NH 3

По одной из версий , название производится от латинского выражения sal ammoniacus («соль Амона»), так как неподалеку от храма Амона в ливийском оазисе Сива можно было добыть хлорид аммония .В очень жарком климате мочевина (NH 2 ) 2 CO, содержащаяся в продуктах жизнедеятельности животных (в частности, караванных верблюдов), разлагается особенно быстро.
Одним из основных продуктов разложения и является аммиак.
Оазис «Аммон»
в Северной Африке

По некоторым другим сведениям, аммиак мог получить современное название от древнеегипетского слова «амониан».
Так называли всех
верующих людей, поклоняющихся богу Амону. Амон ("сокрытый", "потаенный"), в египетской мифологии бог солнца. Священное животное Амона – баран и гусь (оба – символы мудрости). Бога изображали в виде человека (иногда с головой барана), со скипетром и в короне, с двумя высокими перьями и солнечным диском
Люди во время своих ритуальных обрядов нюхали NH 4 Cl, который при нагревании издаёт запах аммиака.
Бог Аммон в образе барана

Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый - химик, академик
Яков Дмитриевич Захаров, который впервые разработал также и систему русской химической номенклатуры.
1781-1852 г .
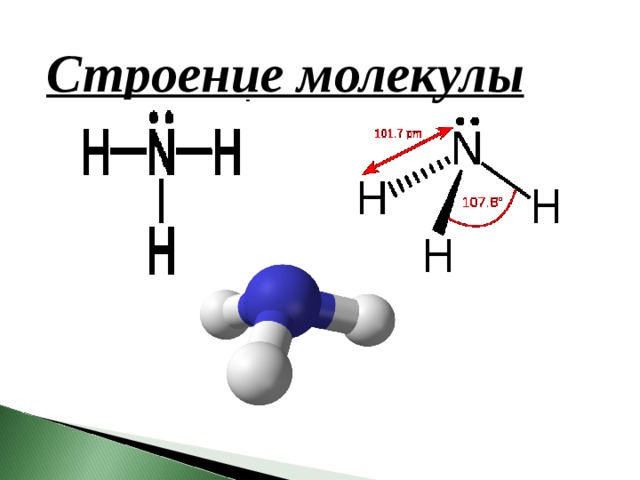
Строение молекулы
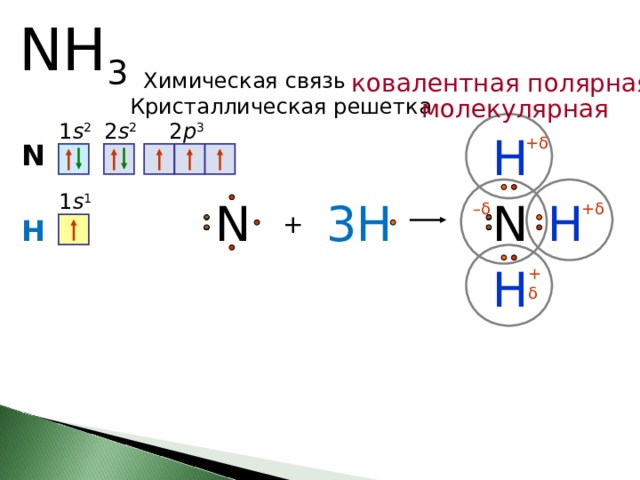
NH 3
ковалентная полярная
Химическая связь
Кристаллическая решетка
молекулярная
1 s 2
2 p 3
2 s 2
H
+ δ
N
1 s 1
N
N
H
3H
– δ
+ δ
+
H
H
+ δ

Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине.
Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электроном трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH 4 +

Физические свойства (при н.у. )
с резким характерным запахом (запах нашатырного спирта)
- легче воздуха (М=17 г/моль)
- хорошо растворяется в воде (1200 объёмов при 0 °C) и 700 объёмов (при 20 °C) в объёме воды
- температура плавления -77.73 °C
- температура кипения -33.34 °C

По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы.

Получение аммиака
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
(NH 4 ) 2 SO 4 + 2NaOH = 2NH 3 ↑ + N a 2 SO 4 + 2H 2 O
Гидроксид аммония - неустойчивое основание, разлагается:
NH 4 OH ↔ NH 3 ↑ + H 2 O
При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха:

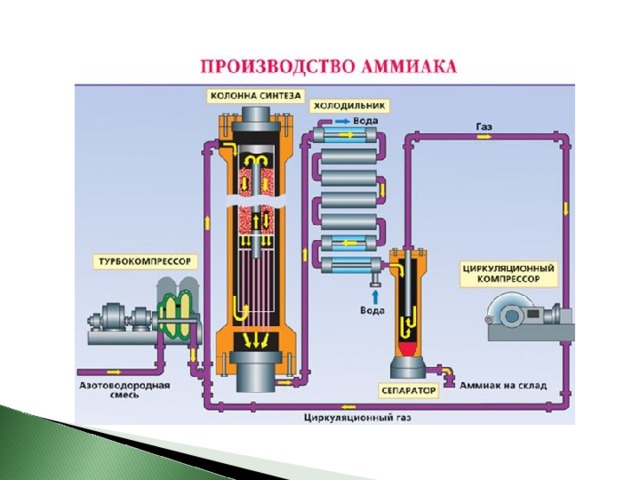
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Условия:
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).

Химические свойства аммиака
Для аммиака характерны реакции:
1) с изменением степени окисления атома азота (реакции окисления);
2) без изменения степени окисления атома азота (присоединение).

Реакции с изменением степени окисления атома азота (реакции окисления)
N -3 → N 0 → N +2
NH3 - сильный восстановитель
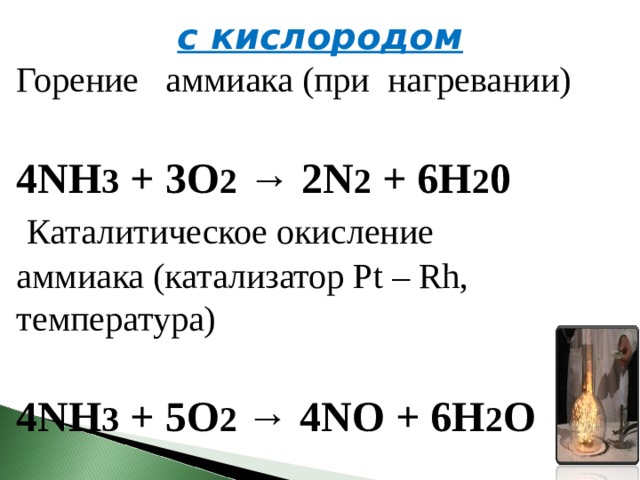
с кислородом
Горение аммиака (при нагревании)
4NH 3 + 3O 2 → 2N 2 + 6H 2 0
Каталитическое окисление аммиака (катализатор Pt – Rh, температура)
4NH 3 + 5O 2 → 4NO + 6H 2 O

с оксидами металлов
2NH 3 +3CuO =3Cu + N 2 +3H 2 O

с сильными окислителями
2NH 3 + 3Cl 2 = N 2 + 6HCl
(при нагревании)

Реакции без изменения степени окисления атома азота (присоединение - образование иона аммония NH 4 +
по донорно-акцепторному механизму
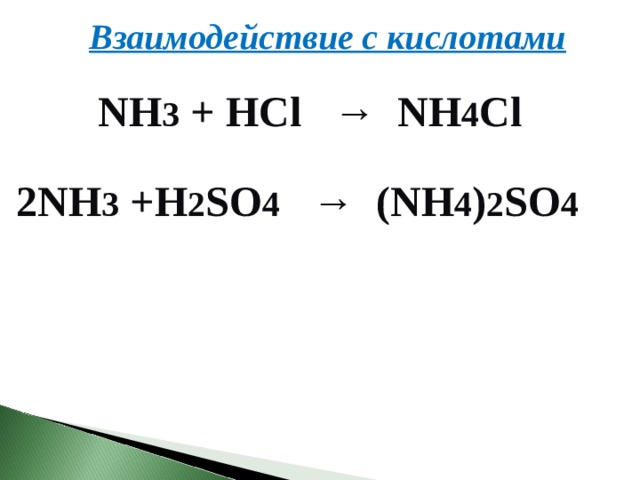
Взаимодействие с кислотами
NH 3 + HCl → NH 4 Cl
2NH 3 +H 2 SO 4 → (NH 4 ) 2 SO 4

Взаимодействие с водой
NH 3 + H 2 O = NH 4 OH
При добавлении фенолфталеина‑ раствор становится малиновым, так как при растворении аммиака частично образуется гидроксид аммония NH 4 OH.

Применение аммиака
волокон
Аммиак используется для
получения синтетических волокон ,
например, найлона и капрона.
2. В составе моющих средств

3. Производство азотных удобрений
4. В сельском хозяйстве

5. Производство азотной кислоты
6. Получение взрывчатых веществ
7. В медицине
Медики используют водные растворы аммиака (нашатырный спирт ) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.

По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH 3 .

Это интересно
- Пары нашатырного спирта способны изменять окраску цветов. Например, голубые и синие лепестки становятся зелеными , ярко красные — черными.
- Облака Юпитера состоят из аммиака.











































