
Вопросы для повторения:
- В чём сущность явления радиоактивности? Кем оно было открыто и исследовано?
- Опишите опыт Резерфорда по исследованию радиоактивного излучения.
- В чём суть атомных моделей Томсона и Резерфорда?
- Опишите и объясните опыт Резерфорда по рассеянию альфа-частиц.

Радиоактивность
Радиоактивность – способность атомов
некоторых химических элементов
к самопроизвольному излучению.
Опыт Резерфорда
Модели атомов

Опыт Резерфорда по рассеянию альфа-частиц

© МОУ Ишненская СОШ
Тема урока
Строение атомного ядра
Автор: Хомченко О.В., учитель физики

Цели урока
- Познакомиться со строением атомного ядра и открытием его составляющих
- Раскрыть сущность понятия «изотопы»

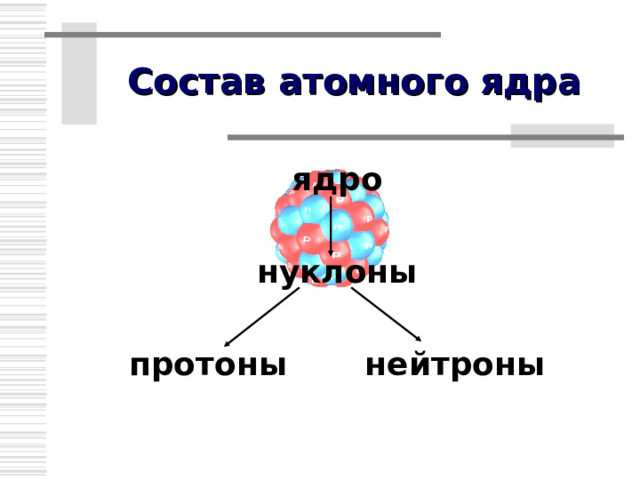
Состав атомного ядра
ядро
нуклоны
протоны нейтроны
![Обозначение состава ядра Массовое число = числу а.е.м. в ядре m я = 56 а.е.м., q я = +26 e Z A X 26 56 Fe Зарядовое число = числу е [ е = 1,6 • 10 -19 Кл ] Число нейтронов: N = A – Z = 56 – 26 = 30](https://fsd.multiurok.ru/html/2023/02/12/s_63e8d132edecc/img8.jpg)
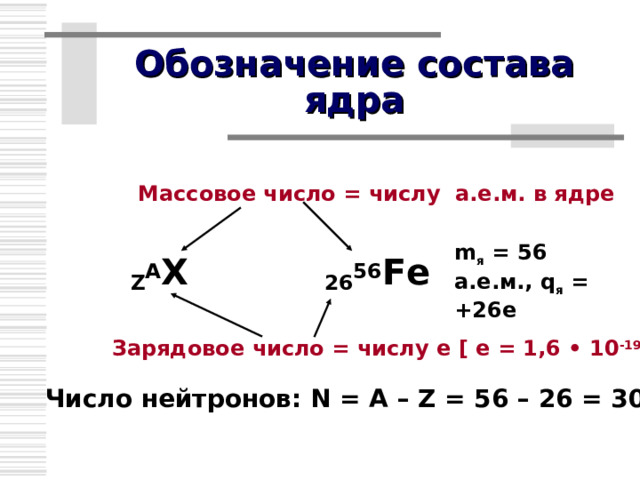
Обозначение состава ядра
Массовое число = числу а.е.м. в ядре
m я = 56 а.е.м., q я = +26 e
Z A X 26 56 Fe
Зарядовое число = числу е [ е = 1,6 • 10 -19 Кл ]
Число нейтронов: N = A – Z = 56 – 26 = 30

Радиоактивные превращения атомных ядер
В 1903 г. Э.Резерфорд и Ф.Содди обнаружили самопроизвольное превращение металла радия в инертный газ радон с испусканием альфа-частицы
88 226 Rd 86 222 Rn + 2 4 He
Δ A = - 4 а.е.м., Δ Z = - 2е
Ядра атомов имеют сложный состав.
Радиоактивность – это способность атомных ядер самопроизвольно превращаться в другие ядра с испусканием частиц (излучения).

Открытие протона
В 1919 г. Резерфорд поставил опыт по исследованию взаимодействия альфа-частиц с ядрами атомов азота, в результате был открыт протон
ядро атома водорода
р + или 1 1 р ( 1 1 Н)
m p = 1 а.е.м., q p = + 1e

Открытие протона
7 14 N + 2 4 He 8 17 O + 1 1 H
Протоны входят в состав ядер атомов всех химических элементов.
Открытие нейтрона
В 1932 г. Дж. Чедвик , исследуя бериллиевое излучение,открыл
нейтрон
n 0 или 0 1 n
m n = 1 а.е.м., q n = 0

Открытие нейтрона
4 9 Ве + 2 4 Не 6 12 C + 0 1 n

Протонно-нейтронная модель ядра
В 1932 г. Д.Д.Иваненко и В.Г.Гейзенберг выдвинули гипотезу о протонно-нейтронном строении ядра: атомные ядра состоят из нуклонов.
Гейзенберг Вернер Карл (1901 – 1976 г.г.)
Протонно-нейтронная модель ядра
Общее число нуклонов в ядре называется массовым и обозначается буквой А .
Число протонов в ядре называется зарядовым и обозначается буквой Z .
Число нейтронов в ядре обозначается буквой N и рассчитывается по формуле N = A – Z .
Зарядовое число равно порядковому номеру химического элемента в периодической системе Д.И. Менделеева.

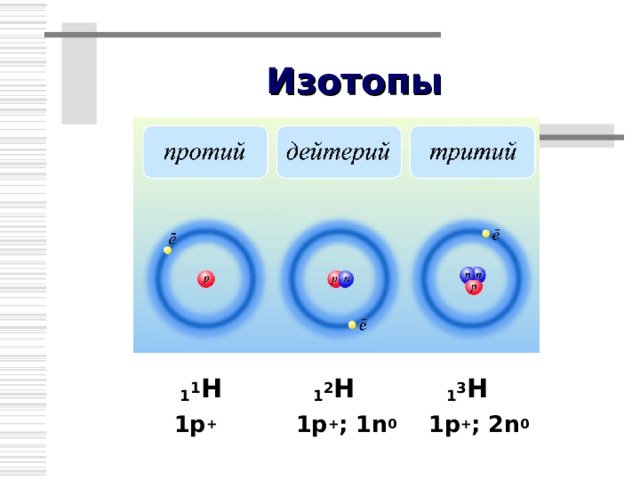
Изотопы
В 1911 г. Ф.Содди предположил, что ядра с одинаковым числом протонов, но разным числом нейтронов являются ядрами одного и того же химического элемента, и назвал их изотопами .
Изотопы – это разновидности данного химического элемента, различающиеся по массе атомных ядер.
Изотопы
1 1 Н 1 2 Н 1 3 Н
1р + 1р + ; 1 n 0 1p + ; 2 n 0

Относительная атомная масса химического элемента
100 атомов Cl
75 атомов 25 атомов
17 35 Cl 17 37 Cl
A r =m ср = 35 а.е.м. · 75 + 37 а.е.м. · 25 / 100= =35,5 а.е.м.
Существование изотопов – причина нецелочисленной А r .

Закрепление изученного
Сборник задач Лукашик
№ 1656
№ 1658
№ 1661
упр. 51 № 3-5, с. 234-235

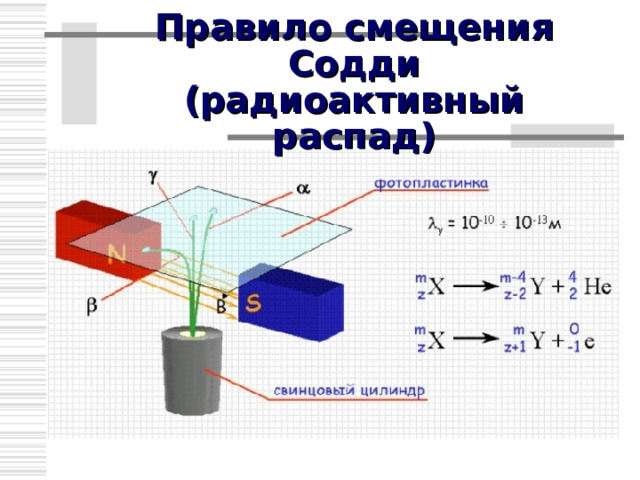
Правило смещения Содди (радиоактивный распад)

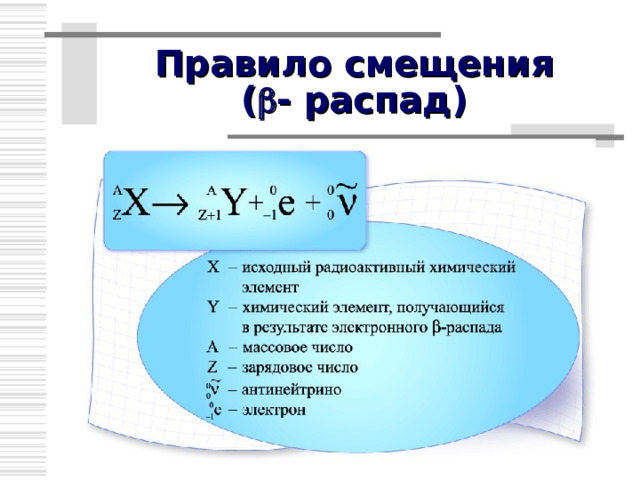
Правило смещения ( - распад)

Правило смещения ( - распад)

Домашнее задание:
§ 67, 69 – 71; вопросы;
упр. 51 № 1, с. 234;
упр. 53 № 2, с. 244 (письменно)
№ 1, 3 (устно).

Домашнее задание:
Повторить § 67, 69 – 71; вопросы;
упр. 51 № 4,5, с. 234;
упр. 52, с. 240;
Р - №1183 (всё письменно).













![Обозначение состава ядра Массовое число = числу а.е.м. в ядре m я = 56 а.е.м., q я = +26 e Z A X 26 56 Fe Зарядовое число = числу е [ е = 1,6 • 10 -19 Кл ] Число нейтронов: N = A – Z = 56 – 26 = 30](https://fsd.multiurok.ru/html/2023/02/12/s_63e8d132edecc/img8.jpg)


























