
Соли:
свойства, получение, применение параграф 17 стр. 78

Проверка домашнего задания
1 . Какие классы веществ вы знаете?
2 . Что такое оксиды?
3. Что такое кислоты ?
Проверка дз
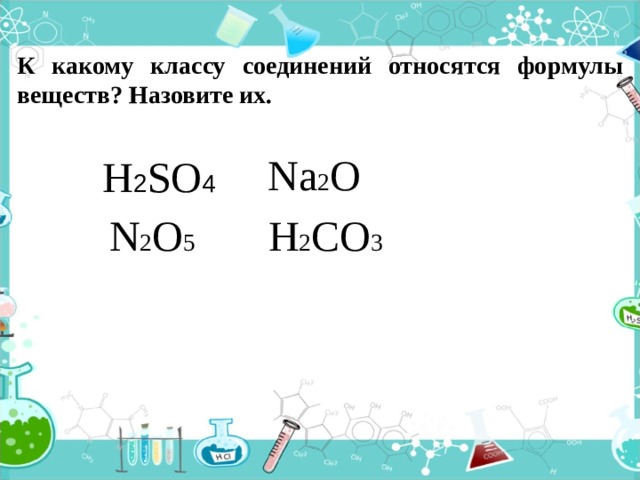
К какому классу соединений относятся формулы веществ? Назовите их.
Na 2 O
H 2 SO 4
H 2 CO 3
N 2 O 5
СЛАЙД 3.

О каком веществе идёт речь?
У травоядных животных потребность в этом веществе велика. В тех странах, где этого вещества мало, люди прибегали к различным способам чтобы ... Меланезийцы каждое утро пили морскую воду, в Новой Зеландии пищу запивали морской водой, в Северной Америке индейские племена высушивали морскую капусту и добавляли её в пищу.

Цели урока:
• н аучить составлять формулы солей и давать им названия;
• узнать классификацию, свойства солей, способы получения и применение солей.

План урока:
1. Что такое соли?
2. Классификация солей.
3. Номенклатура солей.
4. Физические свойства.
5. Химические свойства.
6. Получение.
7. Применение.
8. Некоторые интересные факты.
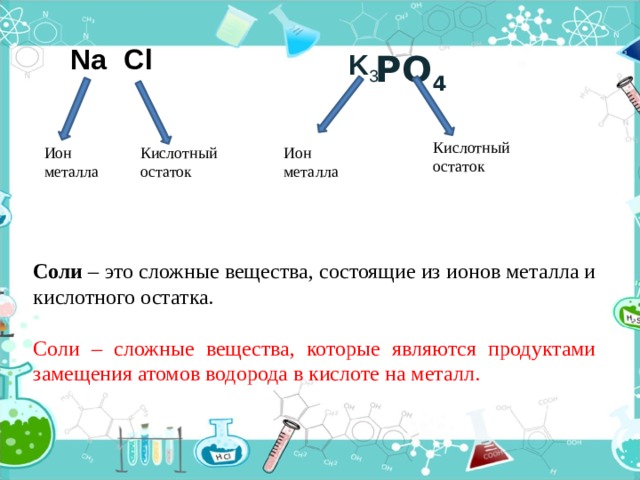
Cl
Na
K 3
PO 4
Кислотный
остаток
Ион
Ион
Кислотный
металла
остаток
металла
Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.
Соли – сложные вещества, которые являются продуктами замещения атомов водорода в кислоте на металл.

Найдите среди формул веществ- формулы солей
CO 2 H 2 SO 4 CaO
BaSO 4 K 2 SO 4 Fe(OH) 3
HCl MgCO 3 H 2 O
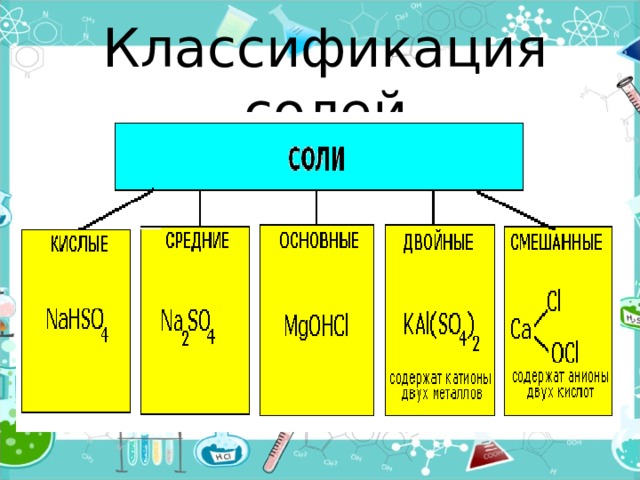
Классификация солей

- Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла (KCl)
- Кислые соли — атомы водорода в кислоте замещены атомами металла частично (NaHCO3)
- Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. ( ( CuOH) 2 CO 3 )

- Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами (KAl(SO 4 ) 2 х12H 2 O)
- Смешанные соли — в их составе присутствует два различных аниона (Ca(OCl)Cl)

Номенклатура средних солей
- Название кислотного остатка
- Наименование металла в родительном падеже
МgСL 2
магния
хлорид

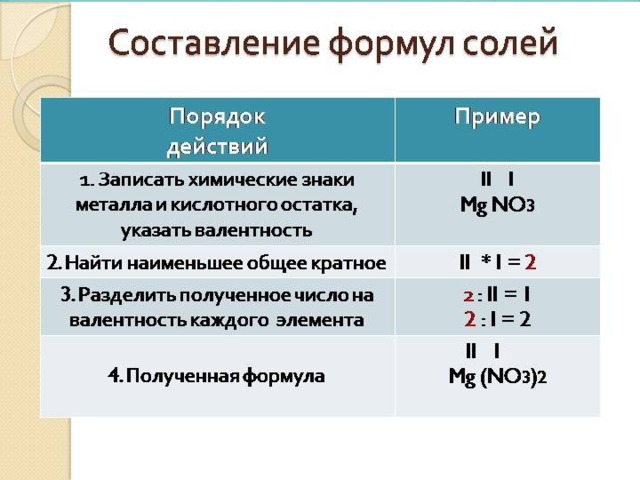
Составить формулы солей:
нитрита магния,
фосфата кальция.
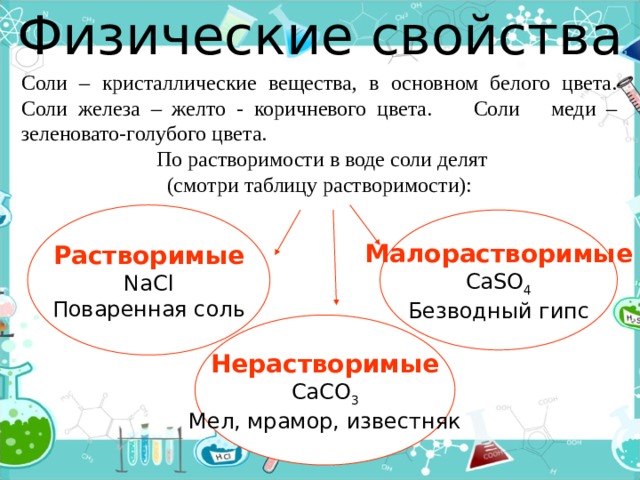
Физические свойства
Соли – кристаллические вещества, в основном белого цвета. Соли железа – желто - коричневого цвета. Соли меди – зеленовато-голубого цвета.
По растворимости в воде соли делят
(смотри таблицу растворимости):
Растворимые
NaCl
Поваренная соль
Малорастворимые
CaSO 4
Безводный гипс
Нерастворимые
CaCO 3
Мел, мрамор, известняк

Химические свойства
1. Взаимодействие с металлами . Каждый левее стоящий металл в ряду напряжений вытесняет последующий из раствора его соли.
Fe + CuCI 2 =Cu + FeCI 2 Fe° + Cu² + + 2CI = Cu° + Fe² + +2CI - Fe° + Cu² + = Cu° + Fe² +
или Fe° – 2e → Fe² + │ процесс окисления (восстановитель) Cu² + + 2e → Cu° │ процесс восстановления (окислитель)

Химические свойства
2. Взаимодействие со щелочами:
В результате обязательно должно образоваться нерастворимое основание.
3. Взаимодействие солей между собой:
2NaОН + CuSO 4 → Cu(OH) 2 + Na 2 SO 4
КСl + AgNO 3 → AgCl + KNO 3
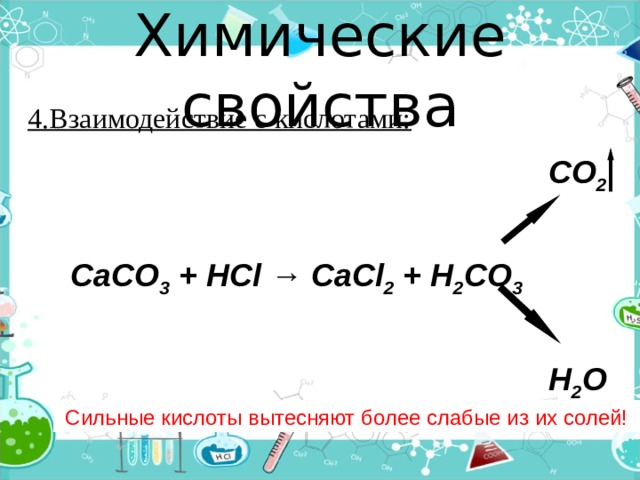
Химические свойства
4.Взаимодействие с кислотами:
CO 2
CaCO 3 + HCl → CaCl 2 + H 2 CO 3
H 2 O
Сильные кислоты вытесняют более слабые из их солей!
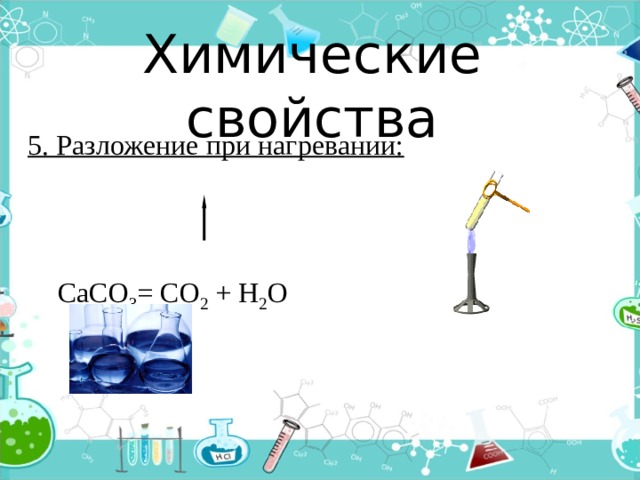
Химические свойства
5. Разложение при нагревании:
СаСО 3 = СО 2 + Н 2 О

Применение солей
- Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды. Хлорид калия используют в сельском хозяйстве как калийное удобрение.

Применение солей
- Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия (соду) применяют в производстве стекла и при варке мыла. Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.

Применение солей
- Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.

Применение солей
- Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.

О соли Мёртвое море

Розовое озеро в Сенегале Это озеро имеет такой цвет из-за большого количества микроорганизмов и полезных ископаемых. Местные женщины проводят до 14 часов в день собирая там соль.

Самое большое солевое озеро в мире расположено на юге пустынной равнины Альтиплано, в Боливии, на высоте около 3700 м. Его площадь составляет 10,5 квадратных километров. В центре толщина соли достигает 10 метров. Это озеро содержит более 10 миллиардов тонн соли. Когда Salar de Uyuni покрывается водой, в нем отражается каждое облако.

Сиквейн
1. В первой строчке тема называется одним словом (обычно существительным). 2. Вторая строчка — это описание темы в двух словах (двумя прилагательными). 3. Третья строчка — это описание действия в рамках этой темы тремя словами (глаголами). 4. Четвертая строка — это фраза из четырех слов, показывающая отношение к теме. 5. Последняя строка — это синоним из одного слова, который повторяет суть темы .

Сиквейн
1. Соль
2. Белая, кристаллическая
3. Солит, удобряет, растворяется
4. Соль наносит вред здоровью
5. Селитра

Домашнее задание
§17, Упр.3

СПАСИБО
ЗА УРОК!
























































