Просмотр содержимого документа
«Презентация к уроку химии на тему Валентность и валентные возможности атомов 11 класс»

Валентные возможности атомов. Степень окисления

Валентность -
- это число химических связей, которое данный атом образует с другими атомами.
- Электроны, принимающие участие в образовании химических связей называют валентными
- Валентные электроны располагаются на внешнем уровне ( для главных подгрупп ) + предвнешнем d-подуровне ( для побочных подгрупп )

Валентность определяется:
1) Числом неспаренных электронов атома
определяем по № группы для главных подгрупп
( В возбужденном состоянии электроны могут распариваться )
2p
2p
2s
2s

Валентность определяется:
1) Числом неспаренных электронов атома
( В возбужденном состоянии электроны могут спариваться )
2s
2p
2s
2p

Валентность определяется:
2) Числом пустых орбиталей
3) наличием неподеленных электронных пар
Механизм образования связи
Обменный
Донорно-акцепторный
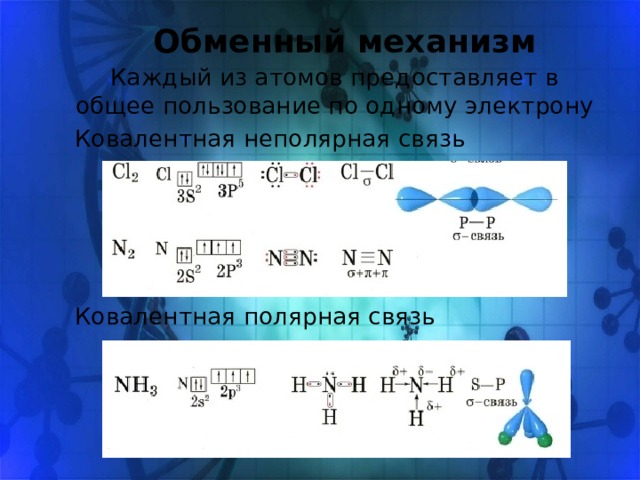
Обменный механизм
Каждый из атомов предоставляет в общее пользование по одному электрону
Ковалентная неполярная связь
Ковалентная полярная связь
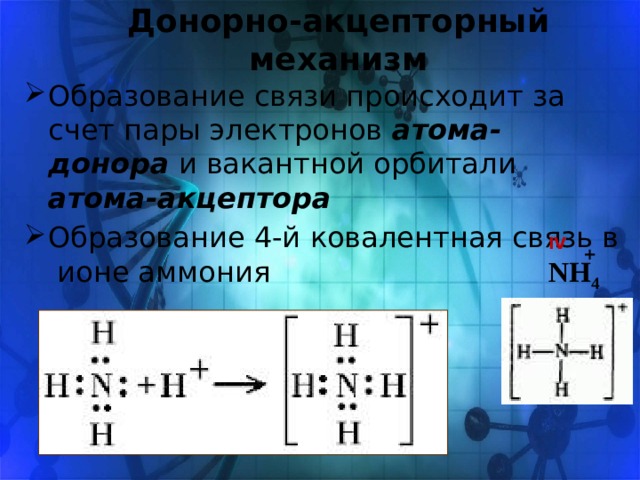
Донорно-акцепторный механизм
- Образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора
- Образование 4-й ковалентная связь в ионе аммония
IV
+
NH 4
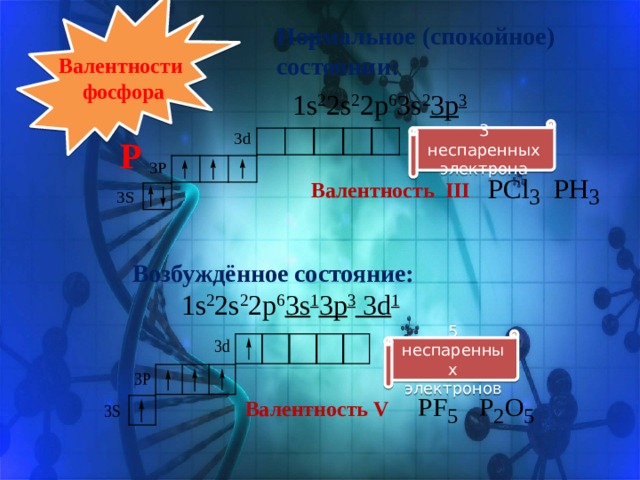
Нормальное (спокойное) состоянии:
Валентности
фосфора
1s 2 2s 2 2p 6 3s 2 3p 3
3 неспаренных
электрона
Р
Валентность III
Возбуждённое состояние:
1s 2 2s 2 2p 6 3s 1 3p 3 3d 1
5 неспаренных
электронов
Валентность V
:
:
:
:
:
:
:
:
:
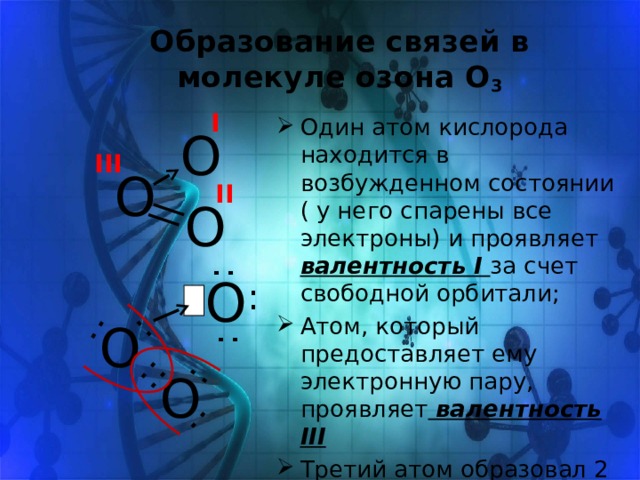
Образование связей в молекуле озона О 3
I
- Один атом кислорода находится в возбужденном состоянии ( у него спарены все электроны) и проявляет валентность I за счет свободной орбитали;
- Атом, который предоставляет ему электронную пару, проявляет валентность III
- Третий атом образовал 2 связи за счет неспаренных электронов, проявляет валентность II
О
III
О
II
О
О
О
О

Степень окисления
- это условный заряд, который бы приобрел атом, если бы все связи в веществе были ионными
- это условный заряд, равный числу частично или полностью, « отданных» или « присоединенных» электронов от одного атома к другому

Степень окисления
1)Численно С.О. совпадает с валентностью, если в веществе нет:
а) Неполярных связей
б)Донорно-акцепторных связей
2) Низшая С.О. неМе определяется :
8-№ группы
3)Высшая С.О. определяется:
по № группы
4) Сумма всех С.О. х.э. = 0
5) С.О. х.э. в простых веществах = 0
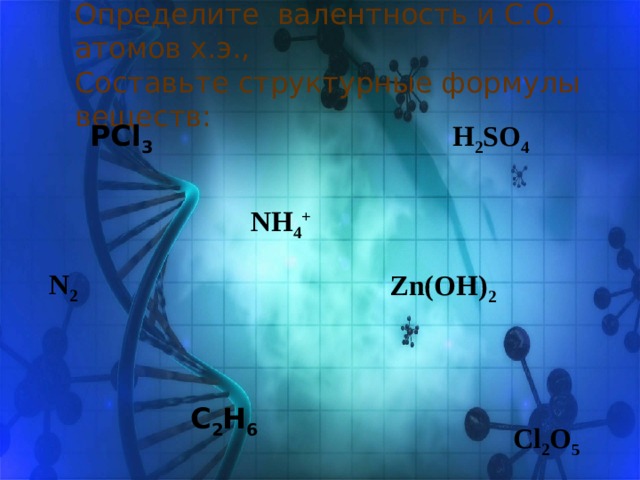
Определите валентность и С.О. атомов х.э., Составьте структурные формулы веществ:
PCl 3
H 2 SO 4
NH 4 +
N 2
Zn(OH) 2
C 2 H 6
Cl 2 O 5
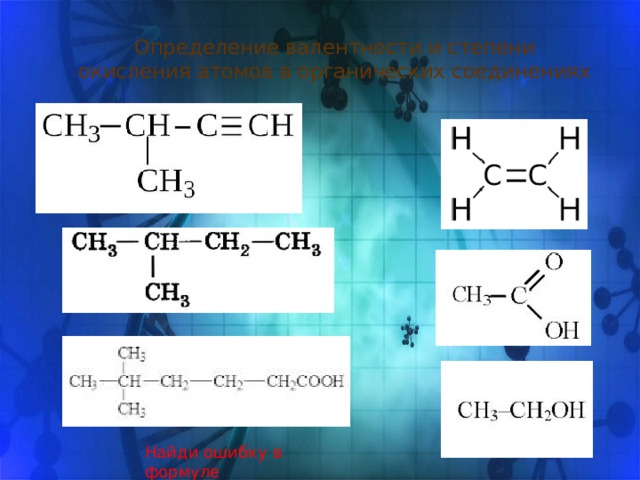
Определение валентности и степени окисления атомов в органических соединениях
Найди ошибку в формуле
Домашнее задание
№ 12,13 стр 22
Задача 3







































