
Общие способы
получения металлов

Общие способы получения металлов
Значительная химическая активность металлов является причиной того, что в земной коре они существуют, как было отмечено ранее, преимущественно в виде соединений — минералов.
Железная руда (Кусок гематитовой ( Fe2O3 ) руды)
Горные породы (скопления минералов), из которых технологически возможно и экономически выгодно извлекать валовым способом металл, называют рудой
Алюминие-вая руда. Боксит
Хромовая руда. Хромит

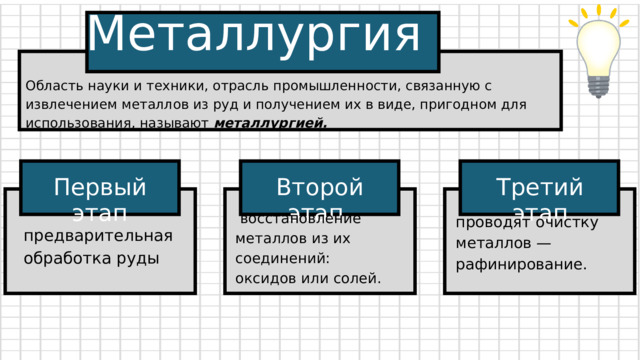
Металлургия
Область науки и техники, отрасль промышленности, связанную с извлечением металлов из руд и получением их в виде, пригодном для использования, называют металлургией.
Чёрная металлургия
Цветная металлургия
отрасль металлургии ; производство железа, чугуна, стали (черных металлов). Для выплавки чёрных металлов требуются железные руды, марганец, хром, коксующийся уголь и другие компоненты. Предприятия черной металлургии располагаются в районах залегания руд или угля либо в портах, куда это сырье ввозится дешевым морским транспортом (приморская металлургия).
отрасль металлургии, которая включает добычу, обогащение руд цветных металлов и выплавку цветных металлов и их сплавов. По физическим свойствам и назначению цветные металлы условно можно разделить на тяжёлые (медь, свинец, цинк, олово, никель) и лёгкие (алюминий, титан, магний). На основании этого деления различают металлургию лёгких металлов и металлургию тяжёлых металлов.
Металлургия
Область науки и техники, отрасль промышленности, связанную с извлечением металлов из руд и получением их в виде, пригодном для использования, называют металлургией.
Второй этап
Первый этап
Третий этап
восстановление металлов из их соединений: оксидов или солей.
проводят очистку металлов — рафинирование.
предварительная обработка руды

Первый этап — предварительная обработка руды
На этом этапе производят обогащение руды — отделение всех ценных минералов от пустой породы.
Если рудой являются сульфиды металла,карбонаты металла (CuFeS2, PbS, ZnS и др.), то такую руду предварительно обжигают в присутствии кислорода для перевода металлов в оксиды:

Второй этап — восстановление металлов из их соединений: оксидов или солей.
Методы восстановления можно разделить на три большие группы: пирометаллургические, электрохимические и гидрометаллургические.
пирометал-лургический
гидрометал-лургический
электрохи-мический
получения металлов (электрометаллургия) предполагает выделение металлов из руд электролизом
получения металлов основаны на восстановлении металлов из их руд при высокой температуре различными веществами с восстановительными свойствами.
это выделение металлов из руд, концентратов и отходов производства с помощью водных растворов определённых веществ (химических реагентов).

На третьем этапе проводят очистку металлов — рафинирование.
Рафинирование металлов — очистка первичных (черновых) металлов от примесей.

Пирометаллургические методы
Пирометаллургические методы получения металлов основаны на восстановлении металлов из их руд при высокой температуре различными веществами с восстановительными свойствами.
Металлотермия
Водородотермия
Карботермия
Кремниетермия

Водородотермия
в качестве восстановителя используется водород
Водородотермия используется для получения малоактивных металлов (медь, вольфрам, молибден)
С помощью водорода нельзя провести реакцию восстановления оксидов очень активных и активных металлов (щелочных, щелочноземельных, алюминия, магния), а также хрома, титана, бериллия

Металлотермия
в качестве восстановителя используется металлы (конкретно алюмотермия, магниетермия и др.)
Методом алюмотермии получают хром, железо, а методом кальциетермии - цезий:
2CsCl + Ca → (t)CaCl2 + 2Cs
Последняя реакция возможна, потому что кальций более тугоплавкий, чем цезий (т. е. цезий более летуч).
Магниетермия используется для получения титана и бе- риллия
TiCl4 + 2 Mg →(t) Ti + 2 MgCl2
BeF2 + Mg →(t) Be + MgF2

Карботермия
Карботермия используется также при производстве чугуна в доменном процессе посредством постепенного восстановления оксида железа (ІІІ).
гематит (Fe2О3)
Основной источник железа — это руды, содержащие такие минералы, как магнетит (Fe3O4) и гематит (Fe2О3). Полезными примесями, улучшающими качество выплавляемого из руды железа, являются соединения Mn, Ni, Co, Сг, В, V. Их называют легирующими добавками. Соединения As, P, S, Pb, Zn — вредные примеси, ухудшающие свойства железа.
магнетит (Fe3O4)

процесс получения железа в составе его сплавов — чугуна и стали.
На первой стадии получают чугун, который на второй стадии перерабатывают в сталь.
1.1
Для этого сверху в доменную печь подается шихта- смесь железной руды, кокса и флюсов (CaCO3, MgCO3), а снизу вдувается воздух или кислород.
Такую смесь вводят в доменную печь сверху, откуда она перемещается вниз в зону более высокотемпературного нагревания(1600 °С) и смесь расплавляется.

процесс получения железа в составе его сплавов — чугуна и стали.
В нижней части печи кокс сгорает с образованием углекислого газа
C + O2 →(t) CO2
в верхней ее части углекислый газ восстанавливается
CO2 + C →(t) 2 CO
Затем протекает процесс постепенного восстановления оксидов железа
В данном процессе образуется также цементит Fe3C :
3 Fe + C → (t)Fe3C

процесс получения железа в составе его сплавов — чугуна и стали.
При переработке чугуна в сталь на второй стадии процесса избыточный углерод, а нередко и другие примеси, например кремния, фосфора, серы, окисляют при высокой температуре кислородом воздуха.
Флюсы взаимодействуют с примесями (соединения Si, P, Ѕ) и превращаются в легкоплавкие шлаки, которые всплывают на поверхность расплавленного железа:
SiO2 + CaCO3 = (t)CaSiO3 + CO2↑,
P₂O₃ + 3CaCO3 = (t)Ca3(PO4)2 + 3CO2↑
Полученный чугун перерабатывают в сталь, выжигая избыточный углерод кислородом в мартеновских печах, конвертерах или электропечах.

процесс получения железа в составе его сплавов — чугуна и стали.
2
Второй способ производства стали одностадийный, его называют прямым . В нём стадия получения чугуна отсутствует, меньше выброс углекислого газа в атмосферу. Являясь более экономичным, он постепенно вытесняет первый способ.
В качестве восстановителя используют смесь метана, оксида углерода(II) и водорода. Водород и оксид углерода(II) образуются из метана при его окислении кислородом в присутствии катализатора в специальных аппаратах по реакции:

процесс получения железа в составе его сплавов — чугуна и стали.
2
Образование металлического железа можно представить уравнениями реакций:
Полученное при восстановлении губчатое железо (окатыши) подвергают переплавлению в электродуговых печах. При этом, вводя необходимые добавки, железо легируют для получения того или иного сорта высококачественных сталей — коррозионностойких, инструментальных, конструкционных, электротехнических, жаропрочных и др.

Самоконтроль
1. Верными являются утверждения:
а) металлургия — это и область науки, и отрасль промышленности;
б) обогащение руды — это отделение определённых минералов от пустой породы;
в) при обжиге руды образуются, как правило, соли;
г) наиболее распространённые в металлургии восстановители — С, СО, Н2, электрический ток.

Самоконтроль
1. Верными являются утверждения:
а) металлургия — это и область науки, и отрасль промышленности;
б) обогащение руды — это отделение определённых минералов от пустой породы;
в) при обжиге руды образуются, как правило, соли;
г) наиболее распространённые в металлургии восстановители — С, СО, Н2, электрический ток.

Самоконтроль
2. Восстановление железа возможно в случае взаимодействия:
а) Fe3O4 и HCl;
б) Fe2O3 и C;
в) FeO и H2;
г) Fe2O3 и СаО.

Самоконтроль
2. Восстановление железа возможно в случае взаимодействия:
а) Fe3O4 и HCl;
б) Fe2O3 и C;
в) FeO и H2;
г) Fe2O3 и СаО.

Самоконтроль
Задания с развёрнутым ответом.
1. Напишите уравнения реакций, с помощью которых
можно осуществить превращения:
Cu → Cu(NO 3 ) 2 → Cu(OH) 2 → Х → Сu → CuSO 4
Укажите условия протекания реакций.
2. Даны вещества: алюминий, оксид марганца (IV),
водный раствор сульфата меди и концентриро-
ванная соляная кислота.
Напишите уравнения четырёх возможных реакций
между этими веществами.

Самоконтроль
Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
ВОДНОГО РАСТВОРА
А) AgF 1) Ag, F 2
Б) NaNO 3 2) Ag, O 2 , HF
B) Pb(NO 3 ) 2 3) H 2 , O 2
Г) NaF 4) Pb, O 2 , HNO 3
5) H 2 , NO 2 , O 2
6) NaOH, H 2 , F 2







































