
Теория электролитической диссоциации.

Классификация веществ
XIX век, М. Фарадей
Вещества
Электролиты - вещества, растворы
которых проводят электрический ток.
(NaCl, CH 3 COOH и др. - проводники 2 рода, металлы - это проводники 1 рода)
Неэлектролиты - вещества, растворы которых не проводят электрический ток ни в твердом, ни в растворенном виде
(сахар, этиловый спирт)

Понятие электролитической диссоциации
Электролитическая диссоциация - процесс распада молекул электролита на ионы в растворе или расплаве.
1887 г. - Сванте Аррениус –
Теория электролитической диссоциации

Схема диссоциации веществ с ионной связью
+
-
+
+
-
+
-
+
-
-
+
-
+
-
Na +
Cl -
Na +
Cl -
Cl -
Na +
Na +
Cl -
Na +
около ионов кристалла

Схема диссоциации веществ с ионной связью
+
+
-
+
-
+
-
+
-
+
-
-
+
-
Na +
Cl -
Na +
Cl -
Cl -
Na +
Na +
Cl -
Na +
около ионов кристалла
- Гидратация (взаимодействие)
молекул воды с ионами кристалла
3. Диссоциация
Уравнение диссоциации хлорида натрия:
NaCl ⇄ Na + + Cl -
5

Схема диссоциации веществ с ковалентной
полярной связью
+
-
+
-
+
+
-
-
+
-
+
-
+
+
-
+
-
-
+
+
-
+
-
+
-
+
-
+
-
-
+
-
-
+
около полюсов электролита
(взаимодействие)
молекул воды с электролитом
- Ионизация молекул электролита
- Диссоциация (распад) кристалла электролита на гидратированные ионы
H +
Cl -
Н + Cl -
H +
Cl -
Уравнение диссоциации соляной кислоты:
НCl ⇄ Н + + Cl -

Ассоциация – объединение ионов
(процесс обратный диссоциации)
HCl H + + Cl -
Степень электролитической диссоциации - отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе.
⇄
α =
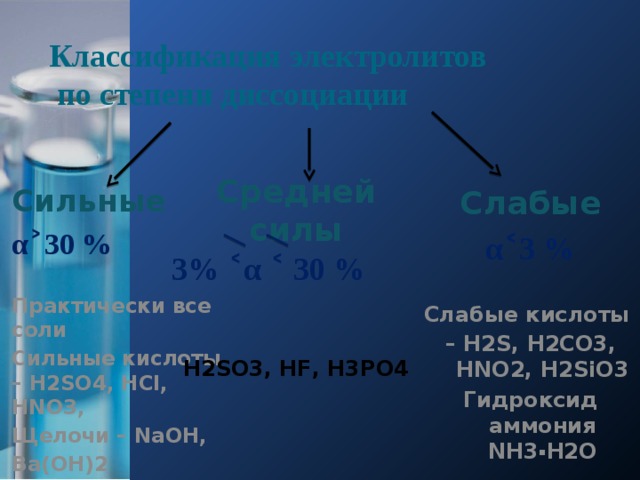
Классификация электролитов по степени диссоциации
Средней силы
3% ˂α ˂ 30 %
Слабые
α˂3 %
Слабые кислоты
H2SO3, HF, H3РO4
– H2S, H2CO3, HNO2, H2SiO3
Гидроксид аммония NH3 ▪ H2O
Сильные
α˃30 %
Практически все соли
Сильные кислоты – H2SO4, HCl, HNO3,
Щелочи – NaOH,
Ba(OH)2

Значение электролитов
- Электролиты – составная часть жидкостей и плотных тканей живых организмов.
- Ионы Na + ,K + ,Ca 2+ ,Mg 2+ ,H + ; OH - ; Cl - ; SO 4 -2 имеют большое значение для физиологических и биохимических процессов:
- ионы H + ; OH - играют большую роль в работе ферментов, обмене веществ, переваривании пищи и др.
- при нарушении водно-солевого обмена в медицине применяется физиологический раствор – 0,85% NaCl;
- ионы I - влияют на работу щитовидной железы.

Положения ТЭД
Основные положения теории электролитической диссоциации
- Ионы – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в результате отдачи или присоединения электронов.
Классификация
Ионы
простые сложные
Cl - , Na + NH 4 + , SO 4 -
2. Причина диссоциации – гидратация ионов.
Ионы
(по наличию водной оболочки)
Гидратированные Негидратированные
(кристаллогидраты) (безводные соли)
3. Постоянный электрический ток вызывает направленное движение ионов
Ионы
(по знаку заряда)
катионы анионы
(положительно (отрицательно заряженные заряженные частицы) частицы)
1. При растворении в воде электролиты диссоциируют (распадаются) ионы.
4. Не все электролиты в одинаковой мере диссоциируют на ионы
Электролиты
(по степени диссоциации)
сильные слабые
5. Электролитическая диссоциация – процесс обратимый.
HNO 2 ↔ H + + NO 2-
Ca(OH) 2 ↔ Ca 2+ + 2OH -
6. Свойства электролитов = свойства ионов.
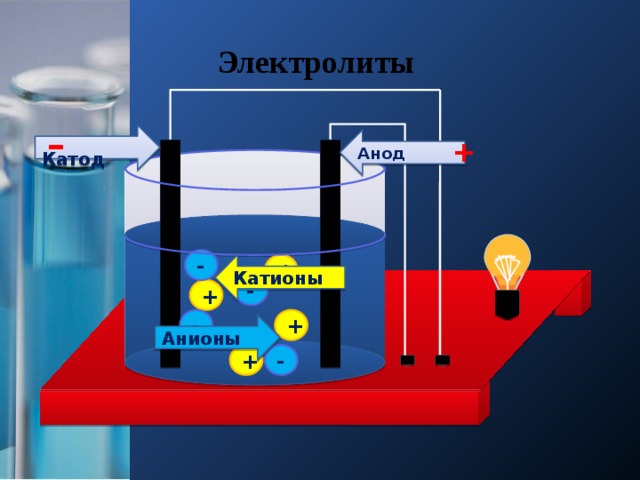
Электролиты
Катод
Анод
-
+
-
Катионы
+
-
+
-
+
Анионы
+
-
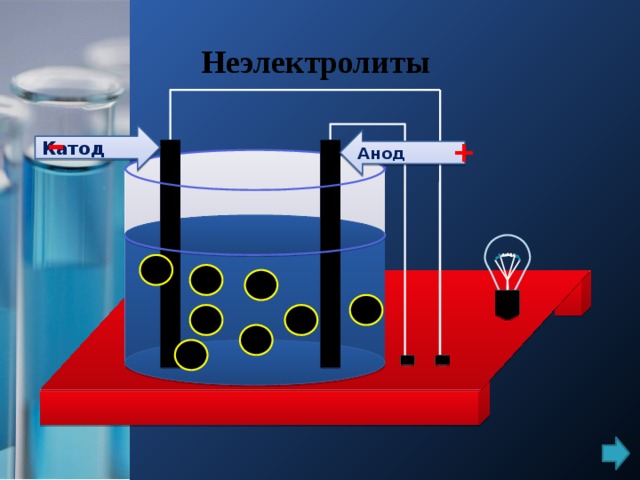
Неэлектролиты
Катод
Анод
-
+

Механизм диссоциации
- HCl = H + + Cl -
- HNO 3 = H + + NO 3 -
Кислоты – электролиты, которые при диссоциации образуют только катионы водорода и анионы кислотного остатка

Механизм диссоциации
- NaOH = Na + + OH -
- Ca(OH) 2 = Ca 2+ + 2 OH -
Основания – электролиты, которые при диссоциации образуют катионы металла и только гидроксид-анионы.

Механизм диссоциации
- Na 2 SO 4 = 2Na + + SO 4 2-
- NH 4 Cl = NH 4 + + Cl -
Соли (средние) – электролиты, которые при диссоциации образуют катионы металлов и анионы кислотных остатков

СПАСИБО ЗА РАБОТУ НА УРОКЕ.































