Просмотр содержимого документа
«Презентация к уроку химии в 9 классе на тему "Соли аммония"»

Соли аммония
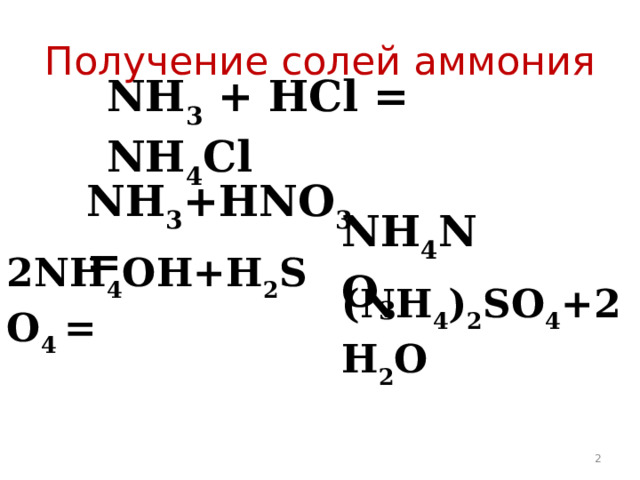
Получение солей аммония
NH 3 + Н Cl = NH 4 Cl
NH 3 +HNO 3 =
NH 4 NO 3
2 NH 4 OH+H 2 SO 4 =
(NH 4 ) 2 SO 4 +2H 2 O

- Будут ли соли аммония проявлять характерные свойства класса солей? Какие?
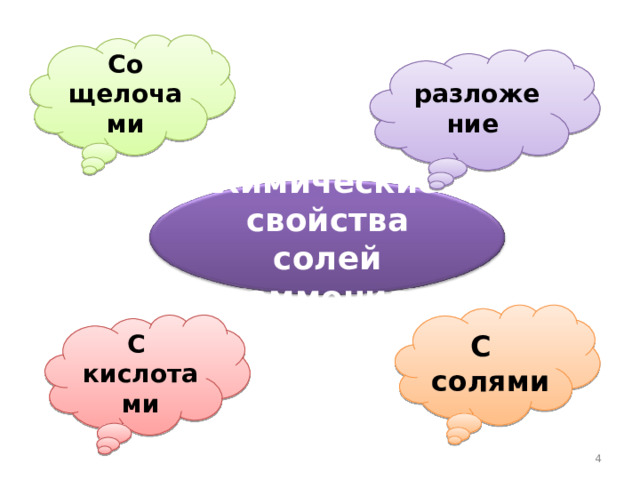
Со щелочами
разложение
Химические свойства солей аммония
С солями
С кислотами
4
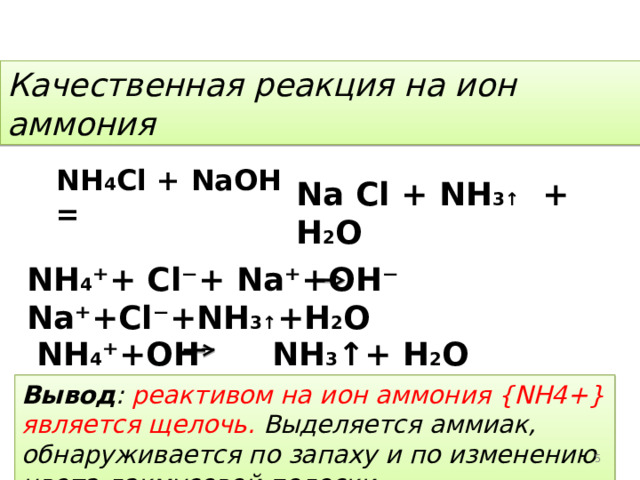
Качественная реакция на ион аммония
NH 4 Cl + NaOH =
Na Cl + NH 3↑ + H 2 O
NH 4 ⁺ + Cl ⁻ + Na ⁺ +OH ⁻ Na⁺+Cl⁻+NH 3↑ +H 2 O
NH 4 ⁺ +OH ⁻ NH 3 ↑+ H 2 O
Вывод : реактивом на ион аммония { NH 4+} является щелочь. Выделяется аммиак, обнаруживается по запаху и по изменению цвета лакмусовой полоски.
4
 NH 4 ⁺ + Cl⁻ + Ag⁺ + N O 3 ⁻ =NH 4 ⁺+ NO 3 ⁻ +AgCl↓ Cl⁻ + Ag⁺ =AgCl↓ 4 4 " width="640"
NH 4 ⁺ + Cl⁻ + Ag⁺ + N O 3 ⁻ =NH 4 ⁺+ NO 3 ⁻ +AgCl↓ Cl⁻ + Ag⁺ =AgCl↓ 4 4 " width="640"
Взаимодействие с солями
NH 4 NO 3 + AgCl↓
NH 4 Cl + AgNO 3 =
NH 4 ⁺ + Cl⁻ + Ag⁺ + N O 3 ⁻ =NH 4 ⁺+ NO 3 ⁻ +AgCl↓
Cl⁻ + Ag⁺ =AgCl↓
4
4
 СО 2 ↑ + Н 2 О + 2 NH 4 Cl 2 NH 4 ⁺+CO 3 2 ⁻ + 2 Н ⁺ + 2 Cl ⁻ =СО 2 ↑ + Н 2 О+ 2 NH 4 ⁺ + 2 CL ⁻ CO 3 ⁻ + 2 Н ⁺ +=СО 2 ↑ + Н 2 О 4 " width="640"
СО 2 ↑ + Н 2 О + 2 NH 4 Cl 2 NH 4 ⁺+CO 3 2 ⁻ + 2 Н ⁺ + 2 Cl ⁻ =СО 2 ↑ + Н 2 О+ 2 NH 4 ⁺ + 2 CL ⁻ CO 3 ⁻ + 2 Н ⁺ +=СО 2 ↑ + Н 2 О 4 " width="640"
Взаимодействие с кислотами
(NH 4 ) 2 СO 3 + 2 НCl=
СО 2 ↑ + Н 2 О + 2 NH 4 Cl
2 NH 4 ⁺+CO 3 2 ⁻ + 2 Н ⁺ + 2 Cl ⁻ =СО 2 ↑ + Н 2 О+ 2 NH 4 ⁺ + 2 CL ⁻
CO 3 ⁻ + 2 Н ⁺ +=СО 2 ↑ + Н 2 О
4
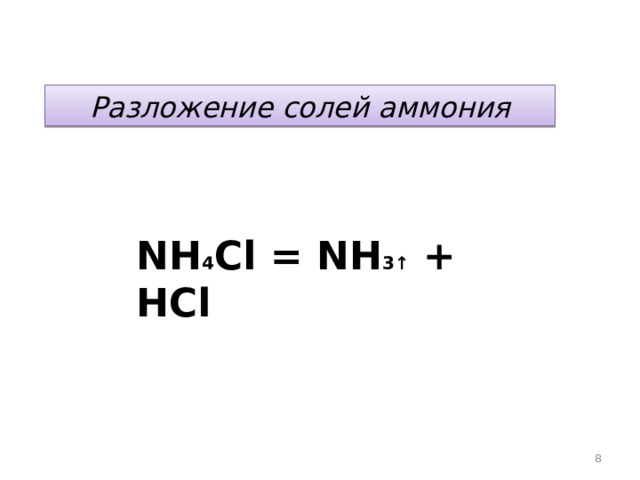
Разложение солей аммония
NH 4 Cl = NH 3↑ + НCl
4

4
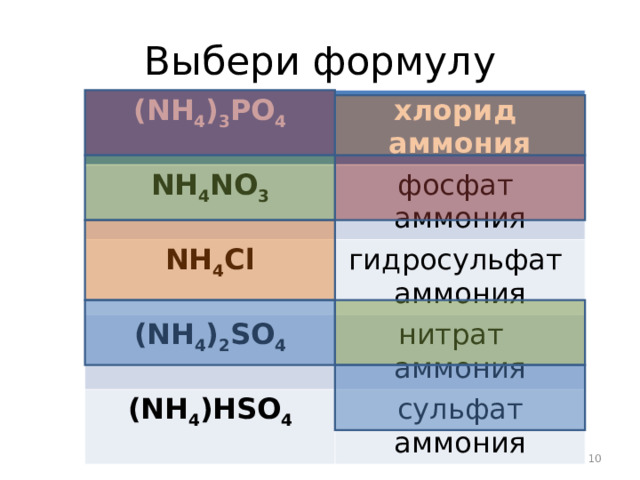
Выбери формулу
( NH 4 ) 3 P О 4
хлорид аммония
NH 4 NO 3
фосфат аммония
NH 4 Cl
гидросульфат аммония
( NH 4 ) 2 SO 4
нитрат аммония
( NH 4 )Н SO 4
сульфат аммония

«Да» или «нет»
НЕТ
1)Ион аммония имеет заряд -1
2) Соли аммония белые кристаллические вещества
3) Все соли аммония хорошо растворимы в воде
4)Дыма без огня не бывает
5)Соли аммония обладают всеми свойствами солей
6)Ион аммония имеет форму пирамиды
7)степень окисления азота в ионе аммония -4
8)Соли аммония можно определить действием щёлочи
9) Аммиак не имеет характерного запаха
10) соли аммония – минеральные удобрения
11)нашатырный спирт – это раствор аммиака в воде
ДА
ДА
НЕТ
ДА
ДА
НЕТ
ДА
НЕТ
ДА
ДА

Задачи:
- 1. Какую массу серной кислоты необходимо ввести в реакцию с аммиаком ,чтобы получить 63,36г сульфата аммония с выходом 80%
- 2.Аммиак пропускали через 756г 50%-ного раствора азотной кислоты. Сколько граммов нитрата аммония может быть получено, если практический выход соли составляет 95% от теоретического
- 3.Сколько граммов аммиака требуется для получения сульфата аммония массой 35,64г, если выход составляет 90% от теоретического. Какой объем занимает такое количество аммиака.












 NH 4 ⁺ + Cl⁻ + Ag⁺ + N O 3 ⁻ =NH 4 ⁺+ NO 3 ⁻ +AgCl↓ Cl⁻ + Ag⁺ =AgCl↓ 4 4 " width="640"
NH 4 ⁺ + Cl⁻ + Ag⁺ + N O 3 ⁻ =NH 4 ⁺+ NO 3 ⁻ +AgCl↓ Cl⁻ + Ag⁺ =AgCl↓ 4 4 " width="640"
 СО 2 ↑ + Н 2 О + 2 NH 4 Cl 2 NH 4 ⁺+CO 3 2 ⁻ + 2 Н ⁺ + 2 Cl ⁻ =СО 2 ↑ + Н 2 О+ 2 NH 4 ⁺ + 2 CL ⁻ CO 3 ⁻ + 2 Н ⁺ +=СО 2 ↑ + Н 2 О 4 " width="640"
СО 2 ↑ + Н 2 О + 2 NH 4 Cl 2 NH 4 ⁺+CO 3 2 ⁻ + 2 Н ⁺ + 2 Cl ⁻ =СО 2 ↑ + Н 2 О+ 2 NH 4 ⁺ + 2 CL ⁻ CO 3 ⁻ + 2 Н ⁺ +=СО 2 ↑ + Н 2 О 4 " width="640"























