
Подготовила
Левченко С.П.
учитель химии
ГБУ ОО ЗО "КОНСТАНТИНОВСКАЯ СОШ №2 ИМ. ГЕРОЯ СОВЕТСКОГО СОЮЗА П.Т.ОДИНЦА" Г.О.МЕЛИТОПОЛЬ

Дать общую характеристику щелочным металлам.
Рассмотреть их электронное строение, сравнить физические и химические свойства.
Узнать о важнейших соединениях металлов и их тривиальных названиях.
Определить области применения этих соединений.

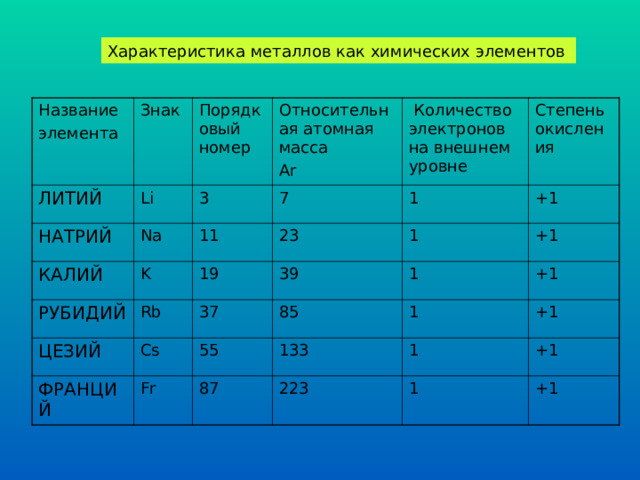
Характеристика металлов как химических элементов
Название
элемента
Знак
ЛИТИЙ
Порядковый номер
Li
НАТРИЙ
КАЛИЙ
Относительная атомная масса
Ar
3
Na
Количество электронов на внешнем уровне
7
K
11
РУБИДИЙ
19
23
1
Степень окисления
Rb
ЦЕЗИЙ
1
+1
39
Cs
37
ФРАНЦИЙ
+1
1
Fr
85
55
+1
1
133
87
223
+1
1
+1
1
+1


- В 1807 г. в Англии Г. Деви открыл натрий и калий.
«Натрун» - сода, «алкали» - щелочь.
- В 1817г. в Швеции А. Арфедсоном был открыт литий.
«Литос» - камень.
- В 1860 – 1861г.г. в Германии Р.Бунзен и Г.Кирхгоф открыли рубидий «темно-красный» и цезий «небесно-голубой».
- В 1939г. во Франции М. Пере открыл радиоактивный элемент франций, который назвал в честь своей страны – Франции.
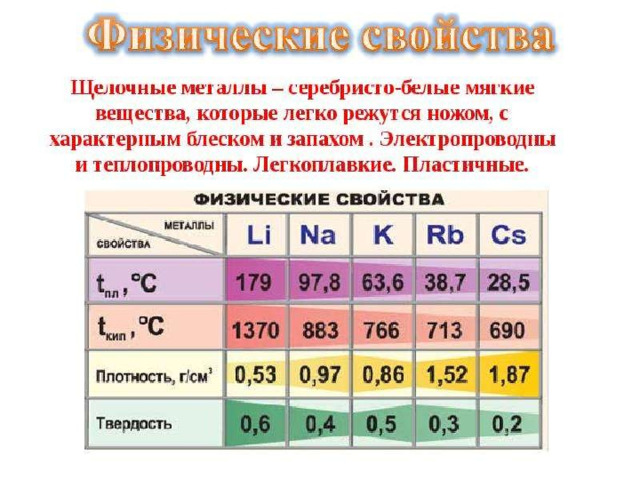

Плотность металлов
Температура плавления
Li- 0,534 г/см 3
Na- 0,971 г/см 3
K - 0,863 г/см 3
Rb – 1,532 г/см 3
Cs - 2,44 г/см 3
Li - 180 о С
Na - 98 о С
K - 64 о С
Rb - 39 о С
Cs - 27 о С

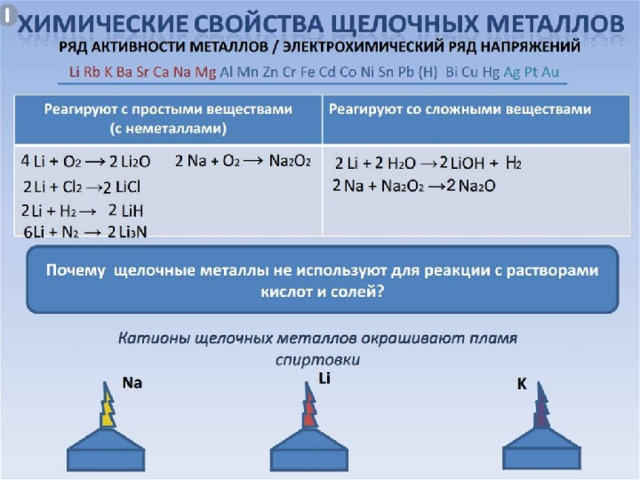

2Na + 2Н 2 О = 2NaОН + Н 2
( Li - спокойно, Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н 2
Rb и Cs реагируют не только
с жидкой Н 2 О , но и со льдом. .
2Na+ Н 2 S О 4 = Na 2 S О 4 + Н 2
(протекают очень бурно)








Самые распространенные соединения металлов и их применение
Используют для очистки нефтепродуктов, производства бумаги, мыла, волокон, стекла, удобрений. Применяют в медицине и фармакологии.
NaOH – едкий натр, каустическая сода.
KOH - едкое кали.
Na 2 CO 3 10H 2 O – кристаллическая сода.
NaHCO 3 – пищевая сода.
K 2 CO 3 - поташ.
Na 2 SO 4 10H 2 O – глауберова соль.
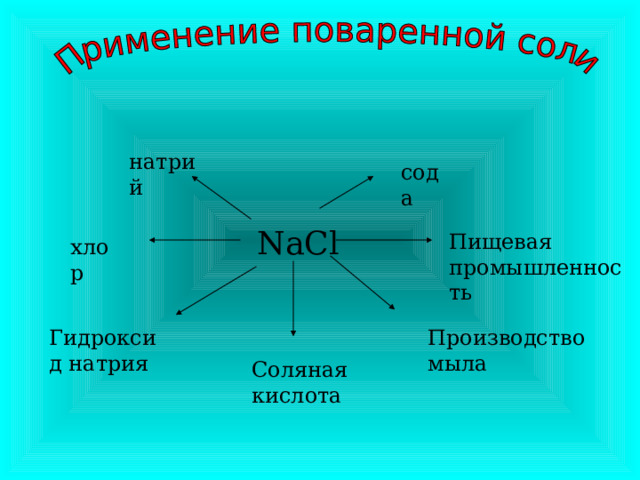
натрий
сода
NaCl
Пищевая промышленность
хлор
Гидроксид натрия
Производство мыла
Соляная кислота

Na + - внутриклеточный ион, содержится в крови и лимфе, создает в клетках осмотическое давление.
K + - внеклеточный ион, поддерживает работу сердца и мышц.
Большое количество калия содержится в кураге, сои, фасоли, зеленом горошке, черносливе, изюме.

Задание №1.
Определите «лишний» элемент в ряду.
А) Fr, K, Cu, Na ;
Б) P, Li, O, Cl ;
В) Al, Ag, Ra, Cs .
Объясните свой выбор.

1.Какой металл при взаимодействии с водой образует щелочь?
Si
Na
Cu
Cs
Fr
Li
Zn
Pb
K
2. Определите электронные формулу щелочных металлов.
4s 2
3s 1
1s 1
2s 2
6s 1
3s 2 3p 1
2s 1
4s 1
6s 2

Вариант - 1
Вариант - 2
1.Соединение Na2SO410H 2 O называется
1) глауберова соль 2) поваренная соль
2) пищевая сода 4) поташ
2. Разъедает ткани и бумагу. Используется при производстве мыла и волокон
1) Na 2 CO 3 10 H 2 O 2 ) Na 2 SO 4 10H 2 O
3) NaCl 4) NaOH
3. Предложил назвать калий от арабского алкали - щелочь
1)Й. Берцеллиус 2) И. Арфведсон
3) Г.Деви 4) Г.Агрикола
4. Цвет пламени, в который его окрашивают ионы калия
1) желтый 2) фиолетовый
3) красный 4) зеленый
5. В 100 г изюма содержится 3,055 г калия. Сколько изюма нужно съесть, чтобы получить суточную норму калия (5 г/сутки)?
1) 0,15 г 2) 164 г 3) 61,5 г 4) 305 г
1.Соединение NaOH называется
1) каустическая сода, 2) кристаллическая сода,
3) питьевая сода, 4) поташ.
2.Используется в производстве стекла, бумаги, мыла
1) Na 2 CO 3 10 H 2 O 2 ) Na 2 SO 4 10H 2 O
3) NaCl 4) NaOH
3. Предложил назвать литием от греческого слова литос – камень
1)Й. Берцеллиус 2) И. Арфведсон
3) Г.Деви 4) Г.Агрикола
4. Цвет пламени, в который его окрашивают ионы натрия
1) желтый 2) фиолетовый
3) красный 4) зеленый
5. В 100 г фасоли содержится 1,075 г калия. Сколько фасоли нужно съесть, чтобы получить суточную норму калия (5 г/сутки)
1) 465 г 2)0,053 г 3)107 г 4)21,5 г

Рефлексия
Мне было понятно (не понятно) …
Мне было интересно (не интересно), потому что…
Сегодня на уроке я узнал(а)…
Я хотел(а) бы продолжить изучение вопроса …
Рефлексия
Мне было понятно (не понятно) …
Мне было интересно (не интересно), потому что…
Сегодня на уроке я узнал(а)…
Я хотел(а) бы продолжить изучение вопроса …

1.П.30, зад.3 (в)- (письменно), стр.159.
2.Подг. презентацию о применении щелочных металлов и их соединений



















































