
Что объединяет объекты на слайде между собой?

Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа №2 г. Щигры Курской области»
Тема урока «Кремний и
его соединения»
Подготовила учитель химии Ерохина Е.Н.

Знаете ли вы, что…
Название «кремний» (от греческого кремнос «утес, скала») введено в 1834 г. русским химиком Германом Ивановичем Гессом
Название силициум происходит
от лат. силекс - кремень

Кремний – химический элемент


1. Положение в ПСХЭ:
период III; группа IV, подгруппа главная;
2. Строение атома
Заряд ядра: +14 Si;
Относительная атомная масса: Ar (Si)=28
Cостав атома: p=14, e=14, n=28 - 14 =14
Электронная формула: +14 Si 2e;8e;4e;
+14 Si 1s 2 2s 2 2p 6 3s 2 3p 2

3. Свойства атома Si - неметалл
Si 0
- 4е
Si +4 SiO 2 H 2 SiO 3
восстановитель
+ 4е
Si -4 Ca 2 Si SiH 4
окислитель
Кремний, отдавая все внешние электроны более ЭО элементам, окисляется, переходя в Si +4
Принимая 4 электрона на свой внешний энергетический уровень, восстанавливается до Si -4

Сравнение свойств атомов углерода и кремния по выраженности неметаллических свойств и окислительной способности

4. Кремний в природе
Кремний в свободном виде в природе не встречается.
Кремний – второй по распространенности элемент ПСХЭ.
В природе встречается в
виде кремнезема (SiO 2 ), силикатов и алюмосиликатов.

Кремень
Кремень, именно этот
невзрачный и очень
прочный камень,
положил
начало каменному
веку – веку
кремниевых орудий труда.
Причиы:
- распространенность и доступность кремнезема;
- способность образовывать при сколе острые режущие края

Разновидности минералов на основе оксида кремния
Опал
Кварц
Агат
Горный
Цитрин
хрусталь
Сердолик
Яшма
Кошачий
Аметист
глаз

Кремний входит и в состав низших живых организмов – диатомовых водорослей и радиолярий, - нежнейших комочков живой материи, которые создают свои непревзойденные по красоте скелеты из кремнезема.
Радиолярии
Диатомовые водоросли

Кремний в продуктах питания
Кремний придаёт гладкость и прочность костям и кровеносным сосудам человека.
В организме человека кремния менее 0,01% по весу.

Кремний – простое вещество

1. Аллотропные модификации кремния

Аморфный кремний

Кристаллический кремний

2. Кристаллическая структура кремния
Атомная кристаллическая решетка кремния кубическая
гранецентрированная, как у алмаза.
Но из-за большей длины связей между Si – Si, твердость кремния значительно меньше, чем алмаза.
Кремний хрупок, плавится только при нагревании выше 800 0 С.

3. Физические свойства кремния
Кристаллический кремний – вещество серовато – стального цвета с металлическим блеском, твердое, но хрупкое.
Аморфный кремний – бурый порошок.
р = 2,33 г/см 3 ; t пл. = 1415 0 С; t кип. = 3500 0 С

Знаете ли вы, что…
В впервые кремний был выделен
в 1811 году французскими учеными, но он был сильно загрязнен примесями
Луи Жак Тенор
Жозеф Луи Гей-Люссак


Знаете ли вы, что..
Кремний в элементарном состоянии был впервые получен в 1825 году шведским химиком Йенсом Якобсом Берцелиусом

4. Получение кремния
В промышленности кремний получают восстанавливая расплав SiO 2 коксом при
t = 1800 0 C в дуговых печах. Чистота полученного таким образом кремния составляет 99,9 %.
SiO 2 + 2C = 2CO + Si

Знаете ли вы, что..
Способ получения кремния
в чистом виде разработан
Н. Н.Бекетовым.
Кремний в России производится
на заводах:
г. Каменск - Уральский (Свердловская область)
г. Шелех (Иркутская область).

Лабораторный способ получения кремния

4. Химические свойства кремния

Восстановительные свойства кремния
Химически кремний малоактивен.
1) При нагревании до 400 – 500 0 С кремний реагирует с кислородом с образованием диоксида кремния:
Si + O 2 = SiO 2

2)При комнатной температуре кремний реагирует только c фтором, образуя летучий фторид кремния:
Si + 2F 2 = SiF 4
При нагревании с хлором, бромом и йодом —
с образованием соответствующих
легко летучих галогенидов SiГ 4 :
Si + 2Cl 2 = SiCl 4
Si + 2Br 2 = SiBr 4
Si + 2Г 2 = SiГ 4


3) Кремний легко растворяется в щелочах
2NаOH + Si + H 2 O =
Na 2 SiO 3 + 2H 2 ↑

Окислительные свойства кремния
При взаимодействии с металлами кремний образует силициды
2Са + Si = Ca 2 Si
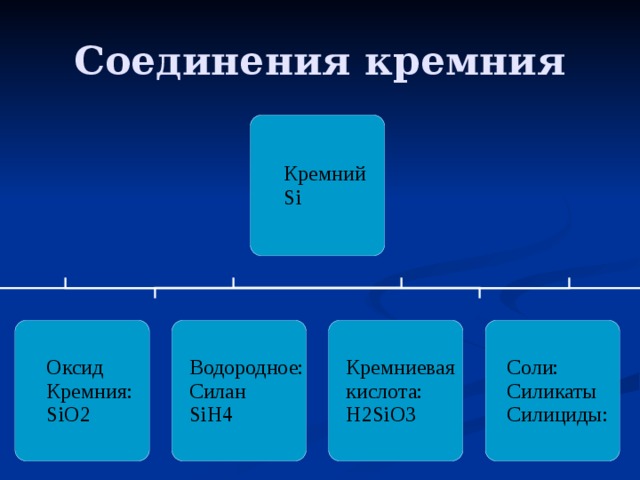
Соединения кремния
Оксид кремния (IV)
Атомная кристаллическая решетка

Оксиды
СО 2
…… ..
Кислотный оксид
…………… .. оксид
Молекулярная
кристаллическая решетка
…………… .. кристаллическая решетка
Физические
свойства
Бесцветный газ, хорошо растворим в воде, тяжелее воздуха.
Химические
свойства
CO 2 + H 2 O H 2 CO 3
CO 2 + CaO = CaCO 3
CO 2 + Ca(OH) 2 =CaCO 3 + H 2 O
CO 2 + 2Mg = 2MgO + C
CO 2 + C = 2CO
------------------------------------------------
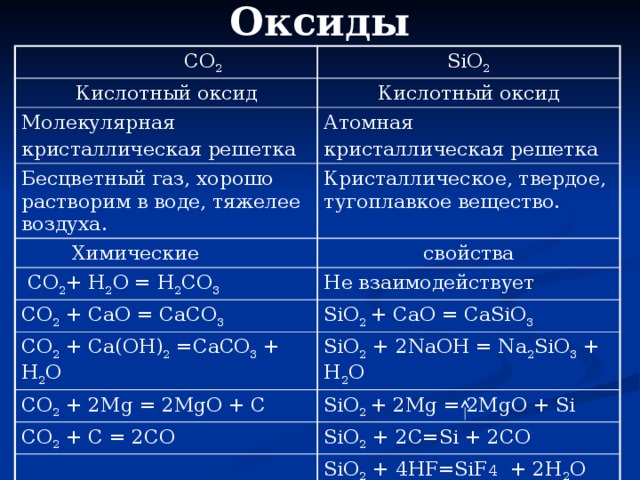
Оксиды
СО 2
SiO 2
Кислотный оксид
Кислотный оксид
Молекулярная
кристаллическая решетка
Атомная
Бесцветный газ, хорошо растворим в воде, тяжелее воздуха.
кристаллическая решетка
Кристаллическое, твердое, тугоплавкое вещество.
Химические
CO 2 + H 2 O = H 2 CO 3
свойства
CO 2 + CaO = CaCO 3
Не взаимодействует
SiO 2 + CaO = CaSiO 3
CO 2 + Ca(OH) 2 =CaCO 3 + H 2 O
SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O
CO 2 + 2Mg = 2MgO + C
SiO 2 + 2Mg = 2MgO + Si
CO 2 + C = 2CO
SiO 2 + 2C=Si + 2CO
SiO 2 + 4HF=SiF 4 + 2H 2 O

Биологическая роль SiO 2 кремнезема
Важнейшее соединение кремния – оксид кремния (IV) необходим для жизни растений и животных. Благодаря ему тростники, камыши и хвощи стоят крепко, как штыки. Острые листья осоки режут, как ножи, стерня на скошенном поле колет, как иголки, а стебли злаков настолько крепки, что не позволяют ниве на полях ложиться от дождя и ветра.

. Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем - оксид кремния(IV).

Кремниевая кислота

Лабораторный опыт
«Получение кремниевой кислоты»
К водному раствору силиката натрия добавьте несколько капель соляной кислоты до образования осадка. Составьте уравнение проделанной реакции в молекулярном и ионном виде.

Кислоты
H 2 CO 3
Двухосновная, кислородсодержащая, слабая, летучая.
Получение:
СО 2 + Н 2 О Н 2 СО 3
Нестойкая, непрочная, при стоянии или нагревании разлагается:
Н 2 СО 3 СО 2 + Н 2 О
2Na OH+ H 2 CO 3 =
Na 2 CO 3 + 2H 2 O

Кислоты
H 2 CO 3
H 2 SiO 3
Двухосновная, кислородсодержащая, слабая, летучая.
Двухосновная, кислородсодержащая, слабая, нерастворимая в воде.
Получение:
СО 2 + Н 2 О Н 2 СО 3
Получение:
Нестойкая, непрочная, при стоянии или нагревании разлагается:
SiO 2 + H 2 O =
Н 2 СО 3 СО 2 + Н 2 О
Выделить в чистом виде нельзя, т.к. при нагревании разлагается:
2Na OH+ H 2 CO 3 =
H 2 SiO 3 = SiO 2 + H 2 O
2Na OH+ H 2 SiO 3 =
Na 2 CO 3 + 2H 2 O
Na 2 SiO 3 +2H 2 O

Соли
Угольной кислоты
Кремниевой кислоты
- карбонаты;
- гидрокарбонаты;
- силикаты
Карбонаты обладают всеми свойствами солей, являются сильными электролитами, полностью диссоциируют на ионы (растворимы в воде).
Растворимыми являются только соли щелочных металлов, остальные образуют нерастворимые или вообще не образуют солей (Al 3+ , Cr 3+ , Ag + ).

Применение кремния и его соединений
Кирпич
Фарфор
Стекло
Керамика
Цемент
Асбест
Гранит
Клей
Фаянс
Силикон

Применение кремния в технике (изготовление полупроводниковых и кислотоупорных материалов)

Применение кремния в медицине

КРЕМНИЙ
Силициум с латыни кремень означает. Берцелиус его открыл и так назвал . Ученый Гесс ввел русский термин – кремний, Слышна в нем мощь утесов, скал. В земной коре второе место он прочно занимает, Хотя в свободном виде в природе не встречают. Известен кремний стал лишь с 19 века, Но неоценима его роль со времен древнего человека. Без него не построить себе особняк, Чашки кофе не выпить без фарфора никак, Звон хрустальный не слышать И как о берег бьют волны, Не носить топ - моделям серьги, броши, кулоны.

Ну, а чистый кремний хоть имеет структуру алмаза Полупроводниковыми свойствами владеет без отказа. Способностью мага он обладает. Энергией солнца вовсю управляет. Часам точный ход обеспечит кристалл. Прочность сталей усилишь, введя кремний в сплав. Живой организм кремний тоже имеет . Из-за него человек силикозом болеет. Недостаток его скелет ослабляет. Если меньше 3-х грамм, то и взгляд не сияет. Химической активностью кремний не блистает, Но в щелочах и фтороводороде себя он окисляет. Его оксид кислотный на редкость очень твердый В воде не растворим, Для получения разных стекол ничем не заменим.

Домашнее задание
§ 31, записи в тетради, № 4

Самоконтроль
1. Какое место занимает кремний в периодической системе:
а) 2 период, 4Б гр. б) 3 период, 3А гр. в) 3 период, 4А гр.
2. Кристаллическая решетка кремния и его соединений :
а) ионная; б) атомная; в) молекулярная;
3. По распространенности в природе кремний …. элемент:
а) первый; б) второй; в) третий;
4. Кремний вступает в реакцию с:
а) металлами, водородом, галогенами;
б) металлами, галогенами, легко растворяется в щелочах;
в) оксидами, кислотами, неметаллами.
5. Соли кремниевой кислоты:
а) силициды; б) гидросилициды; в) силикаты









































































