
Учитель химии МБОУ «Морская средняя общеобразовательная школа» городского округа Судак, Республика Крым

«Я слышу – я забываю,
я вижу – я запоминаю,
я делаю – я понимаю».
(китайская пословица)
Кремний и его соединения.

- В эпоху палеолита, т.е. 800-1000 тысячелетий тому назад, кремний помог человеку в борьбе за жизнь. Этот твердый камень, от которого легко отбить кусок с острыми краями, послужил материалом для первого оружия (наконечником копий и стрел) и первых орудий труда (топоров, ножей и т.д.).
- Позднее, когда на смену камню пришли медь, бронза, железо, кремень нашел использование в виде огнива.

- Мировые компьютерные компании находятся в «Кремниевой долине». Именно кремний служит материалом для изготовления современных процессоров .
- Современный процессор является самым сложным готовым продуктом на Земле. Инженеры-технологи научились изготавливать процессоры из песка.

Чистый элементарный кремний был получен шведским химиком Йенсом Якобом Берцелиусом в 1825 году действием металлического калия на фтористый кремний SiF 4
Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе с древнегреческого κρημνός — « утес, гора».
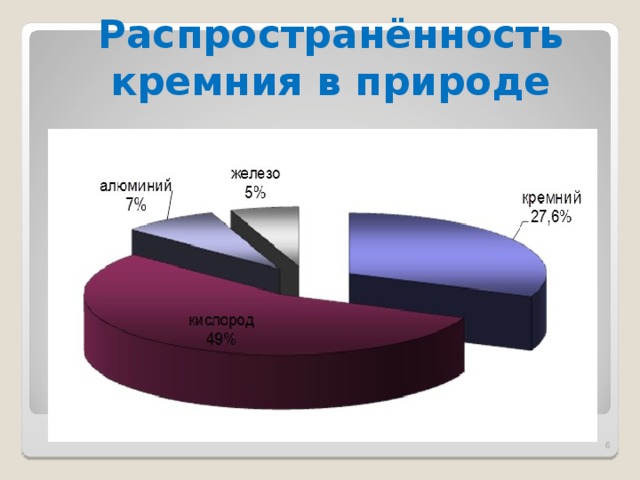
Распространённость кремния в природе

Кремний – второй по распространенности после кислорода химический элемент. Земная кора более чем на четверть состоит из его соединений. В природе кремний встречается только в виде диоксидов (кремнезёма) и солей кремниевой кислоты (силикатов). Наиболее широко распространены алюмосиликаты.

Кремнезём
Песок
Горный хрусталь
SiO 2
Аметист
Агат
Цитрин

K 2 O • Al 2 O 3 • 6SiO 2 ортоклаз
(полевой шпат )
Al 2 O 3 • 2SiO 2 • 2H 2 O каолин (основная часть глины)

Простое вещество – кристаллический кремний Si
- тёмно-серого цвета
- твёрдый
- t плавл. 1415 °С
- полупроводник
- имеет металлический блеск

Простое вещество – аморфный кремний Si
- порошок буро-серого цвета
- обладает большей реакционной способностью, чем кристаллический кремний.
- гигроскопичен
- алмазоподобная структура

Получение кремния
1) в лабораторных условиях
t
SiO 2 + 2Mg = 2MgO + Si

Получение кремния в лаборатории

Получение кремния
2)в промышленност
1900 0
SiO 2 + 2C = 2CO + Si
восстановление расплава SiO 2 коксом при температуре около 1900 о С в руднотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9%
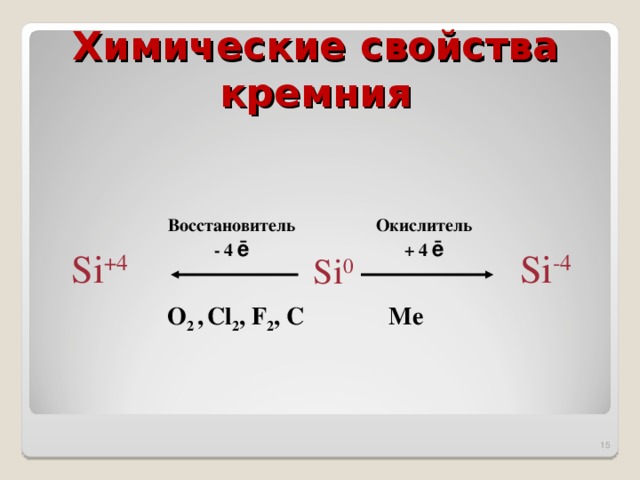
Химические свойства кремния
Восстановитель
- 4 ē
Окислитель
+ 4 ē
Si +4
Si -4
Si 0
O 2 , Cl 2 , F 2 , C
Me

Химические свойства
- Горит в кислороде, образуя диоксид кремния:
2. При нагревании соединяется с металлами с образованием силицидов:
3. Взаимодействует со щелочами, образуя силикаты и водород:
t
Si + O 2 → SiO 2
t
Si + 2Mg → Mg 2 Si
Si + 2 NaOH + H 2 O→ Na 2 SiO 3 + 2H 2 ↑
t
16
Взаимодействие кремния со щелочью
16

Оксид кремния (IV), или кремнезем – тугоплавкий, нелетучий, практически нерастворимый в воде. Специально приготовленный порошок оксида кремния (силикагель) используется в качестве адсорбента. Гранулированный силикагель используется для осушки воздуха.
По химическим свойствам оксид кремния – кислотный оксид, а значит, он вступает в реакции со щелочами, при этом образуются силикаты. Например, при взаимодействии оксида кремния с избытком гидроксида калия образуются силикат калия и вода
SiO 2 + 2KOH = K 2 SiO 3 + H 2 O
При сплавлении он взаимодействует с основными оксидами, например с оксидом кальция: CaO + SiO 2 = CaSiO 3
16

Знаменитый ученый в области минералогии А. Е. Ферсман писал: «Показывают самые разнообразные предметы: прозрачный шар, сверкающий на солнце чистотой холодной ключевой воды, красивый, пестрого рисунка агат, яркой игры многоцветный опал, чистый песок на берегу моря, тонкую, как шелковинка, нитку из плавленого кварца или жароупорную посуду из него, красиво ограненные груды горного хрусталя, таинственный рисунок фантастической яшмы, окаменелое дерево, превращенное в камень, грубо обработанный наконечник стрелы древнего человека... все это одно и то же соединение...» Какое?
16

Силан SiH 4
Представляет собой очень ядовитый бесцветный газ с запахом, напоминающим H 2 S. На воздухе самовоспламеняется, так как температура его воспламенения ниже комнатной. При нагревании разлагается. Не растворяется в холодной воде. Весьма реакционноспособен.
16

Домашнее задание:
§ 37 читать, для обучающихся с высоким уровнем знаний – стр134 №3 письменно, для обучающихся со средним уровнем знаний – подготовить сообщение о биологической роли кремния в живых организмах
16

16







































