
Ферменты
Классификация ферментов.
Особенности строения и свойств ферментов

ФЕРМЕНТЫ
это энзимы, специфические белки, увеличивающие скорость протекания химических реакций в клетках всех живых организмов.
Энзимология - наука о ферментах

История изучения
Термин «фермент» был предложен в XVII веке химиком
Ван Гельмонтом
при обсуждении механизмов пищеварения.

История изучения
В XIX в. Луи Пастер , изучая превращение углеводов
в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой (ферментом), находящейся в дрожжевых клетках, причём он считал, что эти «силы» неотделимы от структуры живой клетки дрожжей.

История изучения
В середине 19 в. разгорелась дискуссия о природе брожения.
Юстас Либих и его сторонники, отстаивая химическую природу брожения ,
считали, что оно является следствием образования в клетках микроорганизмов растворимых ферментов.
Луи Пастер считал, что брожение
вызывается лишь
живыми микроорганизмами и что процесс брожения неразрывно связан с их жизнедеятельностью.

История изучения
Дискуссия Либиха и Пастера о природе брожения была разрешена в 1897 Эдуардом Бухнером , который, растирая дрожжи с инфузорной землёй, выделил из них бесклеточный растворимый ферментный препарат (зимазу), вызывавший спиртовое брожение.
В 1907 г.
Бухнеру была присуждена Нобелевская премия по химии «за проведенную им научно-исследовательскую работу по биологической химии и открытие внеклеточной ферментации».
В течение последующих 10 лет было выделено ещё несколько ферментов, и белковая природа ферментов была окончательно доказана.

История изучения
Впервые ферменты выделили в кристалитической форме в 1926 году Джеймс Бетчеллер Самнер и Джон Говард Нортроп.
В 1946 году им была присуждена Нобелевская премия.
Джеймс Бетчеллер Самнер
Джон Говард Нортроп.

Классификация ферментов
- В 1961 году предложена комиссией международного биохимического союза систематическая номенклатура ферментов. Ферменты подразделили на 6 групп в соответствии с типом реакции, которую они катализируют.
- Рабочее название складывалось из названия субстрата, типа каталитической реакции и окончания –аза.
- Пример: лактан+дегидрогенизация+аза=лактатдегидрогеназа
- Известным ферментам оставлены прежние названия пепсин ,трипсин.

Классификация ферментов
Классы ферментов
Катализируемая реакция
Оксидоредуктазы
Примеры ферментов или их групп
Перенос атомов водорода или электронов от одного вещества к другому.
Трансферазы
Гидролазы
Дегидрогеназа, оксидаза
Перенос определенной группы атомов -метильной, ацильной, фосфатной или аминогруппы-одного вещества к другому
Лиазы
Реакции гидролиза
Трансаминаза, киназа
Липаза, амилаза, пептидаза
Негидролитическое присоединение к субстрату или отщепление от него группы атомов. При этом могут разрываться связи С-С, C-N, C-O
Изомеразы
или C-S
Декарбоксилаза, фумараза, альдолаза
Внутримолекулярная перестройка
Лигазы
Изомераза, мутаза
Соединение двух молекул в результате образования новых связей, сопряженное с распадом АТФ
Синтетаза

Получение ферментов.
Обычно ферменты выделяют из тканей животных, растений, клеток и культуральных жидкостей микроорганизмов, биологических жидкостей (кровь, лимфа и др.).
Для получения некоторых труднодоступных ферментов используются
методы генетической инженерии.
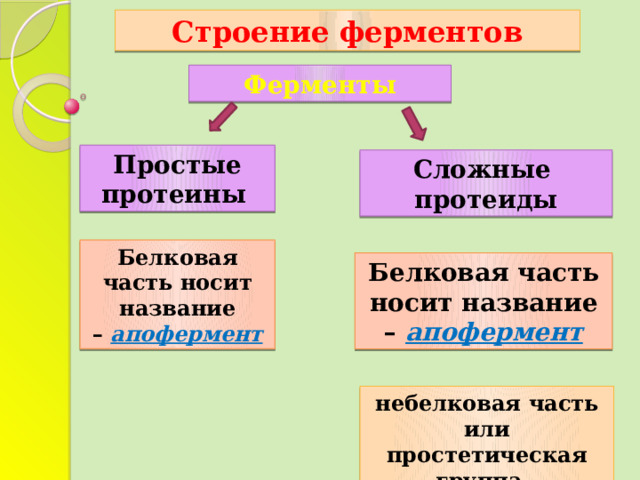
Строение ферментов
Ферменты
Простые
протеины
Сложные
протеиды
Белковая часть носит название – апофермент
Белковая часть носит название – апофермент
небелковая часть или простетическая группа - кофермент

Строение ферментов
Коферменты можно рассматривать как составную часть молекулы фермента. Это органические вещества, среди которых различают: нуклеотиды (АТФ, УМФ, и пр), витамины или их производные (ТДФ – из тиамина (В1), ФМН – из рибофлавина (В2), коэнзим А – из пантотеновой кислоты (В3), НАД и пр) и тетрапиррольные коферменты – гемы.
Функции простетической группы следующие: участие в акте катализа, осуществление контакта между ферментом и субстратом, стабилизация молекулы фермента в пространстве.

Строение ферментов
Ферменты имеют 2 центра: Активный центр и Аллостерический центр.
Активный центр (АЦФ) – это относительно небольшой участок, расположенный на поверхности молекулы фермента, который непосредственно участвует в катализе. Состоит из уникального сочетания аминокислотных остатков, обеспечивает связь с субстратом и его дальнейшее превращение.
В АЦФ различают: Субстратсвязывающий центр – участок, который отвечает за комплиментарное связывание субстрата и образование фермент – субстратного комплекса. Каталитический центр – непосредственно участвуют в химические реакции с субстратом.

Принцип действия ферментов
Фермент и субстрат должны подходить
друг к другу «как ключ к замку»
Субстрат- вещество
на которое действует
фермент
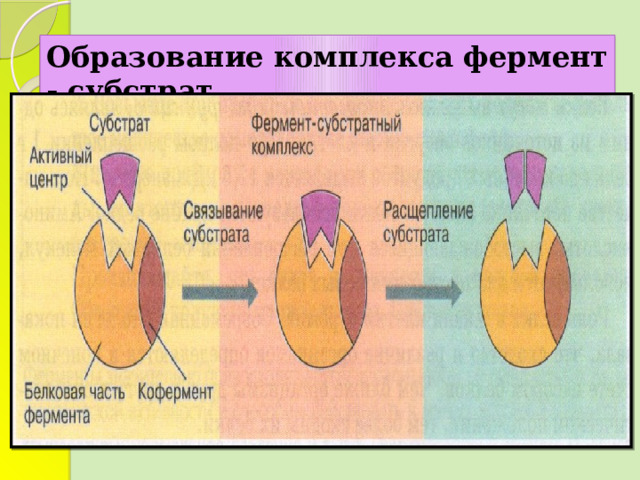
Образование комплекса фермент - субстрат

Ферменты или энзимы обозначают буквой Е
Ферменты обладают свойствами белков, но имеют и особенности:
1. Зависимость от РН
2. Зависимость от температуры
3. Высокая специфичность действия
4. Способностью к регуляции – т.е. могут подвергаться влиянию активаторов или ингибиторов

Свойства ферментов
3. Высокая специфичность действия
Специфичность действия
определяется структурой активного центра фермента и заключается в том, что каждый фермент катализирует превращение одного субстрата или группы субстратов, сходных по своей структуре.
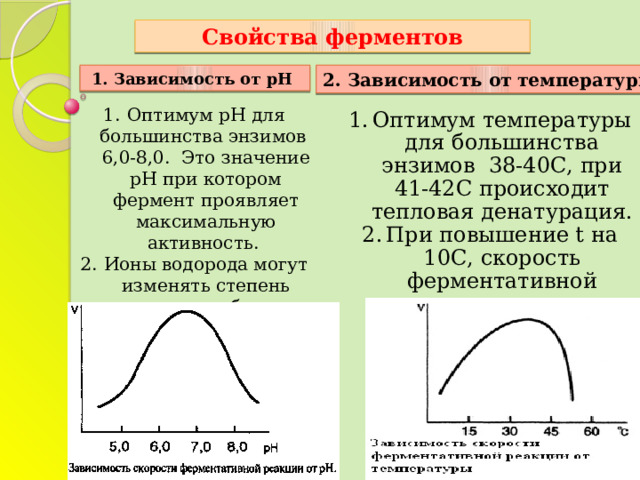
Свойства ферментов
2. Зависимость от температуры
1. Зависимость от рН
- Оптимум рН для большинства энзимов 6,0-8,0. Это значение рН при котором фермент проявляет максимальную активность.
- Ионы водорода могут изменять степень ионизации субстрата, продукта и фермента.
- Оптимум температуры для большинства энзимов 38-40С, при 41-42С происходит тепловая денатурация.
- При повышение t на 10С, скорость ферментативной реакции увеличивается в 2 раза.

Свойства ферментов
4. Способностью к регуляции
Влияние на активность ферментов активаторов и ингибиторов. К числу факторов, повышающих активность ферментов, относятся катионы металлов и некоторые анионы. Чаще всего активаторами ферментов являются катионы Mg 2+ , Mn 2+ , Zn 2+ , K + и Со 2+ , а из анионов - Сl - . Катионы действуют на ферменты по-разному. В одних случаях они облегчают образование фермент-субстратного комплекса, в других - способствуют присоединению кофермента к апоферменту, либо присоединяются к аллостерическому центру фермента и изменяют его третичную структуру, в результате чего субстратный и каталитический центры приобретают наиболее выгодную для осуществления катализа конфигурацию.
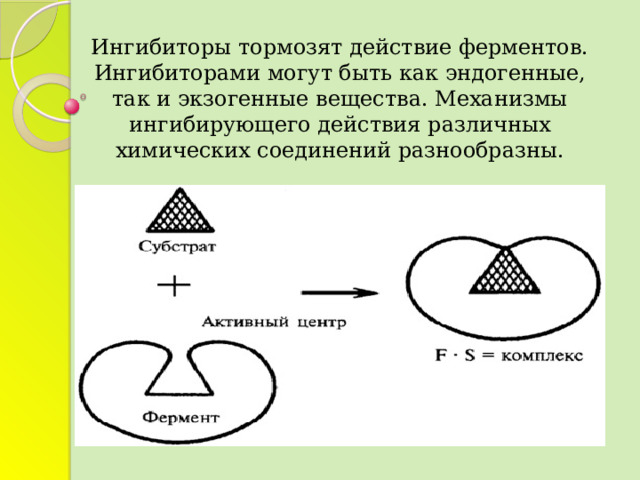
Ингибиторы тормозят действие ферментов. Ингибиторами могут быть как эндогенные, так и экзогенные вещества. Механизмы ингибирующего действия различных химических соединений разнообразны.
Применение ферментов
Ферменты получили широкое применение в легкой, пищевой и химической промышленности, а также в медицинской практике.
- В пищевой промышленности ферменты используют при приготовлении безалкогольных напитков, сыров, консервов, колбас, копченостей. В животноводстве ферменты используют при приготовлении кормов. Ферменты используют при изготовлении фотоматериалов. Ферменты используют при обработке овса и конопли. Ферменты используют для смягчения кожи в кожевенной промышленности. Ферменты входят в состав стиральных порошков, зубных паст. В медицине ферменты имеют диагностическое значение – определение отдельных ферментов в клетке помогает распознаванию природы заболевания (например вирусный гепатит – по активности фермента в плазме крови) их используют для замещения недостающего фермента в организме.
- В пищевой промышленности ферменты используют при приготовлении безалкогольных напитков, сыров, консервов, колбас, копченостей.
- В животноводстве ферменты используют при приготовлении кормов.
- Ферменты используют при изготовлении фотоматериалов.
- Ферменты используют при обработке овса и конопли.
- Ферменты используют для смягчения кожи в кожевенной промышленности.
- Ферменты входят в состав стиральных порошков, зубных паст.
- В медицине ферменты имеют диагностическое значение – определение отдельных ферментов в клетке помогает распознаванию природы заболевания (например вирусный гепатит – по активности фермента в плазме крови) их используют для замещения недостающего фермента в организме.

Домашнее задание
1.Творческое задание: подготовить презентацию.
2. Реферат по теме «Области применения ферментов»















































