
Реакции
Замещения
Обмена

Составить уравнения и расставить коэффициенты укажите тип реакции:
Вариант 1.
1. Оксид азота(V) + вода = азотная кислота
2. Оксид натрия + вода = гидроксид натрия
3. Гидроксид железа (III) = оксид железа (III)
+ вода
Вариант 2.
1. Оксид углерода(IV) + вода = угольная кислота
2. Оксид лития + вода = гидроксид лития
3. Гидроксид меди (II) = оксид меди (II) + вода

Определите типы химических реакций
1) 2 Cu+O 2 → 2 CuO
2) Zn(OH) 2 → ZnO+H 2 O
3) Mg+H 2 SO 4 → MgSO 4 +H 2
4) 2 СО + О 2 → 2 СО 2
5) 2 Ag 2 O → 4 Ag + O 2
6) 2 KNO 3 → 2 KNO 2 + O 2
7) NH 3 + CO 2 + H 2 O → NH 4 HCO 3
8) 2 HBr → H 2 + Br 2
9) CaCO 3 → CaO + CO 2

Реакции замещения
Это такие реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
АВ + С = АС+В
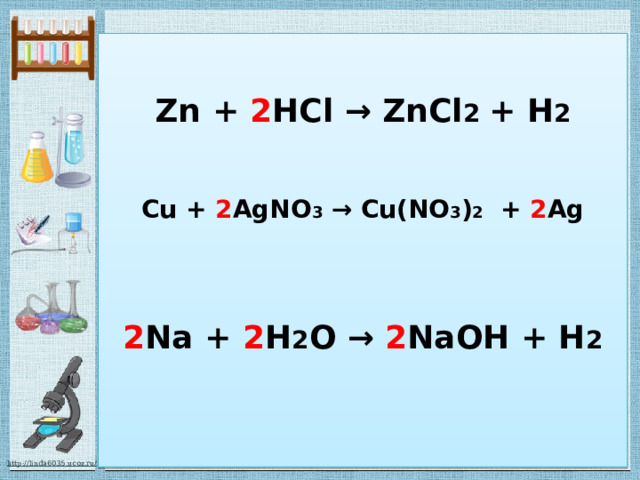
Zn + 2 HCl → ZnCl 2 + H 2
Cu + 2 AgNO 3 → Cu(NO 3 ) 2 + 2 Ag
2 Na + 2 H 2 O → 2 NaOH + H 2

Электрохимический ряд напряжений
Правило 1:
- Каждый из металлов, расположенных в ряду напряжений до водорода вытесняет водород из водных растворов кислот.
- Образованная соль должна быть растворима.
Li, K, Ca, Na, Mg, Al, Mn, Zn, Fe, Pb , H 2 , Cu, Ag, Au
1. Zn + H 2 SO 4 =
2. Fe + H 2 SO 4(разб) =
3. Au + H 2 SO 4 =

Вытеснение металлов из солей
Правило 2:
В реакциях между металлами и солями:
- Каждый металл вытесняет из солей (в водных растворах) все те металлы, которые стоят правее его в электрохимическом ряду.
- Новая соль должна быть растворима.
Закончить уравнения практически осуществимых реакций:
1. Fe + CuCl 2 = 3. Fe + HgCl 2 =
2. Fe + ZnCl 2 = 4. Fe + AlCl 3 =
Li, Ca, Na, Mg, Al, Mn, Zn, Fe, Pb, H 2 , Cu, Hg, Ag .

Реакции обмена
это такие реакции, в результате которых два сложных вещества обмениваются своими составными частями
(атомами или группами атомов)
A B+ C D = A D + C B
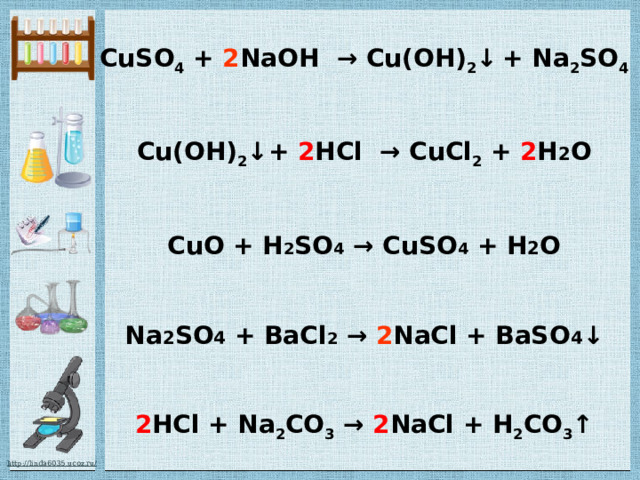
CuSO 4 + 2 NaOH → Cu(OH) 2 ↓ + Na 2 SO 4 Cu(OH) 2 ↓+ 2 HCl → CuCl 2 + 2 H 2 O CuO + H 2 SO 4 → CuSO 4 + H 2 O Na 2 SO 4 + BaCl 2 → 2 NaCl + BaSO 4 ↓ 2 HCl + Na 2 CO 3 → 2 NaCl + H 2 CO 3 ↑

Определите тип реакции
- CuSO 4 + Fe → FeSO 4 + Cu
- CaCO 3 → CaO + CO 2
- 2 Al + 6 HCl → 2 AlCl 3 + 3 H 2
- HCl + KNO 2 = KCl + HNO 2
- Na 2 O + CO 2 = Na 2 CO 3
- 2 KClO 3 → 2 KCl + 3 O 2
- Ba(OH) 2 + H 2 SO 4 = BaSO 4 + 2 H 2 O
- 2 NaI + Cl 2 = 2 NaCl + I 2
- C + O 2 = CO 2
- MgO + Cu = CuO + Mg





































