Просмотр содержимого документа
«Презентация к уроку по химии по теме "Углерод" 9 класс»

Углерод

6
Углерод
C
12,011
2s 2 2p 2
Строение атома
В периодической таблице химических элементов углерод (С) расположен во втором периоде, в IV группе главной подгруппы .
Углерод ( С ) — неметалл.
Возможные степени окисления: -4; 0; +2; +4. Формулы высшего оксида и гидроксида: СО 2 и Н 2 СО 3 .
Оба соединения проявляют кислотные свойства.

Аллотропия углерода
Графит
Структура слоистая.
Хорошо проводит электрический ток.
В отличие от алмаза обладает низкой твёрдостью. Плотность 2,08—2,23 г/см³.
Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха.
В кислотах не растворяется.
Жирный на ощупь.
Природный графит содержит 10—12 % примесей глин и окислов железа.
При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах).

Алма́з
Главные отличительные черты алмаза — высочайшая среди минералов твёрдость, наиболее высокая теплопроводность среди всех твёрдых тел.
Температура плавления алмаза составляет 3700—4000 °C.
На воздухе алмаз сгорает при 850—1000 °C, а в струе чистого кислорода горит слабо-голубым пламенем при 720—800 °C, полностью превращаясь в конечном счёте в углекислый газ.
При нагреве до 2000 °C без доступа воздуха алмаз переходит в графит за 15-30 минут

Карбин
Получен искусственно, минерал на 99% состоит из углерода
Мелкокристаллический порошок чёрного цвета
Построен из длинных цепочек атомов углерода , уложенных параллельно друг другу
Является полупроводником

Сажа Древесный уголь
Древесный уголь получают при сухой перегонке древесины
Благодаря своей пористой поверхности, он поглощает газы и растворённые вещества
Адсорбция -способность поглощать газы и растворённые вещества
Активированный уголь- обработанный водяным паром

Химические свойства
1)Уголь взаимодействует с кислородом, сгорая в нём
С + О 2 =СО 2
2) С металлами углерод образует карбиды
4Al + 3C = Al 4 C 3 ( карбид алюминия светло-жёлтого цвета )
Ca + 2C = CaC 2 ( карбид кальция серого цвета)
3)Важна в промышленности реакция углерода с водяным паром:
C + H 2 O = CO + H 2
4) Карбид кальция применяют сварщики для получения ацетилена С2Н2
CaC 2 + 2H 2 O = Са(ОН) 2 + С 2 Н 2
5) Е сли водой подействовать на карбид кальция то получится другой газ- метан СН 4
- Al 4 C 3 + 12H 2 O = Al(ОН) 3 +3СН 4
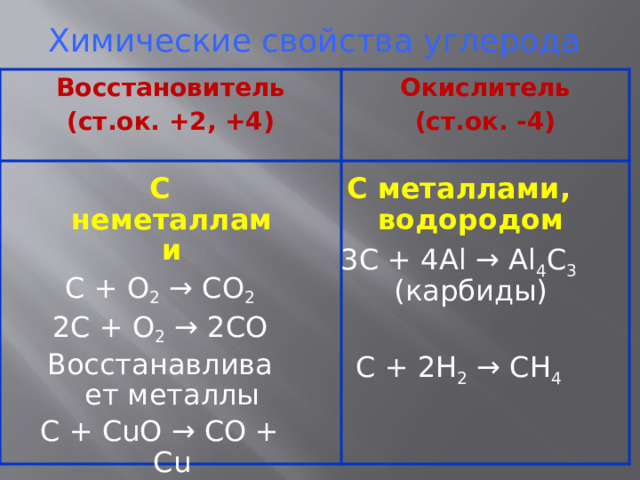
Химические свойства углерода
Восстановитель
(ст.ок. +2, +4)
Окислитель
(ст.ок. -4)
С неметаллами
С металлами, водородом
С + О 2 → СО 2
3С + 4Аl → Al 4 С 3 (карбиды)
2С + О 2 → 2СО
Восстанавливает металлы
С + 2H 2 → CH 4
С + СuO → CO + Cu

Домашнее задание
Параграф 30
упр.5
(письменно)


































