
Девиз урока
«О, физика, наука из наук
Все впереди так мало за плечами
Пусть химия нам будет вместо рук,
Пусть математика очами станет.
Не разлучайте этих трех сестёр
Познания в подлунном мире
Тогда лишь будет ум и глаз остёр
И знанье человеческое шире.»
М. Алигер

Номер 13! Счастливый или нет?



ТЕМА УРОКА:
ЭЛЕКТРОЛИЗ

Цель: изучить сущность процесса электролиза
Задачи:
- раскрыть принцип работы электролизёра
- суть катодных и анодных процессов
- примеры электролиза
- применение электролиза

Электролиз – дословно: «лизис» - разложение, «электро» - электрическим током.

Электролиз.
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
- Электролиты: соли, щёлочи, кислоты.

Первый закон Фарадея
- m =K*q=K*I*t
- K – электрохимический эквивалент вещества(кг/Kл)

Растворение
+
-
-
+
+
-
-
+
+
-
NaCl =
Na (H 2 O) 6 +
Cl (H 2 O) 4
+
- Na
-
- Cl
К уроку «Химическое равновесие в растворах»
-
+
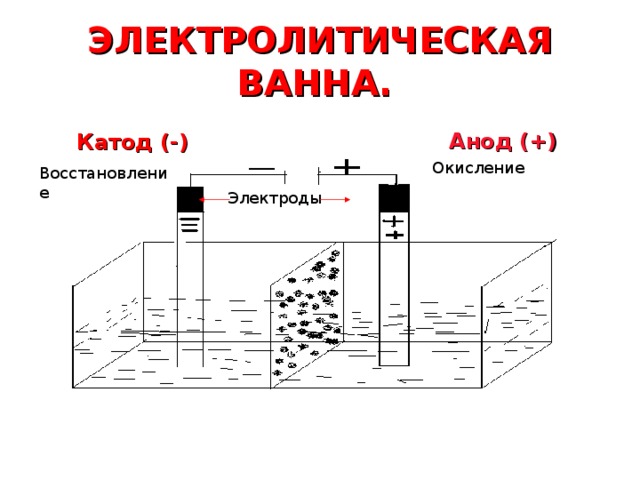
ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА.
Анод (+)
Катод (-)
Окисление
Восстановление
Электроды

Окислительно-восстановительные процессы легко запомнить так:
На
КАТОД
идут
ПОЛОЖИТЕЛЬНЫЕ
ионы, там происходит
процесс
ВОССТАНОВЛЕНИЯ
На
АНОД
идут
ОТРИЦАТЕЛЬНЫЕ
ионы, там происходит
процесс
ОКИСЛЕНИЯ

Электролиз расплава хлорида натрия.
K(-) Na + +e = Na 0 - процесс восстановления.
A(+) 2Cl - - 2e = Cl 2 0 - процесс окисления.
Молекулярное уравнение электролиза.
2NaCl ====2Na + Cl 2


Для подбора коэффициентов используем метод электронно-ионного баланса:
Электролиз раствора сульфата меди
Схема процесса:

Задача №1
Рассчитайте массу меди, полученной при электролизе водного раствора сульфата меди c графитовыми электродами, если на аноде выделилось 6,4 г кислорода.

Решение задачи №1
- 2CuSO 4 + 2H 2 O → 2Cu + O 2 + 2H 2 SO 4
- 2 моль 1 моль
- n(O 2 ) = 6,4г/ 32г/моль = 0,2 моль
- n(Cu) = 2n(O 2 ) = 2×0,2моль = 0,4моль
- m(Cu) = 0,4 моль×64 г/моль = 25,6 г

Задача №2:
Рассчитайте время получения данной массы меди (25,6 г), при показании амперметра 10 А, К=0,33*10 -6 кг/Кл. Ответ округлите до целых и выразите в часах.

Решение задачи №2
- По закону электролиза (по закону Фарадея )
- m(Cu) = k(Cu)*I*t
- t = m/k*I
- t = 0,0256 кг /10 А*0,00000033кг/Кл = =7636 с = 2 ч

Применение электролиза.
- Для получения щёлочных, щёлочноземельных металлов, алюминия, лантаноидов
- Для получения точных металлических копий, что называется гальванопластикой
- Для защиты металлических изделий от коррозии и для придания декоративного вида. Отрасль прикладной электрохимии, которая занимается покрытием металлических изделий другими металлами называется ГАЛЬВАНОСТЕГИЕЙ.

Применение ЭЛЕКТРОЛИЗА
Кыштымский Медеэлектролитный завод:
- получение алюминия
- получение меди;
- выпуск золота и серебра в слитках;
- получение металлов платиновой группы;
- получение технического селена

Металлы платиновой группы :
- палладиевая оправу для драгоценных камней,
не тускнеет и стоек к коррозии;
- иридий обладает очень высокой твердостью
и его используют для изготовления
электроконтактов,
хирургических инструментов,
точных химических весов;
- рутений (Россия) - самый редкий из
платиновой группы,используют при изготовлении
проводов, контактов, электродов,
лабораторной посуды, ювелирных изделий.
ИТЕРБИЙ - для изготовления
оптоволоконных лазеров
(стоимость чистого составляет
250-300 долларов за килограмм)

ЭЛЕКТРОЛИЗОМ получают
два основных продукта :
серную кислоту и цинк

Применение ЭЛЕКТРОЛИЗА
Одно из новых направлений электролиза – это косметология. Существует несколько видов элекроэпиляции, один из которых основан на ЭЛЕКТРОЛИЗЕ. В основу метода положено электрохимическое действие гальванического тока. В результате анодно-катодной реакции происходит образование соляной кислоты, которая, распадаясь, преобразуется в едкую щелочь. Именно эти два химических вещества приводят к электролитическому ожогу и разрушению волосяного фолликула.

Другие применения электролиза.
Кроме указанных выше электролиз нашел применение и в других областях. Укажем некоторые из них:
а) получение оксидных защитных пленок на металлах (анодирование);
б) электрохимическая обработка поверхности металлического изделия (полировка);
в) электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др.);
г) очистка воды – удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной);
д) электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т.д.).

Итоговое тестирование.
1.Электролиз можно считать окислительно-восстановительной реакцией, происходящей под воздействием электрического тока?
2.На катоде происходит процесс электрохимического окисления?
3.Катион Na + будет восстанавливаться на катоде в водном растворе?
4.Анион Cl – будет окисляться на аноде в водном растворе?
5.При электролизе расплава NaCl можно получить Na и Cl 2
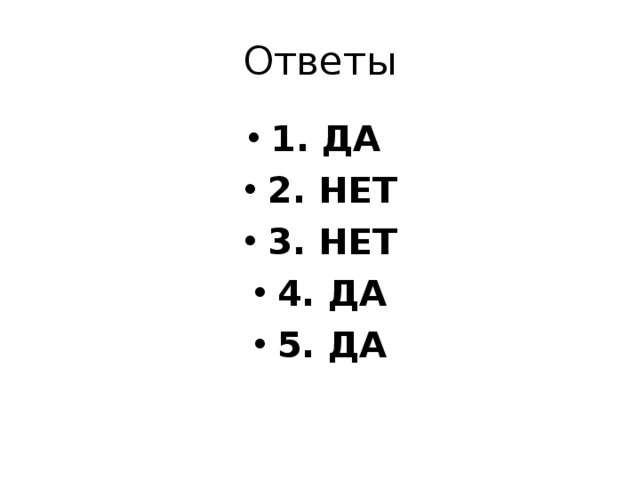
Ответы
- 1. ДА
- 2. НЕТ
- 3. НЕТ
- 4. ДА
- 5. ДА
Рефлексия «Лестница знаний»

- Спасибо за терпение!
- Спасибо за внимание!
- Спасибо за урок!













































