
Ионное произведение воды, рН растворов.
Преподаватель химии Звягинцева О.В.
![Электролитическая диссоциация воды Вода проявляет свойства слабого электролита Диссоциация воды происходит в очень незначительной степени: в 1 л воды на ионы распадается только 1 • 10 -7 моль молекул. По уравнению электролитической диссоциации воды видно, что вода электролит , проявляющий амфотерные свойства: H 2 O H + + OH ион Н + - носитель кислотных свойств, ион ОН - - обуславливает щелочные свойства воды Как видно из уравнения диссоциации в жидкой воде концентрация ионов водорода приблизительно равна концентрации ионов гидроксила и поэтому можно написать, что в воде [Н + ] = [ОН - ]](https://fsd.multiurok.ru/html/2021/12/19/s_61bf61d0cdfc2/img1.jpg)
Электролитическая диссоциация воды
Вода проявляет свойства слабого электролита
Диссоциация воды происходит в очень незначительной степени:
в 1 л воды на ионы распадается только 1 • 10 -7 моль молекул.
По уравнению электролитической диссоциации воды видно,
что вода электролит , проявляющий амфотерные свойства:
H 2 O H + + OH
ион Н + - носитель кислотных свойств,
ион ОН - - обуславливает щелочные свойства воды
Как видно из уравнения диссоциации в жидкой воде концентрация ионов водорода приблизительно равна концентрации ионов гидроксила и поэтому можно написать, что в воде [Н + ] = [ОН - ]
![Ионное произведение воды. Равновесие процесса диссоциации воды H 2 O H + + OH описывается константой Кw, которая носит название “ионное произведение воды”. Ионное произведение воды - произведение концентраций ионов водорода и гидроксид-ионов в воде. Для чистой воды и для разбавленных водных растворов при неизменной температуре произведение концентрации ионов водорода и гидроксид-ионов есть величина постоянная. К Н 2 О = [Н + ][ОН - ] = 10 -7 10 -7 = 10 -14 моль/л при температуре 25 0 С](https://fsd.multiurok.ru/html/2021/12/19/s_61bf61d0cdfc2/img2.jpg)
Ионное произведение воды.
Равновесие процесса диссоциации воды
H 2 O H + + OH
описывается константой Кw, которая носит название “ионное произведение воды”.
Ионное произведение воды - произведение концентраций ионов водорода и гидроксид-ионов в воде.
Для чистой воды и для разбавленных водных растворов при неизменной температуре произведение концентрации ионов водорода и гидроксид-ионов есть величина постоянная.
К Н 2 О = [Н + ][ОН - ] = 10 -7 10 -7 = 10 -14 моль/л при температуре 25 0 С
![Водородный показатель (рН) Реакцию того или иного раствора принято характеризовать концентрацией водородных ионов. Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН. Водородный показатель – десятичный логарифм концентрации ионов Н + , взятый с обратным знаком: рН = -lg[H + ] Например, если [Н + ] = 10 -5 моль/л, то lg 10 -5 = - 5, т.е. рН=5 Обозначение рН ввел в научный обиход в 1909 датский физикохимик и биохимик С.П.Л.Сёренсен, который занимался в то время изучением процессов, происходящих при сбраживании пивного солода, и их зависимостью от кислотности среды. Буква “р” — начальная от датского слова potenz (степень), “Н” — символ водорода. Сёрен Педер Лауриц Сёренсен (1868-1939)](https://fsd.multiurok.ru/html/2021/12/19/s_61bf61d0cdfc2/img3.jpg)
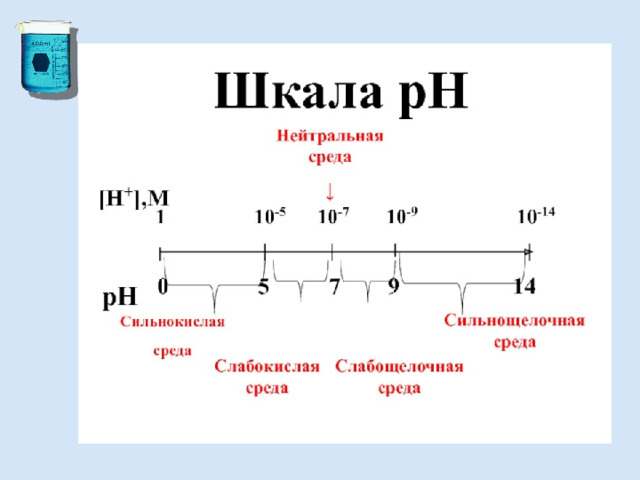
Водородный показатель (рН)
Реакцию того или иного раствора принято характеризовать концентрацией водородных ионов.
Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН.
Водородный показатель – десятичный логарифм концентрации ионов Н + ,
взятый с обратным знаком: рН = -lg[H + ]
Например, если [Н + ] = 10 -5 моль/л,
то lg 10 -5 = - 5, т.е. рН=5
Обозначение рН ввел в научный обиход в 1909 датский физикохимик и биохимик С.П.Л.Сёренсен, который занимался в то время изучением процессов, происходящих при сбраживании пивного солода, и их зависимостью от кислотности среды.
Буква “р” — начальная от датского слова potenz (степень), “Н” — символ водорода.
Сёрен Педер Лауриц Сёренсен
(1868-1939)
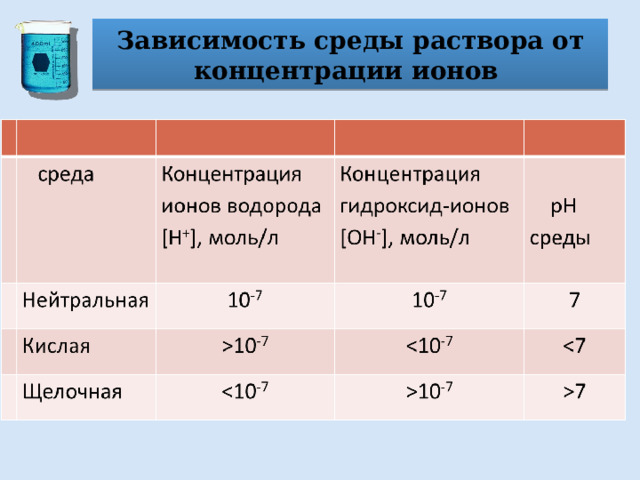
Зависимость среды раствора от концентрации ионов

Кислотно-основные индикаторы
Для определения рН используют индикаторы – вещества органической природы, которые по-разному окрашиваются в растворах в зависимости от реакции среды. Эти соединения, например фенолфталеин, метиловый оранжевый, представляют собой слабые кислоты или основания, которым в молекулярной форме присуще одно окрашивание, а в ионной форме – другое.
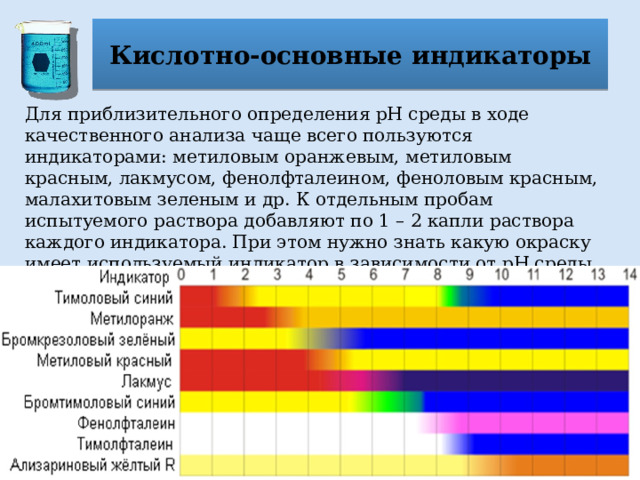
Кислотно-основные индикаторы
Для приблизительного определения рН среды в ходе качественного анализа чаще всего пользуются индикаторами: метиловым оранжевым, метиловым красным, лакмусом, фенолфталеином, феноловым красным, малахитовым зеленым и др. К отдельным пробам испытуемого раствора добавляют по 1 – 2 капли раствора каждого индикатора. При этом нужно знать какую окраску имеет используемый индикатор в зависимости от рН среды.

Роль рН
Водородный показатель водного раствора имеет огромное значение для природных процессов, жизнедеятельности и технологий.
Незначительные изменения pH грунтовых вод и водоемов приводят к гибели растений и обитающих в воде живых существ, а нарушение pH жидкостей организмов вызывает их заболевания и гибель.
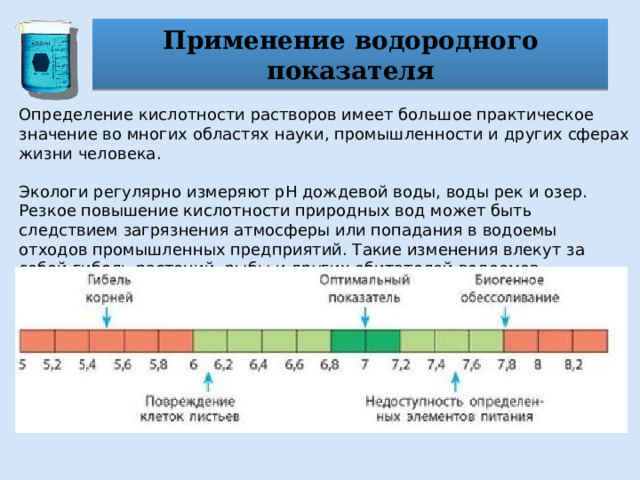
Применение водородного показателя
Определение кислотности растворов имеет большое практическое значение во многих областях науки, промышленности и других сферах жизни человека.
Экологи регулярно измеряют рН дождевой воды, воды рек и озер. Резкое повышение кислотности природных вод может быть следствием загрязнения атмосферы или попадания в водоемы отходов промышленных предприятий. Такие изменения влекут за собой гибель растений, рыбы и других обитателей водоемов.

Применение водородного показателя
Для большинства растений важна кислотность почвы, поэтому агрономы заранее проводят анализ почв, определяя их рН. Если кислотность слишком велика для определенной культуры, почву известкуют — добавляют мел или известь.
В пищевой промышленности при помощью кислотно-основных индикаторов проводят контроль качества продуктов питания. Например, в норме для молока pH = 6,8. Отклонение от этого значения свидетельствует либо о наличии посторонних примесей, либо о его скисании.

Роль рН в биологических жидкостях организма
Синтез, распад и взаимопревращения (метаболизм) химических соединений в организме осуществляется с помощью белков-ферментов. Их насчитывается примерно 2 тысячи.
Ферменты наиболее активны в пределах узкой зоны рН и соответствуют области физиологических значений.
Подсчитано, что в процессе метаболизма ежесуточно в организме образуется большое количество кислых продуктов. Это может привести к сдвигу рН крови, различных тканевых жидкостей мозга, печени, почек и др., что резко отразится на активности ферментов. Например, сдвиг рН крови на 0,4 единицы приводит к летальному исходу, рН слюны меньше 5 единиц способствует развитию кариеса.
Постоянство рН различных биологических жидкостей обеспечивается благодаря наличию в организме многочисленных регулирующих систем: легкие , кишечник, почки, кожа и др.
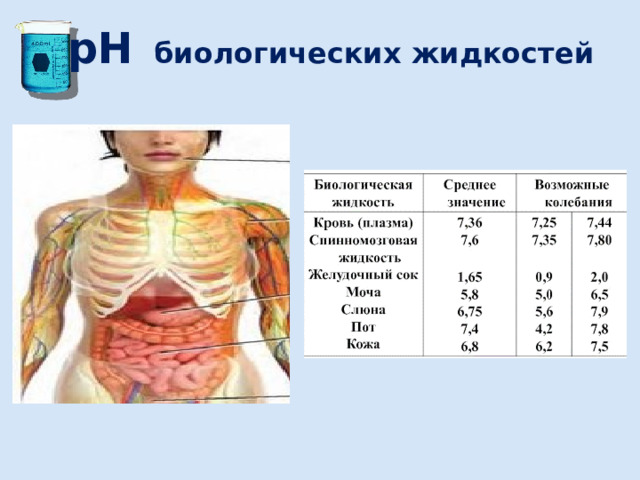
рН биологических жидкостей

Кислотно-основное состояние (КОС) организма человека
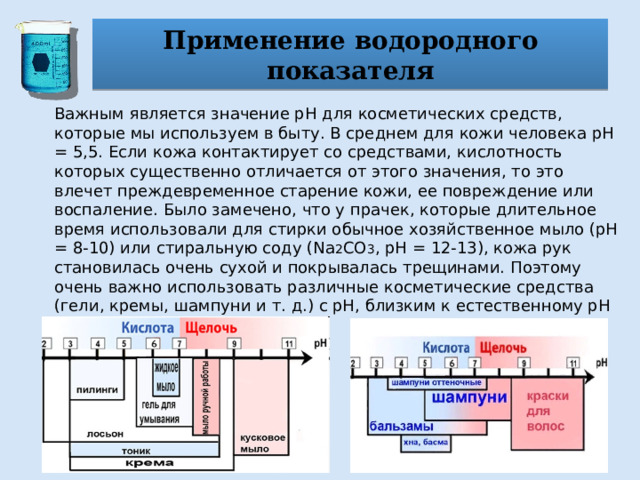
Применение водородного показателя
Важным является значение pH для косметических средств, которые мы используем в быту. В среднем для кожи человека pH = 5,5. Если кожа контактирует со средствами, кислотность которых существенно отличается от этого значения, то это влечет преждевременное старение кожи, ее повреждение или воспаление. Было замечено, что у прачек, которые длительное время использовали для стирки обычное хозяйственное мыло (pH = 8-10) или стиральную соду (Na 2 CO 3 , pH = 12-13), кожа рук становилась очень сухой и покрывалась трещинами. Поэтому очень важно использовать различные косметические средства (гели, кремы, шампуни и т. д.) с pH, близким к естественному pH кожи.






![Электролитическая диссоциация воды Вода проявляет свойства слабого электролита Диссоциация воды происходит в очень незначительной степени: в 1 л воды на ионы распадается только 1 • 10 -7 моль молекул. По уравнению электролитической диссоциации воды видно, что вода электролит , проявляющий амфотерные свойства: H 2 O H + + OH ион Н + - носитель кислотных свойств, ион ОН - - обуславливает щелочные свойства воды Как видно из уравнения диссоциации в жидкой воде концентрация ионов водорода приблизительно равна концентрации ионов гидроксила и поэтому можно написать, что в воде [Н + ] = [ОН - ]](https://fsd.multiurok.ru/html/2021/12/19/s_61bf61d0cdfc2/img1.jpg)
![Ионное произведение воды. Равновесие процесса диссоциации воды H 2 O H + + OH описывается константой Кw, которая носит название “ионное произведение воды”. Ионное произведение воды - произведение концентраций ионов водорода и гидроксид-ионов в воде. Для чистой воды и для разбавленных водных растворов при неизменной температуре произведение концентрации ионов водорода и гидроксид-ионов есть величина постоянная. К Н 2 О = [Н + ][ОН - ] = 10 -7 10 -7 = 10 -14 моль/л при температуре 25 0 С](https://fsd.multiurok.ru/html/2021/12/19/s_61bf61d0cdfc2/img2.jpg)
![Водородный показатель (рН) Реакцию того или иного раствора принято характеризовать концентрацией водородных ионов. Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН. Водородный показатель – десятичный логарифм концентрации ионов Н + , взятый с обратным знаком: рН = -lg[H + ] Например, если [Н + ] = 10 -5 моль/л, то lg 10 -5 = - 5, т.е. рН=5 Обозначение рН ввел в научный обиход в 1909 датский физикохимик и биохимик С.П.Л.Сёренсен, который занимался в то время изучением процессов, происходящих при сбраживании пивного солода, и их зависимостью от кислотности среды. Буква “р” — начальная от датского слова potenz (степень), “Н” — символ водорода. Сёрен Педер Лауриц Сёренсен (1868-1939)](https://fsd.multiurok.ru/html/2021/12/19/s_61bf61d0cdfc2/img3.jpg)





















