
УЭ – 0.
Цель. Изучение нового класса
неорганических веществ.

Домашнее задание
§ 22 по учебнику Габриелян О.С. Химия 8 класс.
На оценку «5» - зад. 1-3 на стр.133
На оценку «4» - зад. 1,2 на стр.133
На оценку «3» - зад. 1 на стр.133

УЭ – 1.
Цель. Определить исходный уровень знаний о классификации неорганических веществ

Распределить предложенные вещества по классам, дать определения известных классов, названия веществ
NaCl
Li 2 O
S O 2
Mg O
CaC O 3
Н NO 3
H 3 PO 4
Fe(OH) 3
K O H
C a 3 (P O 4 ) 2
C a (OH) 2
H 2 SO 4

ОКСИДЫ
вещества, состоящие из … ,
… один из которых – …
в с.о. =

ОСНОВАНИЯ
вещества, состоящие из атома
… и одной или нескольких
…

КИСЛОТЫ
вещества, состоящие из атомов … и … …

1 вариант
2 вариант
MgO – оксид магния
S O 2 – оксид серы ( IV)
Li 2 O –оксид лития
( 2 балла за каждый правильный ответ)
H 3 PO 4 – фосфорная кислота
H N O 3 – азотная кислота
H 2 SO 4 – серная кислота
(2 балла за каждый правильный ответ)
3 вариант
K O H – гидроксид калия
C a (OH) 2 – гидроксид кальция
Fe(OH) 3 – гидроксид железа (III)
(2 балла за каждый правильный ответ)
Внесите заработанные баллы в листок учета знаний

NaCl CaC O 3 C a 3 (P O 4 ) 2

УЭ – 2.
Цель . Определение темы, цели и задач урока.

Тема урока: « СОЛИ»
Цель урока: сформировать понятие о солях
ЗАДАЧИ УРОКА: изучить состав, строение,
физические свойства солей.

УЭ – 3.
Цель . Р ассмотрение правил составления формул солей, номенклатуру солей.
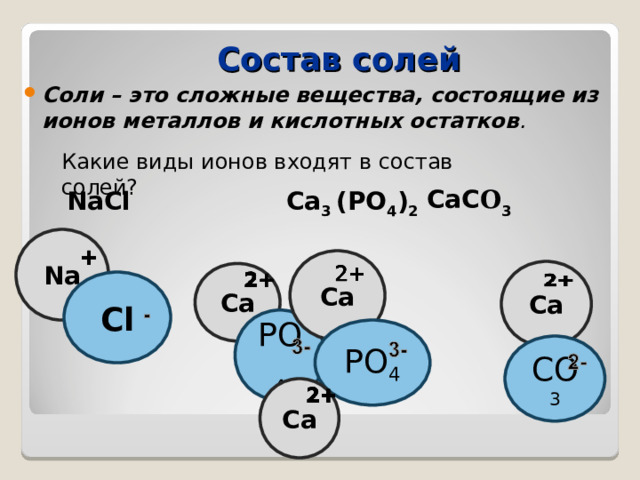
Состав солей
- Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков .
Какие виды ионов входят в состав солей?
CaC O 3
NaCl Ca 3 (PO 4 ) 2
Na
Ca
Ca
Ca
Cl
PO 4
PO 4
CO 3
Ca
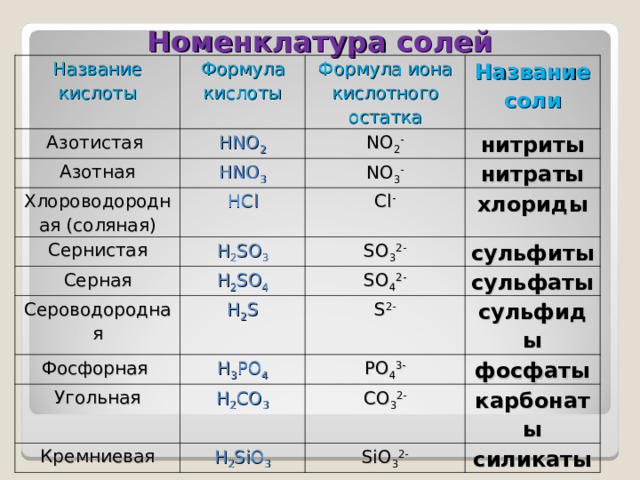
Номенклатура солей
Название кислоты
Формула кислоты
Азотистая
Азотная
Формула иона кислотного остатка
HNO 2
Хлороводородная (соляная)
HNO 3
NO 2 -
Название соли
нитриты
NO 3 -
HCl
Сернистая
нитраты
Cl -
H 2 SO 3
Серная
H 2 SO 4
хлориды
SO 3 2-
Сероводородная
сульфиты
SO 4 2-
H 2 S
Фосфорная
сульфаты
S 2-
H 3 PO 4
Угольная
Кремниевая
сульфиды
PO 4 3-
H 2 CO 3
H 2 SiO 3
фосфаты
CO 3 2-
карбонаты
SiO 3 2-
силикаты

Составление формулы соли
4. Проверка : произведение значения заряда металла на его индекс должно быть равно аналогичному произведению кислотного остатка
Порядок действий
Пример
2*3 = 6
6 : 2 = 3 (индекс)
С a 2+ 3 PO 4 3-
6 : 3 = 2 (индекс)
С a 2+ 3 ( PO 4 3- ) 2
1. Записать химические знаки металла и кислотного остатка, указать их заряды
2. Найти наименьшее общее кратное значений зарядов
3. Разделить полученное число:
а) на заряд металла и записать индекс справа внизу от знака металла;
б) на заряд кислотного остатка и записать индекс кислотного остатка
С a 2+ PO 4 3-
2*3 = 6
С a 2+ 3 ( PO 4 3- ) 2
( 2 +) ∙ 3 = 6 +
(3 -) ∙ 2 = 6 –
(6 +) + (6-)= 0
С a 2+ PO 4 3-

УЭ – 4.
Цель . Решение экспериментальной задачи по определению растворимости солей в воде.

УЭ – 5
Цель. Проверить усвоение знаний по теме.

Выполните задания:
1) дайте названия веществ:
CuSO 4 , Al ( NO 3 ) 3 , Fe ( NO 2 ) 3 , Mg 3 ( PO 4 ) 2 , K 2 SO 3 ;
2) решите задачу.
Какое количество вещества соответствует
34,2 мг сульфата алюминия. Сколько
молекул содержится в данном количестве?
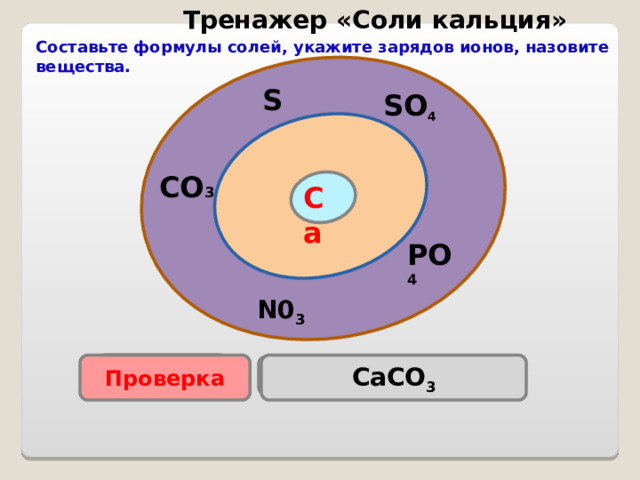
Тренажер «Соли кальция»
Составьте формулы солей, укажите зарядов ионов, назовите вещества.
S
SO 4
CO 3
Са
PO 4
N0 3
Проверка
CaCO 3
Проверка
Ca(NO 3 ) 2
Са 3 ( PO 4 ) 2
Са S О 4
CaS
Проверка
Проверка
Проверка

CuSO 4 – сульфат меди (II)
Al ( NO 3 ) 3 – нитрат алюминия
Fe ( NO 2 ) 3 – нитрит железа (III)
Mg 3 ( PO 4 ) 2 – фосфат магния
K 2 SO 3 – сульфит калия
( 1 балл за каждый правильный ответ)

Дано : m (Al 2 (SO 4 ) 3 ) = 34,2 мг
Найти : n=? N=?
Решение. M ( Al 2 ( SO 4 ) 3 ) = 2х27+ 3 х (32+4х16) = 342мг/моль
1) n = m / M = 34,2/342=0,1 ммоль.
2) N = N a х n ; N = 6х10 20 х 0,1=6х10 19 молекул.
(2 балла за правильный ответ)

УЭ – 6. Рефлексия. Совершая массажные движения вдоль пальцев рук, ответьте на вопросы:
- МИЗИНЕЦ . Какие знания, опыт я сегодня получил?
- БЕЗЫМЯННЫЙ . Что я делал и чего достиг?
- СРЕДНИЙ . Какое у меня настроение?
- УКАЗАТЕЛЬНЫЙ . Кому я сегодня помог, чем порадовал, чему поспособствовал?
- БОЛЬШОЙ . Что я сделал для своего здоровья?
















































