Просмотр содержимого документа
«Урок-презентация "Гидролиз солей". Химия 11 кл.»


Цель урока:
- сформировать у учащихся понятие гидролиза солей.

Задачи урока:
- Научить учащихся определять характер среды растворов солей по их составу, составлять ионные уравнения реакций гидролиза солей по первой стадии;
- углубить их знание свойств солей, понимание практического гидролиза в природе и жизни человека;
- развить мышление учащихся, умение делать логические выводы из наблюдений по опыту;
- закрепить умения и навыки химического эксперимента работать с таблицами, справочным материалом, дополнительной литературой.

Задача:
При сливании раствора, содержащего 5 моль хлорида железа( III ), с избытком раствора кальцинированной соды выделяется газ и выпадает осадок. Определите массу выпавшего осадка.

Дано:
V(FeCl 3 ) = 5 моль
m (осадка)=?
Решение:
2 FeCl 3 +3Na 2 CO 3 = 6NaCl + Fe 2 (CO 3 ) 3
 7,то среда щёлочная, при этом [Н + ] Если рН [ ОН - ] " width="640"
7,то среда щёлочная, при этом [Н + ] Если рН [ ОН - ] " width="640"
Гидролиз соли - это взаимодействие ионов соли с водой. Известно, что молекула воды хотя и не значительно, но все же диссоциирует на ионы Н + и ОН - . Для определения кислотности или щёлочности среды пользуются водородным показателем pH .
- Если рН = 7,то среда нейтральная и при этом [Н + ] = [ ОН - ] = 10 -7 моль/л.
- Если рН 7,то среда щёлочная, при этом [Н + ]
![Гидролиз хлорида железа ( III ) FeCl 3 + HOH ↔ HCl + FeOHCl 2 Fe 3+ +3 Cl - + HOH ↔ H + + Cl - + FeOH 2+ + 2 Cl - Fe 3+ + HOH ↔ FeOH 2+ + H + ; pH [ ОН - ] Раствор соли, образованной слабым основанием и сильной кислотой, имеет кислую среду, так как имеется избыток ионов водорода.](https://fsd.multiurok.ru/html/2023/02/18/s_63f088e630508/img6.jpg)
Гидролиз хлорида железа ( III )
FeCl 3 + HOH ↔ HCl + FeOHCl 2
Fe 3+ +3 Cl - + HOH ↔ H + + Cl - + FeOH 2+ + 2 Cl -
Fe 3+ + HOH ↔ FeOH 2+ + H + ; pH [ ОН - ]
- Раствор соли, образованной слабым основанием и сильной кислотой, имеет кислую среду, так как имеется избыток ионов водорода.
 7 [H + ] Раствор соли, образованный сильным основанием и слабой кислотой, имеет щелочную среду, так как имеется избыток гидроксид анионов. " width="640"
7 [H + ] Раствор соли, образованный сильным основанием и слабой кислотой, имеет щелочную среду, так как имеется избыток гидроксид анионов. " width="640"
Гидролиз карбоната натрия
Na 2 CO 3 + HOH ↔ NaOH + NaHCO 3
2Na + + CO 3 2- + HOH↔ Na + +OH - +HCO 3 -
CO 3 2- + HOH ↔ OH - + HCO 3 -
pH 7
[H + ]
- Раствор соли, образованный сильным основанием и слабой кислотой, имеет щелочную среду, так как имеется избыток гидроксид анионов.
![Гидролиз хлорида натрия NaCl +HOH ↔ NaOH + HCl Na + + Cl - + HOH ↔ Na + + OH - + H + + Cl - HOH↔ OH - + H + pH = 7 [H + ]= [OH - ] Раствор соли, образованной сильным основанием и сильной кислотой, имеет нейтральную среду, так как равенство концентраций ионов водорода и гидроксид–ионов не нарушено. Можно сказать, что такие соли гидролизу не подвергаются.](https://fsd.multiurok.ru/html/2023/02/18/s_63f088e630508/img8.jpg)
Гидролиз хлорида натрия
NaCl +HOH ↔ NaOH + HCl
Na + + Cl - + HOH ↔ Na + + OH - + H + + Cl -
HOH↔ OH - + H +
pH = 7
[H + ]= [OH - ]
- Раствор соли, образованной сильным основанием и сильной кислотой, имеет нейтральную среду, так как равенство концентраций ионов водорода и гидроксид–ионов не нарушено. Можно сказать, что такие соли гидролизу не подвергаются.

Гидролиз карбоната железа ( III )
Fe 2 (CO 3 ) 3 + 3HOH → 2Fe(OH) 3 ↓ + 3CO 2 ↑
- Соли, образованные слабым основанием и слабой кислотой, подвергаются необратимому гидролизу, то есть полностью разлагаются с образованием осадка и выделением газа.

Задача:
При сливании раствора, содержащего 5 моль хлорида железа( III ), с избытком раствора кальцинированной соды выделяется газ и выпадает осадок. Определите массу выпавшего осадка.

Дано:
V(FeCl 3 ) = 5 моль
m (осадка)=?
Решение:
2 FeCl 3 +3Na 2 CO 3 + 3H 2 O= 2Fe(OH) 3 ↓ + 3CO 2 ↑ + 6NaCl
v (Fe(OH) 3 ) = v (FeCl 3 ) = 5 моль
m ( Fe ( OH ) 3 ) = M ∙ v = 107∙ 5= 535г
Ответ: Масса выпавшего осадка составляет 535г.

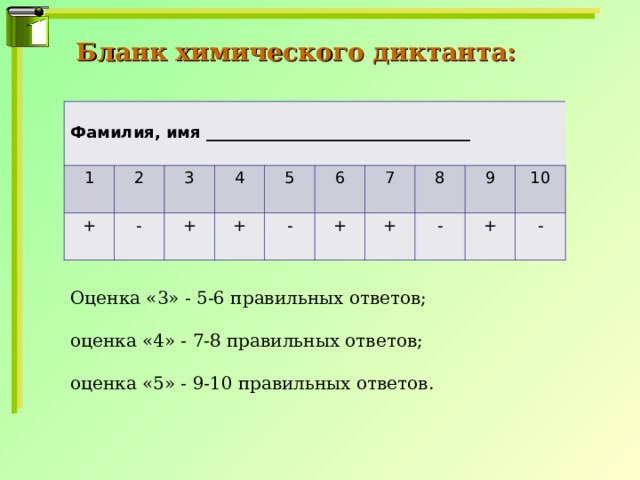
Бланк химического диктанта:
Фамилия, имя _________________________________
1
2
3
4
5
6
7
8
9
10
«+» - да
«-» - нет

Диктант:
- В чистой воде рН = 7.
- Раствор соляной кислоты- слабый электролит.
- Соль Na 2 CO 3 образована сильным основанием и слабой кислотой.
- Соль AlCl 3 образована слабым основанием и сильной кислотой.
- Водный раствор соли NaCl имеет рН
- Водный раствор соли K 2 SO 4 имеет рН = 7.
- Водный раствор соли Al 2 ( SO 4 ) 3 имеет рН
- Соль KNO 3 подвергается необратимому гидролизу с выпадением осадка.
- Раствор соли Na 2 SiO 3 при действии фенолфталеина окраситься в малиновый цвет.
- Раствор соли K 2 CO 3 при действии фенолфталеина остается бесцветным.
Бланк химического диктанта:
Фамилия, имя _________________________________
1
2
+
3
-
4
+
5
+
6
-
7
+
8
+
9
-
10
+
-
Оценка «3» - 5-6 правильных ответов;
оценка «4» - 7-8 правильных ответов;
оценка «5» - 9-10 правильных ответов.

Домашнее задание
- § 18, ответить на вопросы 6-8 стр. 74;

Спасибо за урок!











 7,то среда щёлочная, при этом [Н + ] Если рН [ ОН - ] " width="640"
7,то среда щёлочная, при этом [Н + ] Если рН [ ОН - ] " width="640"
![Гидролиз хлорида железа ( III ) FeCl 3 + HOH ↔ HCl + FeOHCl 2 Fe 3+ +3 Cl - + HOH ↔ H + + Cl - + FeOH 2+ + 2 Cl - Fe 3+ + HOH ↔ FeOH 2+ + H + ; pH [ ОН - ] Раствор соли, образованной слабым основанием и сильной кислотой, имеет кислую среду, так как имеется избыток ионов водорода.](https://fsd.multiurok.ru/html/2023/02/18/s_63f088e630508/img6.jpg)
 7 [H + ] Раствор соли, образованный сильным основанием и слабой кислотой, имеет щелочную среду, так как имеется избыток гидроксид анионов. " width="640"
7 [H + ] Раствор соли, образованный сильным основанием и слабой кислотой, имеет щелочную среду, так как имеется избыток гидроксид анионов. " width="640"
![Гидролиз хлорида натрия NaCl +HOH ↔ NaOH + HCl Na + + Cl - + HOH ↔ Na + + OH - + H + + Cl - HOH↔ OH - + H + pH = 7 [H + ]= [OH - ] Раствор соли, образованной сильным основанием и сильной кислотой, имеет нейтральную среду, так как равенство концентраций ионов водорода и гидроксид–ионов не нарушено. Можно сказать, что такие соли гидролизу не подвергаются.](https://fsd.multiurok.ru/html/2023/02/18/s_63f088e630508/img8.jpg)


















