
Уравнение состояния идеального газа

Зависимость давления газа от концентрации его молекул и температуры: p = nkT .
Можно получить уравнение, связывающее все три макроскопических параметра р, V и Т, характеризующие состояние идеального газа данной массы.
p = kT
p = nkT
k = R - универсальная (молярная) газовая постоянная
n =
R = 6,02 • •1,38 • = 8,31
N =
p = RT
- уравнение состояния идеального газа произвольной массы
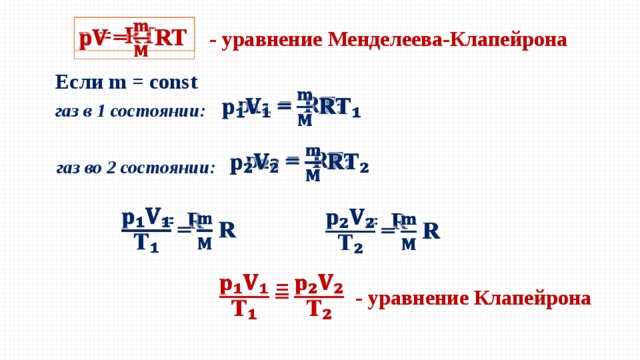
p = RT
- уравнение Менделеева-Клапейрона
Если m = const
p ₁₁ = RT ₁
газ в 1 состоянии:
p ₂₂ = RT ₂
газ во 2 состоянии:
= R
= R
=
- уравнение Клапейрона

Дмитрий Иванович Менделеев (1834-1907) - русский учёный-энциклопедист: химик, физикохимик, физик, метролог, экономист, технолог, геолог, метеоролог, нефтяник, педагог, преподаватель, воздухоплаватель, приборостроитель.
Профессор Санкт-Петербургского университета; член-корреспондент (по разряду «физический») Императорской Санкт-Петербургской Академии наук.
Бенуа Поль Эмиль Клапейрон (1799-1864)- французский физик и инженер. Член-корреспондент Петербургской академии наук. В течение 10 лет работал в России профессором в институте путей сообщения. Вернувшись во Францию, участвовал в постройке многих железных дорог и составил множество проектов по постройке мостов и дорог.
Его имя внесено в список величайших учёных Франции, помещённый на первом этаже Эйфелевой башни.

Экспериментальная проверка уравнения состояния
Герметический гофрированный сосуд с манометром, регистрирующим давление внутри сосуда.
При вращении винта объем сосуда меняется. Об объеме можно судить с помощью линейки.
Температура газа в сосуде равна температуре окружающего воздуха и регистрируется термометром.

Экспериментальная проверка уравнения состояния
p ₁; V ₁; T ₁
- вычислить
- вычислить
p ₁; V ₁; T ₁
Не выполняется при давлениях в тысячи атмосфер.
Плотные газы нельзя даже приближенно считать идеальными.

Определите массу водорода, находящегося в баллоне вместимостью 20 л под давлением 830 кПа при температуре 17 °С.
Дано:
p = RT
- уравнение Менделеева-Клапейрона
M = 2 •
m =
V = 20 л
= 20 • м ³
p = 830 кПа
= 8,3 • 10 ⁵ Па
m = =
= 0,14 • кг = 0,014 кг
T = 290 К
t = 17°C
R = 8,31
m -?

Какое давление рабочей смеси установилось в цилиндрах двигателя внутреннего сгорания, если к концу такта сжатия температура повысилась с 47 до 367 °С, а объем уменьшился с 1,8 до 0,3 л? Первоначальное давление было 100 кПа.
газ в 1 состоянии:
t = 47°C
V = 1,8 л
p = 100 кПа
газ во 2 состоянии:
t = 367°C
V = 0,3 л
p - ?
m = const
=
- уравнение Клапейрона

Дано:
=
m = const
p ₁ = 100 кПа = 10 ⁵ Па
p ₂ =
=
V ₁ = 1,8 л
= 1,8 • м ³
T ₁ = 320 К
t ₁ = 47°C
p ₂ = =
= 12•= 1,2•
= 0,3 • м ³
V ₂ = 0,3 л
t ₂ = 367°C
T ₂ = 640 К
p ₂ - ?

Подумайте…
1 вариант
2 вариант
1. Если при сжатии объём идеального газа уменьшился
в 2 раза, а давление газа увеличилось в 2 раза, то во сколько раз изменилась при этом абсолютная температура газа?
1. Во сколько раз изменяется давление идеального газа при уменьшении объёма идеального газа в 2 раза и увеличении его абсолютной температуры в 4 раза?

2. Идеальный газ в цилиндре переводится из состояния А в состоянии В так, что его масса при этом не изменяется. Параметры, определяющие состояния газа, приведены в таблице. Какое число должно быть в свободной клетке таблицы?
p, 10 ⁵ Па
Состояние A
p, 10 ⁵ Па
Состояние A
Состояние B
V, 10 ⁻³ м³
Состояние B
V, 10 ⁻³ м³
1,0
1,0
, К
4
4
1,5
1,5
8
8
900
900
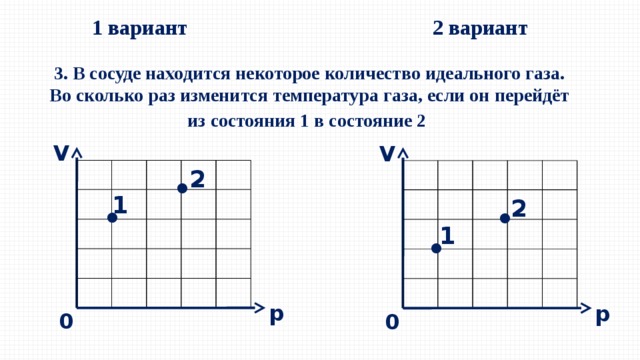
1 вариант
2 вариант
3. В сосуде находится некоторое количество идеального газа. Во сколько раз изменится температура газа, если он перейдёт из состояния 1 в состояние 2
V
V
2
•
1
2
•
•
1
•
p
p
0
0

=
Проверим…
2 вариант
1 вариант
1. Если при сжатии объём идеального газа уменьшился
1. Во сколько раз изменяется давление идеального газа при уменьшении объёма идеального газа в 2 раза и увеличении его абсолютной температуры в 4 раза?
в 2 раза, а давление газа увеличилось в 2 раза, то во сколько раз изменилась при этом абсолютная температура газа?
= = • 2 • 4 = 8 p ₁
= = 2 • •

2. Идеальный газ в цилиндре переводится из состояния А в состоянии В так, что его масса при этом не изменяется. Параметры, определяющие состояния газа, приведены в таблице. Какое число должно быть в свободной клетке таблицы?
p, 10 ⁵ Па
p, 10 ⁵ Па
Состояние A
Состояние A
1,0
1,0
V, 10 ⁻³ м³
Состояние B
V, 10 ⁻³ м³
Состояние B
4
1,5
4
1,5
, К
300
300
8
8
900
900
=
=
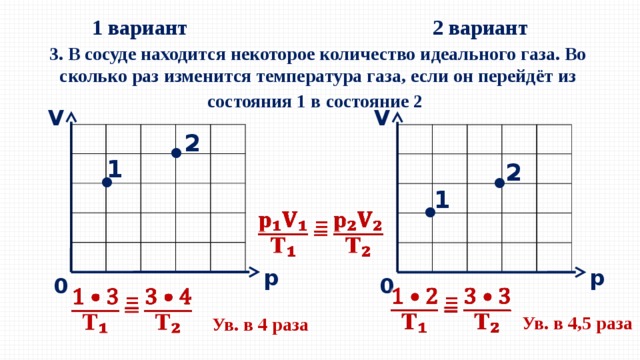
1 вариант
2 вариант
3. В сосуде находится некоторое количество идеального газа. Во сколько раз изменится температура газа, если он перейдёт из состояния 1 в состояние 2
V
V
2
•
1
2
•
•
1
•
=
p
p
0
0
=
=
Ув. в 4,5 раза
Ув. в 4 раза
































