

Периодический закон и периодическая система элементов Д.И. Менделеева

Открытие Периодического закона
В основу своей классификации химических элементов Д.И. Менделеев положил два их основных и постоянных признака:
- величину атомной массы
- свойства образованных химическими элементами веществ .
И только с открытием строения атома, удалось грамотно сформулировать периодический закон

Открытие Периодического закона
При этом он обнаружил, что свойства элементов в некоторых пределах изменяются линейно (монотонно усиливаются или ослабевают), затем после резкого скачка повторяются периодически , т.е. через определённое число элементов встречаются сходные .

Первый вариант Периодической таблицы
На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной своей формулировке звучал так : свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов

Периодический закон
Д.И. Менделеева
Если написать ряды один под другим так, чтобы под литием находился натрий , а под неоном – аргон , то получим следующее расположение элементов:
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
При таком расположении в вертикальные столбики
попадают элементы, сходные по своим свойствам.
При переходе от лития к фтору происходит закономерное ослабление металлических свойств и усиление неметаллических.
При переходе от фтора к следующему по значению атомной массы элементу натрию происходит скачок в изменении свойств ( Nа повторяет свойства Li )

Периодический закон Д.И. Менделеева
Современная трактовка Периодического закона:
Свойства химических элементов и образуемых ими соединений находятся в периодической зависимости от величины заряда их атомных ядер.
Почему существует такая зависимость можно понять разобравшись со строением атома, но это позже.
А в этой теме мы разберем строение периодической системы и отметим закономерности изменения свойств атомов.

Р
19
30,974
ФОСФОР
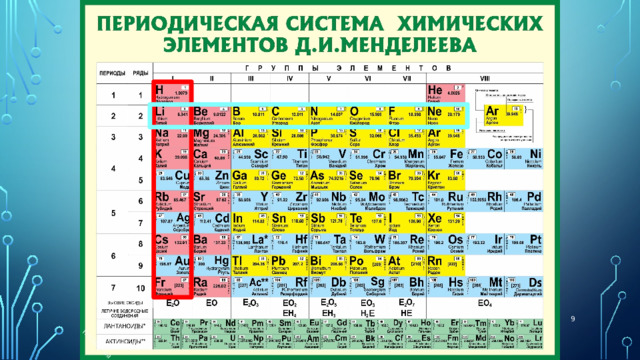
Итак периодическая система состоит из ячеек, В КОТОРЫХ ЕСТЬ СИМВОЛ хэ, ЕГО НАЗВАНИЕ. ПОРЯДКОВЫЙ НОМЕР И ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
ЭТИ ЯЧЕЙКИ складываются в вертикальные и горизонтальные ряды.
8
Итак периодическая система состоит из ячеек, В КОТОРЫХ ЕСТЬ СИМВОЛ хэ, ЕГО НАЗВАНИЕ. ПОРЯДКОВЫЙ НОМЕР И МАССА АТОМА ИЛИ МАССОВОЕ ЧИСЛО
ЭТИ ЯЧЕЙКИ складываются в вертикальные и горизонтальные ряды.
8
8

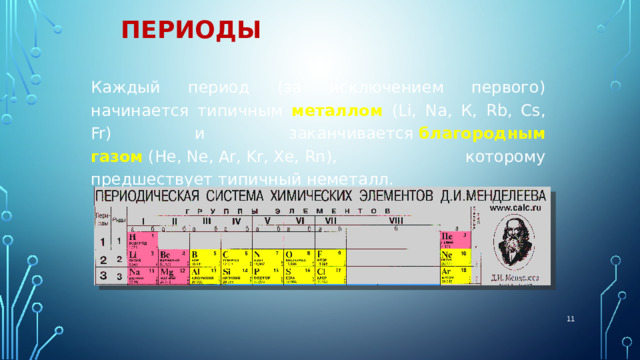
Периоды
Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и большие (IV,V,VI), VII-незаконченный.
8
8
Периоды
Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.
8

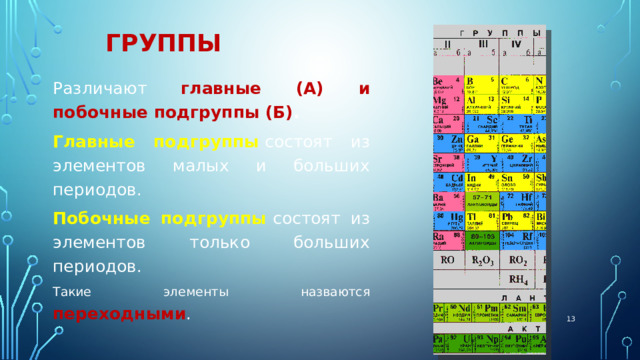
Группы
вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне , равным номеру группы.
8
8
Группы
Различают главные (А) и побочные подгруппы (Б) .
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
Такие элементы назваются переходными .
8
8

Переходные элементы В ТАБЛИЦЕ ОБЫЧНО ВЫДЕЛЕНЫ ОТДЕЛЬНЫМ ЦВЕТОМ. ЗДЕСЬ окрашены в голубой цвет.
Элементы главных подгрупп по химическим свойствам значительно отличаются от элементов побочных подгрупп. Особенно наглядно это различие в VII и VIII группах периодической системы элементов.
Например главную подгруппу в VIII группе составляют благородные газы He, Ne, Ar, Kr, Xe, Rn (РОДОН), а побочная подгруппа представлена триадами элементов: Fe, Co, Ni — в IV периоде, Ru, Rh, Pd — в V периоде, Os, Ir, Pt — в VI периоде. В отличие от благородных газов названные элементы имеют ярко выраженные металлические свойства.
8
8

Периодическая таблица химических элементов
Запомнить!!!
- Номер периода = число энергетических уровней атома .
- Номер группы = число внешних электронов атома .
(Для элементов главных подгрупп)
в котором находится элемент
8
8

Валентность
Номер группы показывает высшую валентность элемента по кислороду .
Поскольку внешние электроны отвечают за образование связей между атомами, то номер группы связан с валентностью следующим правилами:
Это значит что в соединениях с кислородом , т.е. в оксидах, атомы проявляют валентность равную номеру группы. Это справедливо для высших оксидов.
Мы видим, что в этих соединенияхвалентность возрастает от 1 до 8
8

Валентность
- Элементы IV, V, VI и VII групп образуют летучие водородные соединения.
- Номер группы показывает валентность элемента в соединениях с водородом .
8-№группы
Элементы главных подгрупп характеризуются также валентностью по водороду.
Поскольку, Элементы IV, V, VI и VII групп образуют летучие водородные соединения.
Номер группы = валентность элемента в соединениях с водородом .
8
8
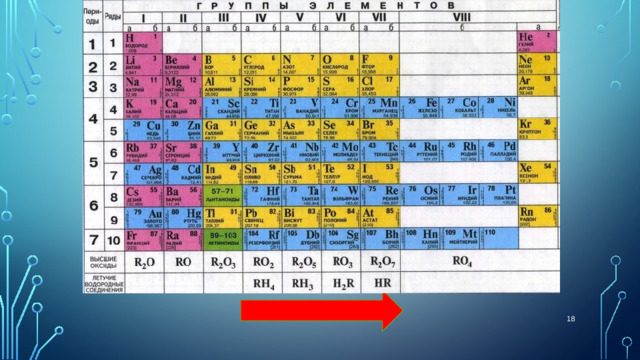
Валентность по водороду при переходе от элементов IV группы к элементам VII группы уменьшается от 4 до 1. Напротив, валентность этих элементов по кислороду в том же направлении возрастает от 4 до 7.
8
8

Задание:
- Назовите в каком периоде и в какой группе, подгруппе находятся следующие химические элементы:
- Натрий, Медь, Углерод, Сера, Хлор, Хром, Железо, Бром
8
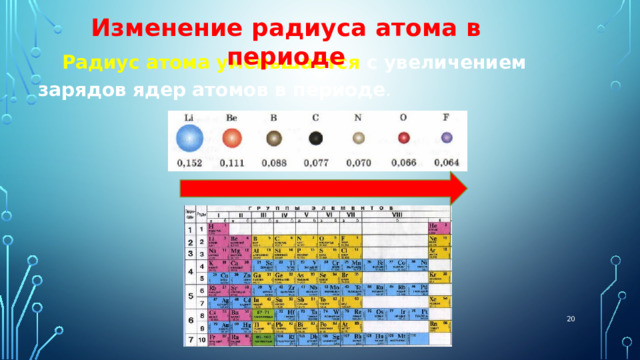
Изменение радиуса атома в периоде
Радиус атома уменьшается с увеличением зарядов ядер атомов в периоде .
В начале периода расположены элементы с небольшим числом электронов на внешнем электронном слое и, соответственно, большим радиусом атома .
8
8

Изменение радиуса атома в периоде
В одной группе с увеличением номера периода атомные радиусы возрастают .
8

Изменение радиусов атомов в таблице Д.И. Менделеева
В правом верхнем углу располагаются эл. С наименьшим радиусом
8
8

Задание:
- Сравните радиусы следующих химических элементов:
- Литий, натрий, калий
- Бор, углерод, азот
- Кислород, Сера, селен
- Йод, Хлор, фтор
- Хлор, сера, фосфор
8

Электроотрицательность
Электроотрицательность - это способность атома притягивать электронную плотность .
Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо .
Электроотрицательность - это способность атома притягивать электронную плотность .
Или это способность атомов оттягивать к себе электроны других атомов
Чем больше положительный заряд в ядре атома, тем больше притяжение к этому ядру
Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо . .
8
8
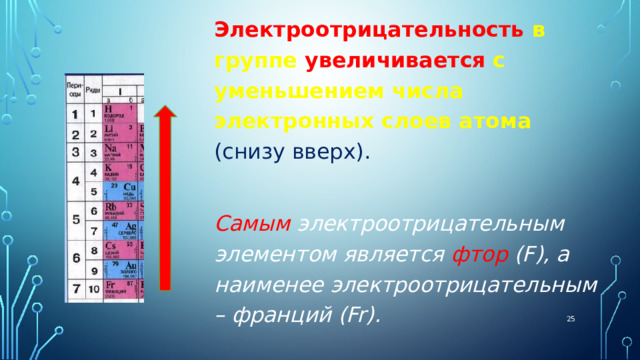
Электроотрицательность в группе увеличивается с уменьшением числа электронных слоев атома (снизу вверх).
Самым электроотрицательным элементом является фтор (F), а наименее электроотрицательным – франций (Fr).
8

ОТНОСИТЕЛЬНАЯ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
АТОМОВ
Н
2,1
О
В
С
Be
N
F
3,07
2,0
3,5
2,5
4,0
1,5
S
Сl
Mg
Al
P
Si
2,6
2,2
3,0
1,9
1,6
1,2
As
Ga
Se
Ca
Ge
Br
2,8
1,8
2,5
2,0
1,04
2,1
In
Sb
Sr
I
Sn
Те
1,5
2,6
2,1
0,99
1,7
1,8
Li
0,98
Na
0,93
К
0,91
Rb
0,89
Давайте посмотрим на численные значения ЭО для следующих элементов в таблице.
Мы видим, что действительно ЭО растет слева-направо и снизу – вверх.
Т.е. , можно сказать, что она увеличивается в таблице Менделеева По диагонали
Т.о. ,еще раз отмечу, Самым электроотрицательным элементом является фтор (F)
Существует Наиболее распространённая шкала относительных атомных электроотрицательностей Полинга, которая охватывает значения от 0,7 для атомов франция или 0,79 для цезия и до 4,0 для атомов фтора.
8
8

Задание:
- Сравните ЭО следующих химических элементов:
- Натрий и кислород
- Углерод и водород
- Кислород и фтор
- Бор и азот
- Йод, фтор
- Хлор, фосфор
8

Окислительно-восстановительные
свойства
Восстановительные свойства атомов - способность терять электроны при образовании химической связи.
Окислительные свойства атомов -способность принимать электроны при образовании химической связи.
1) С понятием ЭО напрямую связаны следующие свойства простых веществ
Восстановительные свойства атомов - способность терять электроны при образовании химической связи.
Окислительные свойства атомов -способность принимать электроны при образовании химической связи.
8
8

Окислительно-восстановительные
свойства
В главных подгруппах снизу вверх, в периодах – слева направо окислительные свойства простых веществ элементов возрастают , а восстановительные свойства, соответственно, убывают.
8
8
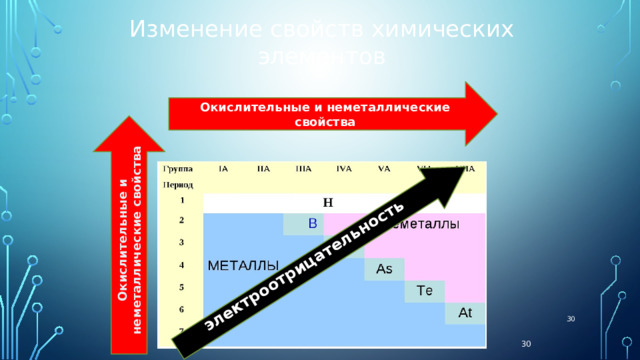
электроотрицательность
Окислительные и неметаллические свойства
Изменение свойств химических элементов
Окислительные и неметаллические свойства
Т.о. окислительные свойства растут в том же направлении, что и ЭО.
Такое сильное различие в ОК-ВС свойствах разделяет табл.Менделеева на два полюса:
В нижнем левом углу располагаются сильнйшие восстановители - это активные металлы
А в верхнем правом типичные неметаллы – или сильнейшие окислители.
8
8
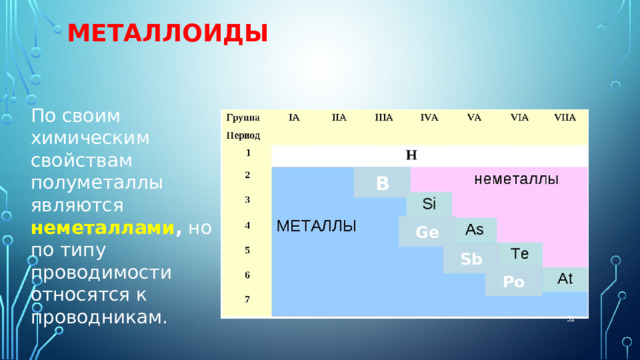
МЕТАЛЛОИДЫ
По своим химическим свойствам полуметаллы являются неметаллами , но по типу проводимости относятся к проводникам.
B
Ge
На границе располагаются элементы, которые обладают свойствами металлов, и неметаллов- их называют МЕТАЛЛОИДЫ ИЛИ ПОЛУМЕТАЛЛЫ
Это: бор (B), кремний (Si), мышьяк (As), сурьма (Sb),теллур (Te), полоний (Po).
По своим химическим свойствам полуметаллы являются неметаллами, но по типу проводимости относятся к проводникам.
Sb
Po
8
8

Cпасибо за внимание!!
8

















































