
Понятие о группах сходных элементов. Современная формулировка ПЗ и его значение.


В 60-е годы 20 века атом считался неделимым, о его внутреннем строении ничего не было известно. Открытие Д. И. Менделеева, с одной стороны, было своевременным (если учесть попытки классификации элементов, сделанные предшественниками), но, с другой – значительно опережало свое время, научное сообщество не было готово к его восприятию. Поэтому сначала работу Менделеева встретили равнодушно, и только после открытия предсказанных им элементов его ждали подлинный триумф и признание во всем мире.

На основании характерных свойств все элементы вначале разделили на две группы
Химические элементы
Неметаллы
Металлы
1. Могут быть твердыми (уголь), жидкими (бром), газообразными (кислород).
2. Металлического блеска не имеют (кроме йода и графита).
3. Хрупкие.
4. Изоляторы тока или полупроводники.
1. Твердые вещества (кроме ртути).
2. Имеют металлический блеск.
3. Ковкие, пластичные.
4. Хорошие проводники теплоты и электричества.
4
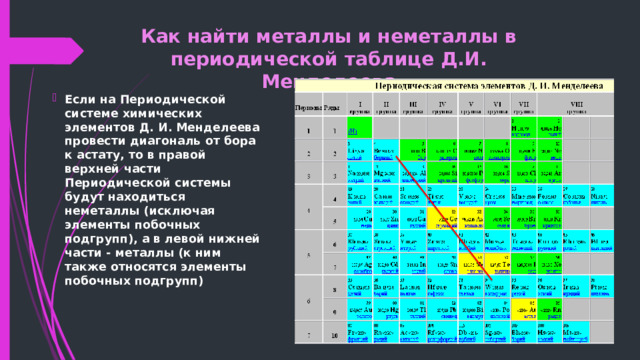
Как найти металлы и неметаллы в периодической таблице Д.И. Менделеева
- Если на Периодической системе химических элементов Д. И. Менделеева провести диагональ от бора к астату, то в правой верхней части Периодической системы будут находиться неметаллы (исключая элементы побочных подгрупп), а в левой нижней части - металлы (к ним также относятся элементы побочных подгрупп)

Первые попытки классификации химических элементов
Попытки систематизации химических элементов предпринимались различными учёными в Германии, Франции, Англии, США с 30-х годов 19 в.
Предшественники Менделеева - И. Дёберейнер, Ж. Дюма, французский химик А. Шанкуртуа, английские химики У. Одлинг, Дж. Ньюлендс, Леопольд Гмелин, Баумгауэр Г. и другие установили существование групп элементов, сходных по химическим свойствам, так называемых "естественных семейств".

Иоганн Вольфанг Деберейнер
В 1829 г. Сформулировал представления о естественных группах элементов (по три элемента), обладающих сходными химическими свойствами. Каждую тройку сходных элементов он назвал триадами, всего он набрал четыре тирады. Остальные элементы остались вне его классификации.


Джон Александр Ньюлендс
В 1856 г. Впервые расположил элементы в порядке увеличения их атомных масс, каждому элементу присвоил номер, сформулировал «закон октав», в соответствии с которым номера аналогичных элементов отличаются на целое число семь или кратное семи. Впервые установил некую периодичность в изменении свойств химических элементов . Однако его октавы содержали ошибки.


Юлиус Лотар Майер
В 1864-1865гг. Опубликовал таблицы, в которых расположил элементы в соответствии с их валентностями.


Недостатки работ предшественников Д. И. менделеева
- Ученые сравнивали только сходные элементы, поэтому никаких сходных закономерностей для всех химических элементов обнаружено не было. Сам Менделеев отмечал, что открытие им Периодического закона связано с работой над книгой «Основы химии», с его размышлениями о том, в какой последовательности представлять сведения о химических элементах. Его путь к открытию периодического закона был долгим и трудным.

Работа над Периодической системой
- Менделеев в качестве основной характеристики атома при построении им Периодической системы выбрал атомный вес элемента (современный термин – атомная масса). Однако он учитывал и химические свойства элементов (их валентности, формы образуемых ими соединений) Расположив все известные элементы в порядке увеличения их атомных масс, Менделеев обнаружил, что в этом ряду наблюдается периодическая повторяемость химических свойств.

- Рассмотрим эту закономерность на примере элементов малых периодов (2-го и 3-го). Свойства типичного металла лития повторяются у натрия и калия, свойства сильного неметалла фтора – у других галогенов (хлор, бром). Такие элементы называют элементами –аналогами.
- Пример: литий – аналог калия, натрия.
- К моменту открытия ПЗ было известно 63 элемента, Менделеев расположил их в своей таблице, не сделав при этом ни одной ошибки, не смотря на то , что атомные массы многих элементов были определены не верно! У 1/3 всех известных тогда элементов он исправил атомные массы, а для двадцати девяти еще не открытых элементов оставил пустые места в таблице!

Почему периодическая система имеет такое название?
- В таблице общие закономерности в изменении свойств атомов образуемых ими соединений повторяются через определенные интервалы –периоды, поэтому вся система называется периодической. Каждый период начинается щелочным металлом и заканчивается инертным газом (кроме 1-го и последнего, 7-го незавершенного периода)

Закономерные изменения свойств, проявляемые в пределах периодов.
- Заряды атомных ядер увеличиваются
- Металлические свойства ослабевают
- Неметаллические свойства усиливаются
- Степень окисления элементов в высших оксидах увеличивается от+1 до +8
- Степень окисления элементов в летучих водородных соединения увеличивается от -4до-1.
- Оксиды от основных через амфотерные сменяются кислотными
- Гидроксиды от щелочей через амфотерные гидроксиды сменяются кислородсодержащими кислотами.
На основании этих наблюдений Д. И. Менделеев в 1869г. сделал вывод – сформулировал Периодический закон

Три формулировки периодического закона
- Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов
- Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
- Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от строения внешних энергетических уровней атомов элементов.

Современное содержание периодического закона
- Третья формулировка фактически раскрывает смысл Периодического закона. Только теория строения атома смогла объяснить периодическое изменение свойств элементов. Периодический закон был открыт в XIX веке, а объяснение ему было дано только в XX веке, после установления строения атома.
Свойства химических элементов и образованных ими соединений находятся в периодической зависимости от периодичности в изменении строения внешних электронных слоев атомов химических элементов

Физический смысл периодического закона
Число электронов на последнем уровне периодически повторяется, поэтому периодически повторяются и свойства элементов и их соединений.

Значение периодического закона Д. И. Менделеева
Периодический закон - один из основных законов природы, основа современной химии. ПЗ и ПСХЭ позволили предсказать существование новых, еще не открытых элементов.
ПЗ позволяет ученым синтезировать новые химические элементы.
Сам Менделеев так писал по этому поводу «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются»

В середине XIX века химические элементы стали объединять в группы, получившие названия естественных семейств. Семейства – это группы химических элементов со сходными физическими и химическими свойствами!
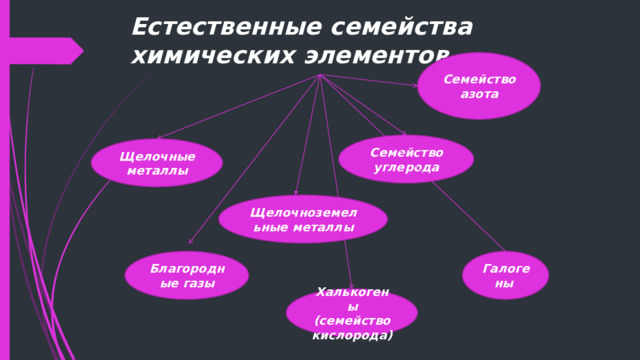
Естественные семейства химических элементов
Семейство азота
Семейство углерода
Щелочные металлы
Щелочноземельные металлы
Благородные газы
Галогены
Халькогены (семейство кислорода)

Щелочные металлы
- Элементы данного семейства: Li, Na, K, Rb, Cs, Fr
- Особенности данного семейства:
А)При взаимодействии с водой образуют щёлочи .
2Na+2H 2 O=2NaOH+H 2
2K+2H 2 O=2KOH+H 2
Б)Имеют общую формулу гидроксидов ROH
В)Мягкие, быстро окисляются кислородом, поэтому хранятся под слоем керосина,
Г)В соединениях одновалентны .
Д) Из всех металлов самые активные .

Щелочноземельные металлы
Ca, Sr, Ba
1. Элементы данного семейства:
2. Особенности данного семейства:
А) Металлы и оксиды этих Ме при взаимодействии с водой образуют щёлочи .
Вa+2H 2 O=Вa(OH) 2 +H 2
BaO+H 2 O=Ba(OH) 2
Б)Все они в соединениях двухвалентные .
В)Образуют оксиды с общей формулой RO, которым соответствуют гидроксиды с общей формулой R(OH) 2.

Галогены
1. Элементы данного семейства:
F, Cl, Br, I, At
2. Особенности данного семейства:
А)Образуют простые вещества, молекулы которых состоят из 2х атомов: F 2 , Cl 2 , Br 2 , I 2 .
Б)Высшая валентность в соединениях с кислородом YII (R 2 O 7 ) ,кроме фтора
В)С водородом образуют летучие соединения, в которых проявляют валентность I (RH) , например: НF.
Г)С металлами образуют соли: NaF
Д)Ядовиты!
Е) Из всех неметаллов самые активные .

Халькогены
1. Элементы данного семейства :
O, S, Se, Te
2. Особенности данного семейства:
А)Образуют кислотные оксиды с общей формулой RO 3 , где проявляют валентность YI.
Б)Этим оксидам соответствуют кислоты состава H 2 RO 4.
В) Химические элементы S, Se, Te называют халькогенами-« рождающие медные руды»
Г) С водородом образуют соединения состава H 2 R .












































