Просмотр содержимого документа
«Презентация " Общая характеристика элементов 6 группы. Кислород и сера." 9 класс.»

ТЕМА 4 КИСЛОРОД И СЕРА
Положение кислорода и серы
в ПСХЭ, строение их атомов.
Аллотропия серы

Цель урока.
- Дать общую характеристику элементов
- VIА-группы на основании положения в периодической таблице и строения атомов.
- Рассмотреть аллотропные модификации серы.
- Основные понятия.
- Аллотропные модификации серы:
- пластическая и кристаллическая
- (ромбическая, моноклинная) сера.
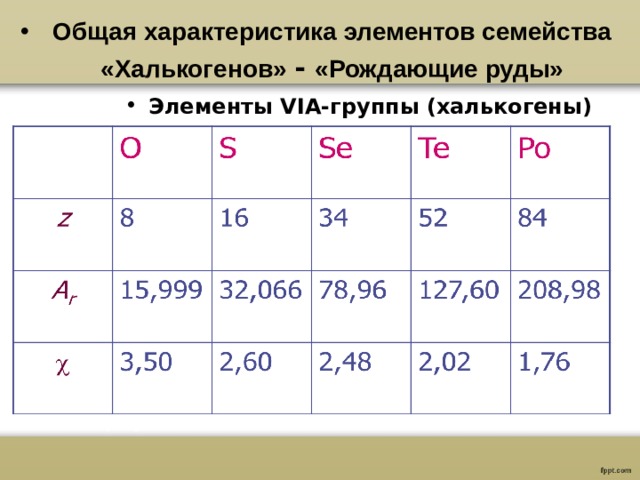
- Общая характеристика элементов семейства «Халькогенов» - «Рождающие руды»
- Элементы VI А-группы (халькогены)
Заполнить таблицу
№
О
1
S
2
3
4
5

План характеристики химического элемента по его положению в периодической таблице элементов
- 1. Название химического элемента. Химический знак элемента.
- 2. Положение в периодической таблице (порядковый номер, номер периода (малый, большой), номер группы, группа (А или Б).
- 3. Металл или неметалл.
- 4. Высшая валентность в кислородных соединениях, формулы высшего оксида, гидроксида и характер их свойств.
- 5. Валентность в водородном соединении, формула летучего водородного соединения (для неметаллов).
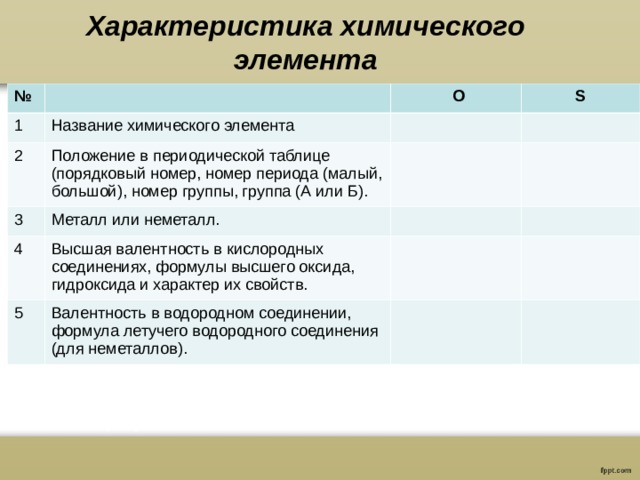
Характеристика химического элемента
№
1
О
Название химического элемента
2
S
Положение в периодической таблице (порядковый номер, номер периода (малый, большой), номер группы, группа (А или Б).
3
Металл или неметалл.
4
Высшая валентность в кислородных соединениях, формулы высшего оксида, гидроксида и характер их свойств.
5
Валентность в водородном соединении, формула летучего водородного соединения (для неметаллов).
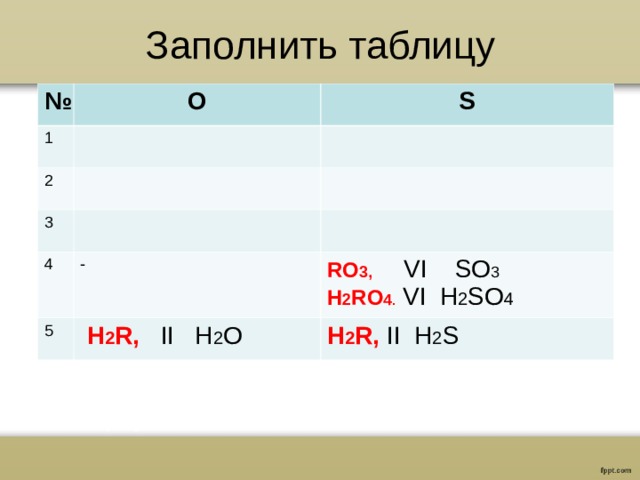
Заполнить таблицу
№
О
1
S
2
3
4
-
5
RO 3, VI SO 3
H 2 RO 4 . VI H 2 SO 4
H 2 R, II H 2 O
H 2 R, II H 2 S
![Элементы VI А-группы (халькогены) Общая электронная формула: […] ns 2 np 4 Степени окисления: O: –II, –I, 0, +I, +II H 2 O; H 2 O 2 ; O 2 ; O 2 F 2 ; OF 2 S, Se, Te : – II, 0, (+II), +IV, +VI H 2 Э ; Э х ; ЭО 2 ; ЭО 3](https://fsd.multiurok.ru/html/2019/12/01/s_5de3e08ca9fb8/img7.jpg)
Элементы VI А-группы (халькогены)
- Общая электронная формула:
[…] ns 2 np 4
H 2 O; H 2 O 2 ; O 2 ; O 2 F 2 ; OF 2
- S, Se, Te : – II, 0, (+II), +IV, +VI
H 2 Э ; Э х ; ЭО 2 ; ЭО 3
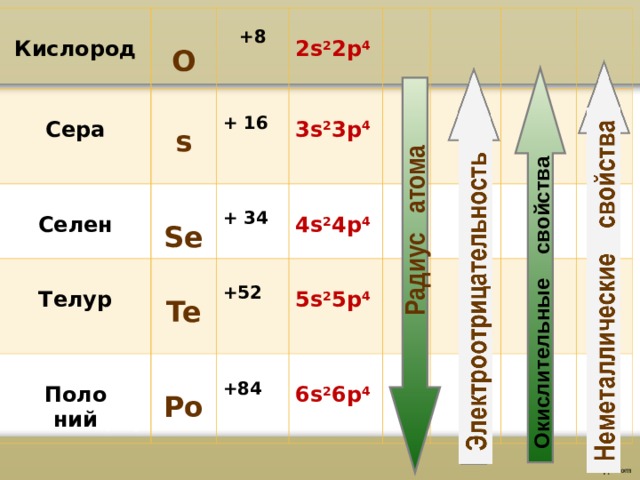
Радиус атома
Окислительные свойства
Кислород
О
s
+8
Сера
Se
+ 16
Селен
2 s 2 2р 4
+ 34
Телур
Te
Po
4 s 2 4 p 4
Поло
ний
+52
3 s 2 3 p 4
+84
5 s 2 5 p 4
6 s 2 6 p 4

Характеристика элемента – кислород
- 1. Положение элемента кислорода в ПСХЭ Д.И.Менделеева :
- № 8, 2 период, VI (А); Ar(O)=16 ;
- 2. Строение атома кислорода.
- заряд ядра +8: Строение атома : P + = 8; n 0 = 8; ē = 8
- Распределение электронов 2е; 6е;
- 3. Свойства атома кислорода.
- Типичный окислитель. Принимает 2е:
- О 0 + 2е → О -2
- Характерная степень окисления - 2.
- (редко +2; +1; -1). валентность II


Распространение кислорода в природе
- Кислород – самый распространенный элемент на нашей планете
- На долю кислорода приходится приблизительно половина всей массы земной коры.
- В почвах, грунтовых, речных и морских водах кислород выступает настоящим геохимическим диктатором.

Периодическая система химических элементов Д.И.Менделеева
ряды
периоды
Группы элементов
VII
VIII
VI
V
IV
III
II
I
1
1
0
32
Характеристика
2
2
3
3
(16р + + 16 n 0 ) 16e -
4
4
r (атома) – 0,104 нм
5
Pd
6
5
ЭО – 2,5
7
Неметалл
+16
6
8
Подробнее…
9
10
7
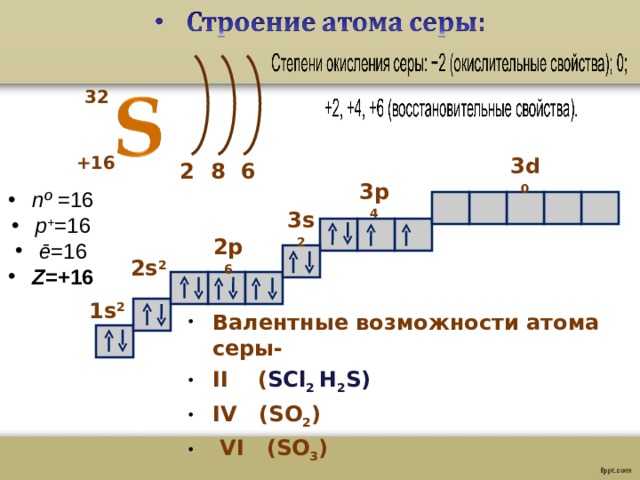
32
+16
8
6
2
3d 0
- nº = 16
- p + = 16
- ē = 16
- Z =+ 16
3p 4
3s 2
2p 6
2s 2
1s 2
- Валентные возможности атома серы-
- II ( SCl 2 H 2 S )
- IV ( SO 2 )
- VI (SO 3 )

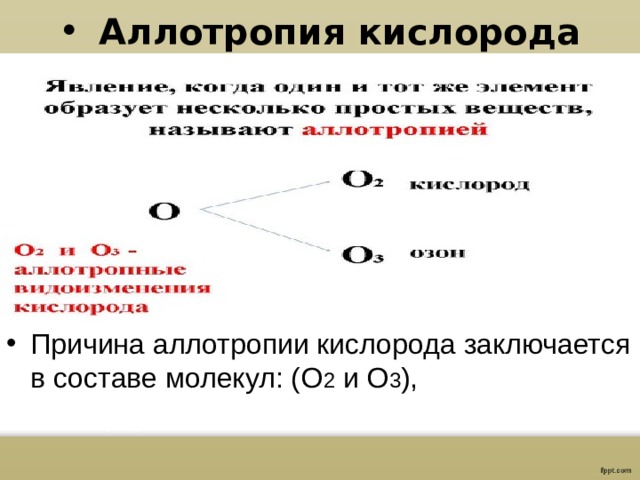
- Причина аллотропии кислорода заключается в составе молекул: (O 2 и O 3 ),


- Ромбическая
- ( α -сера) – S 8 ,
- желтого цвета,
- t° пл.=113 °C ;
- Наиболее
- устойчивая модификация

- Пластическая сера
- коричневая резиноподобная (аморфная) масса.
- Она неустойчива и через некоторое время становится хрупкой.
- приобретёт желтый цвет, т.е превращается в ромбическую серу
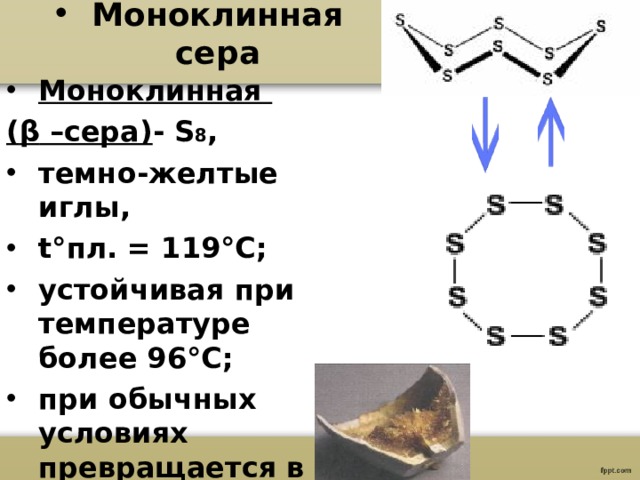
( β –сера) - S 8 ,
- темно-желтые иглы,
- t° пл. = 119 °C ;
- устойчивая при температуре более 96 ° С;
- при обычных условиях превращается в ромбическую

главная
- Существует несколько аллотропных модификаций серы.
пластическая
моноклинная
- Причина аллотропии в разном строении кристаллов.
- Наиболее устойчивой модификацией является
ромбическая сера.


Нахождение серы в природе
- По распространённости в земной коре сера занимает
пятнадцатое место.
- Встречается в свободном (самородном) состоянии и в связанном виде.

Сульфиды: пирит FeS 2 .
серный колчедан FeS 2 , медный колчедан CuFeS 2 , свинцовый блеск PbS с цинковой обманкой ZnS,

- Гипс- Са SO 4 *2H 2 O
- Мирабилит – Na 2 SO 4 *10H 2 O
- Горькая соль- MgSO 4 *7H 2 O
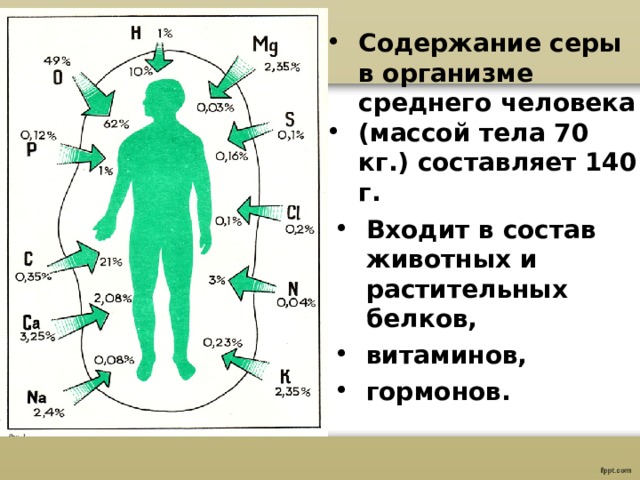
- Содержание серы в организме среднего человека
- (массой тела 70 кг.) составляет 140 г.
- Входит в состав животных и растительных белков,
- витаминов,
- гормонов.

- Особенно много серы в белках волос, рогов, шерсти.
- Кроме этого сера является составной частью биологически активных веществ:
- витаминов и гормонов.
- При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос.

Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца

Домашнее задание
- § 17,
- упр. 1—4,
- тестовые задания.














![Элементы VI А-группы (халькогены) Общая электронная формула: […] ns 2 np 4 Степени окисления: O: –II, –I, 0, +I, +II H 2 O; H 2 O 2 ; O 2 ; O 2 F 2 ; OF 2 S, Se, Te : – II, 0, (+II), +IV, +VI H 2 Э ; Э х ; ЭО 2 ; ЭО 3](https://fsd.multiurok.ru/html/2019/12/01/s_5de3e08ca9fb8/img7.jpg)































