
МКОУ Скляевская СОШ
Рамонского района, Воронежской области
Основные виды химической связи
Учитель химии: Бурлака Д. В.

Цели урока:
Учащиеся должны знать :
- определение понятия химическая связь,
- виды химической связи,
- механизмы образования каждого вида связи.
Учащиеся должны уметь:
- определять вид связи по формуле вещества,
- записывать схему образования каждого вида связи .

Na
Na
Cl
H
H
H
Cl
Na
3,0
0,9
0,9
3,0
0,9
(2,1)
(2,1)
(2,1)
Различают три случая образования химической связи:
1. а) Между атомами элементов, электроотрицательность которых одинакова .
В частности, такое взаимодействие наблюдается при образовании простых веществ — неметаллов
(Н 2 , F 2 , Cl 2 , O 2 , N 2 ), молекулы которых состоят из двух одинаковых атомов;
б) между атомами в металле, электроотрицательность которых также одинакова.
2. Между атомами элементов, электроотрицательность которых отличается , но не очень сильно .
Этот случай встречается особенно часто, например при образовании молекул воды Н 2 О, хлороводорода НСl,
метана СН 4 и многих других веществ.
3. Между атомами элементов, электроотрицательность которых резко отличается , например между
атомами щелочных металлов и атомами галогенов.

Ковалентная связь
Химическую связь, возникающую в результате образования общих (связывающих) электронных пар, называют ковалентной связью.
Ковалентную химическую связь, которая образуется между атомами с одинаковой электроотрицательностью, называют ковалентной неполярной связью .
Пример:
Н 2
N 2
O 2
F 2
0
0
0
0
0
0
0
0
+
+
+
+
O
O
N
O
N
Н
N
Н
O
N
Н
F
F
F
F
Н

Ковалентная связь
Химическая связь, возникающая в результате образования общих электронных пар, называется ковалентной.
Химическую связь, образованную атомами, электроотрицательности которых отличаются, но незначительно, называют ковалентной полярной связью .
Электроотрицательность (ЭО) – это способность атомов химического элемента притягивать к себе электроны.
N
Н
NН 3
Н
Н
Пример:
Н
О
Н
Н 2 О
Cl
Н
НCl
+δ
- δ
+ δ
Элемент с большей ЭО, при образовании ковалентной полярной связи, приобретает частично отрицательный заряд (- δ).
- δ
+ δ
+ δ
+
- δ
Н
О
+
Н
N
Н
+
Н
Cl
+ δ
Элемент с меньшей ЭО, при образовании ковалентной полярной связи, приобретает частично положительный заряд (+ δ).
Н
+ δ
Н

Ионная связь
Химическую связь, образующуюся между ионами, называется ионной .
Ионы — это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Ионная связь как правило возникает между металлом и неметаллом.
NaCl – хлорид натрия (поваренная, пищевая соль)
Пример:
+
23
0
23
Механизм:
35
35
-1
+1
0
Na
Cl
Cl
Na
NaCl
+ 11
+ 11
+ 17
+ 17
2
1
8
2
8
8
7
8
2
8
2
-1
+1
ион хлора
ион натрия
Na
+
Cl
Na
Cl
1e
0
0
+1
-1
+
Na
Cl
Na
Cl
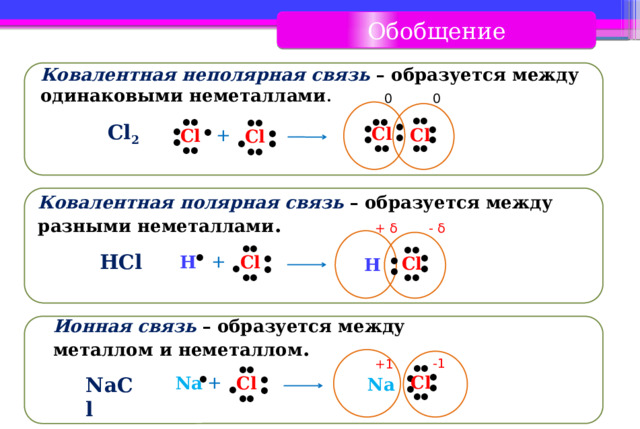
Обобщение
Ковалентная неполярная связь – образуется между одинаковыми неметаллами .
0
0
●●
●●
●●
●●
Cl 2
●
●
●
Cl
●
●
●
Cl
+
Cl
Cl
●
●
●
●
●
●
●●
●●
●●
●●
Ковалентная полярная связь – образуется между разными неметаллами .
- δ
+ δ
●●
●●
HCl
+
H
●
Cl
●
●
●
Cl
●
●
H
●
●
●●
●●
Ионная связь – образуется между металлом и неметаллом .
-1
+1
●●
●●
●
●
Cl
+
NaCl
Na
Cl
●
●
●
Na
●
●
●
●●
●●
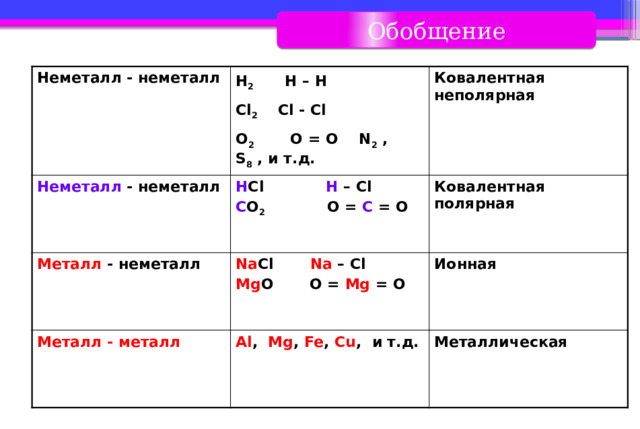
Обобщение
Неметалл - неметалл
H 2 H – H
Неметалл - неметалл
Металл - неметалл
Cl 2 Cl - Cl
Ковалентная неполярная
H Cl H – Cl
Металл - металл
Na Cl Na – Cl
C O 2 O = C = O
Ковалентная полярная
O 2 O = O N 2 , S 8 , и т.д.
Mg O O = Mg = O
Ионная
Al , Mg , Fe , Cu , и т.д.
Металлическая
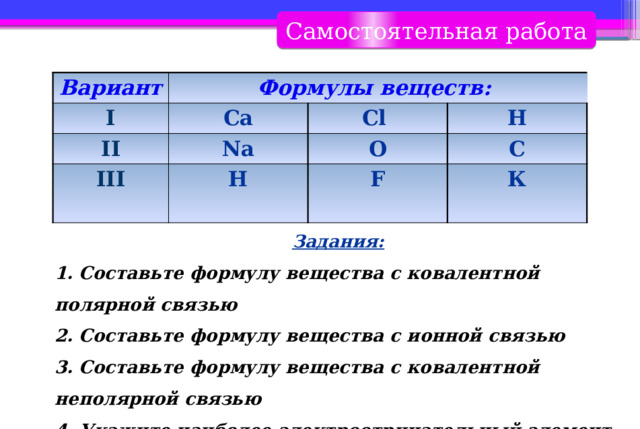
Самостоятельная работа
Вариант
Формулы веществ:
I
II
Ca
Na
III
Cl
Н
O
H
C
F
К
Задания:
1. Составьте формулу вещества с ковалентной полярной связью
2. Составьте формулу вещества с ионной связью
3. Составьте формулу вещества с ковалентной неполярной связью
4. Укажите наиболее электроотрицательный элемент
5. Укажите наименее электроотрицательный элемент
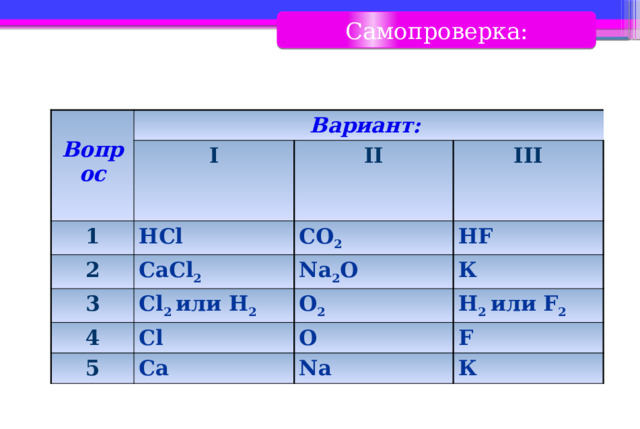
Самопроверка:
Вопрос
Вариант:
I
1
II
НCl
2
III
CaCl 2
3
СО 2
4
Cl 2 или Н 2
Na 2 O
НF
К
Cl
O 2
5
Н 2 или F 2
O
Ca
F
Na
К

Тестирование:
I вариант
II вариант
1. Наименее электроотрицательный элемент:
III вариант
А. кремний
А.литий
2. Наиболее электроотрицательный элемент:
Б. сера
В. фосфор
А. магний
А. магний
Б.углерод
3. Ковалентная неполярная связь:
Б. алюминий
А.кислород
Б. азот
В.хлор
В. барий
В. калий
Б.натрий
А. фтор
А. PCl 5
В.медь
Б. кальций
Б. CH 4
А. CO 2
4. Ковалентная полярная связь:
А. MgCI 2
В. H 2
Б. O 2
В. сера
А.KCI
В. SCI 2
Б. PH 3
Б. H 2 S
А. NaCI
5. Ионная связь:
В. CI 2
А. NaCl
В. F 2
Б. S 2
А. SiH 4
А. PH 3
Б. K
Б. LiCI
В. CO 2
В. N 2
В. HF
Б. Mg
А. KCI
В. LiCI
Б. Na
В. CO 2

Повторение основных понятий
1. Химическая связь – это…
2. Какова причина возникновения химических связей?
3. Валентные электроны расположены на ……
4. Что показывает номер группы?
5. Сколько валентных электронов в атомах Са ,Al, S?
6. Что такое электроотрицательность?
7. Как изменяется электроотрицательность в периодах и главных подгруппах?
8. Какие виды химических связей вам известны?
9. Приведите примеры веществ, имеющих кристаллическую решетку: а) ионную; б) молекулярную; в) атомную.

Домашнее задание :
повторить § 40-41, стр. 145 упр. 2-7




































