
- Вы со мною уже встречались - Я космический скиталец, Элементов прародитель И отважный предводитель. Я любитель кислорода, Вместе с ним даю я воду.
водород

Водород, его общая характеристика, нахождение в природе, получение.
Составитель :учитель биологии , химии МБОУ «СШ №27» а.Новая Адыгея
Садырина О.Н.
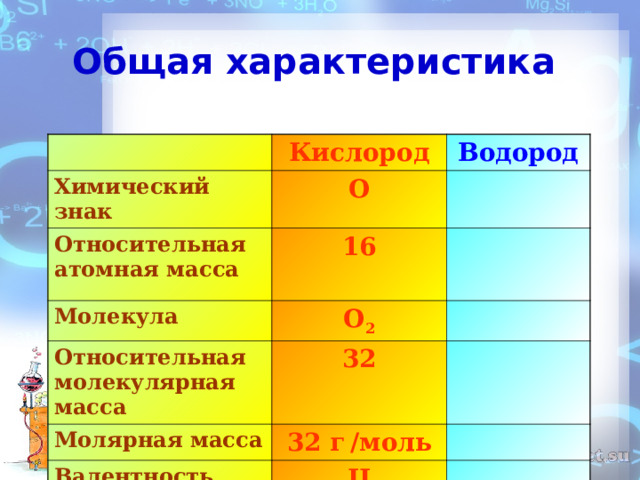
Общая характеристика
Кислород
Химический знак
Водород
О
Относительная атомная масса
16
Молекула
О 2
Относительная молекулярная масса
32
Молярная масса
32 г / моль
Валентность
II
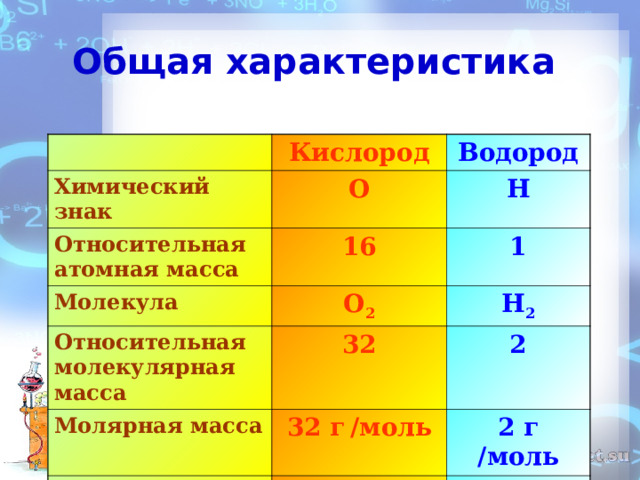
Общая характеристика
Кислород
Химический знак
Водород
О
Относительная атомная масса
16
Н
Молекула
Относительная молекулярная масса
О 2
1
32
Н 2
Молярная масса
2
32 г / моль
Валентность
II
2 г / моль
I

H
1
1 , 0 0 7 9
1 S
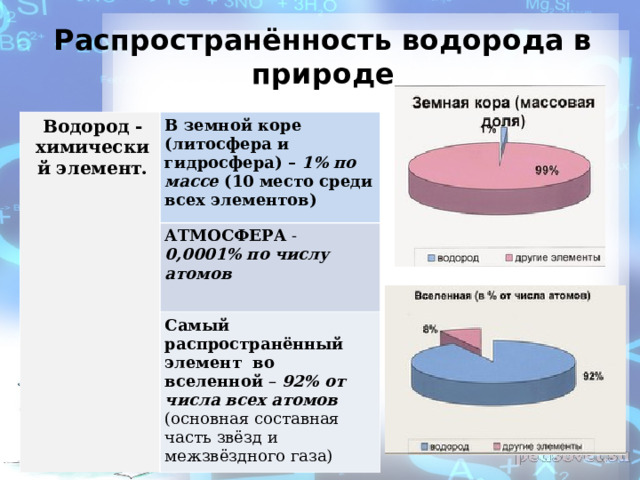
Распространённость водорода в природе
Водород - химический элемент.
В земной коре (литосфера и гидросфера) – 1% по массе (10 место среди всех элементов)
АТМОСФЕРА - 0,0001% по числу атомов
Самый распространённый элемент во вселенной – 92% от числа всех атомов (основная составная часть звёзд и межзвёздного газа)

Распространённость водорода в природе
Водород – химический
элемент
В соединениях
Н 2 О – вода (11% по массе)
СН 4 – газ метан (25% по массе)
Органические вещества (нефть, горючие природные газы и других)
В организмах животных и растений (то есть в составе белков, нуклеиновых кислот, жиров, углеводов и других)
В теле человека в среднем содержится около 7 килограммов водорода.

Земная кора
(массовая доля)
1 %
99 %

В составе атмосферного воздуха присутствие водорода менее 0,0001 %

На долю
водорода
приходится
50 % массы
Солнца и других
звезд




и минералы
Горные породы
Каменный уголь


Какое соединение богаче водородом: H 2 O или CH 4 ?
РЕШЕНИЕ:

Водород – простое вещество (Н 2 ). Получение.
- 1.Лаборатория (аппарат Киппа)
- А) Взаимодействие металлов с кислотами:
- Zn + 2HCl = ZnCl 2 + H 2 ↑
- соль
②
ɪɪ
ɪ

АЛГОРИТМ №1 СОСТАВЛЕНИЯ УХР ПОЛУЧЕНИЯ ВОДОРОДА
- Изучите алгоритм написания уравнения химического взаимодействия металла и кислоты

АЛГОРИТМ №1 СОСТАВЛЕНИЯ УХР ПОЛУЧЕНИЯ ВОДОРОДА
- Некоторые важнейшие кислоты:
Химическая формула кислоты- название
Кислотный остаток (КО)-валентность-название
H 2 SO 4 – серная кислота
SO 4 - ( II ) - сульфат
HCl – соляная кислота
Cl - ( I ) - хлорид
H 3 PO 4 – ортофосфорная кислота
PO 4 - ( III ) - ортофосфат

АЛГОРИТМ №1 СОСТАВЛЕНИЯ УХР ПОЛУЧЕНИЯ ВОДОРОДА

Закончите уравнения химических реакций, используя алгоритм: Подсказка! Zn - двухвалентен; K - одновалентен; Al - трёхвалентен.
- Zn + H 2 SO 4 →
- K + HCl →
- Al + H 3 PO 4 →
- Zn + H 2 SO 4 → Zn SO 4 + H 2
- 2 K + 2 HCl → 2 KCl + H 2
- 2 Al + 2 H 3 PO 4 → 2 Al PO 4 + 3 H 2
②
ΙΙ
ΙΙ
①
Ι
Ι
③
ΙΙΙ
ΙΙΙ

Водород – простое вещество (Н 2 ). Получение.
1.Лаборатории
- Б) Взаимодействие активных металлов с водой:
- 2Na + 2H 2 O = 2NaOH + H 2 ↑
- основание
①
ɪ
ɪ

АЛГОРИТМ №2. СОСТАВЛЕНИЯ УХР ПОЛУЧЕНИЯ ВОДОРОДА
- Изучите алгоритм написания уравнения химического взаимодействия металла и воды
ɪ

- Закончите уравнения химических реакций, используя алгоритм:
- Ca + H 2 O →
- Al + H 2 O →
- K + H 2 O →
- Ca + 2 H 2 O → Ca ( OH ) 2 + Н 2
- 2 Al + 6 H 2 O → 2 Al ( OH ) 3 + 3Н 2
- 2 K + 2 H 2 O → 2 K OH + Н 2
②
ΙΙ
Ι
③
Ι
ΙΙΙ
①
Ι
Ι

Водород – простое вещество (Н 2 ). Получение.
- 2.Промышленность
- · Электролиз воды
- эл. ток
- 2H 2 O → 2H 2 ↑ + O 2 ↑
- · Из природного газа
- t, Ni
- CH 4 + 2H 2 O → 4H 2 ↑+CO 2

Подведем итоги.

Способы получения.
В лаборатории
В промышленности
2H 2 O → 2H 2 ↑ + O 2 ↑
Ca + 2 H 2 O → Ca ( OH )2 + Н2
Zn + H 2 SO 4 → Zn SO 4 + H 2
CH 4 + 2H 2 O → 4H 2 ↑+CO 2
2 K + 2 HCl → 2 KCl + H 2

Домашнее задание
- Параграф 25, 26
- Упражнение № 2,4,5 на стр.76















































