Просмотр содержимого документа
«Презентация по химии: "Алкены. Строение, номенклатура, свойства, изомерия"»

Тема урока:
«Получение, свойства и применение алкенов»
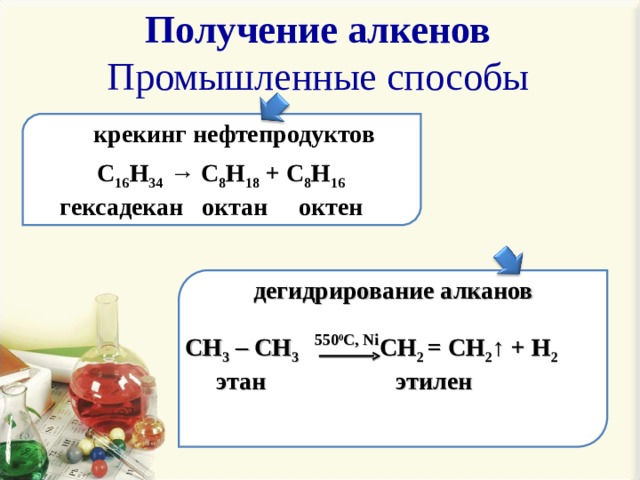
Получение алкенов Промышленные способы
крекинг нефтепродуктов
C 16 H 34 → C 8 H 18 + C 8 H 16
гексадекан октан октен
дегидрирование алканов
CH 3 – CH 3 CH 2 = CH 2 ↑ + H 2
этан этилен
550 0 С, Ni
 140 0 С, H 2 SO 4 (конц) дегалогенирование дигалогеналканов CH 3 – CHBr – CHBr – CH 3 + Zn → CH 3 – CH = CH – CH 3 + ZnBr 2 2,3 – дибром бутан бутен - 2 дегидрогалогенирование галогеналканов CH 3 – CHBr – CH 2 – CH 3 + NaOH CH 3 – CH = CH – CH 3 + NaBr + H 2 O 2 – бромбутан бутен - 2 спирт, t " width="640"
140 0 С, H 2 SO 4 (конц) дегалогенирование дигалогеналканов CH 3 – CHBr – CHBr – CH 3 + Zn → CH 3 – CH = CH – CH 3 + ZnBr 2 2,3 – дибром бутан бутен - 2 дегидрогалогенирование галогеналканов CH 3 – CHBr – CH 2 – CH 3 + NaOH CH 3 – CH = CH – CH 3 + NaBr + H 2 O 2 – бромбутан бутен - 2 спирт, t " width="640"
Получение алкенов Лабораторные способы
дегидратация спиртов
C 2 H 5 OH CH 2 = CH 2 ↑ + H 2 O
t 140 0 С, H 2 SO 4 (конц)
дегалогенирование дигалогеналканов
CH 3 – CHBr – CHBr – CH 3 + Zn → CH 3 – CH = CH – CH 3 + ZnBr 2
2,3 – дибром бутан бутен - 2
дегидрогалогенирование галогеналканов
CH 3 – CHBr – CH 2 – CH 3 + NaOH CH 3 – CH = CH – CH 3 + NaBr + H 2 O
2 – бромбутан бутен - 2
спирт, t
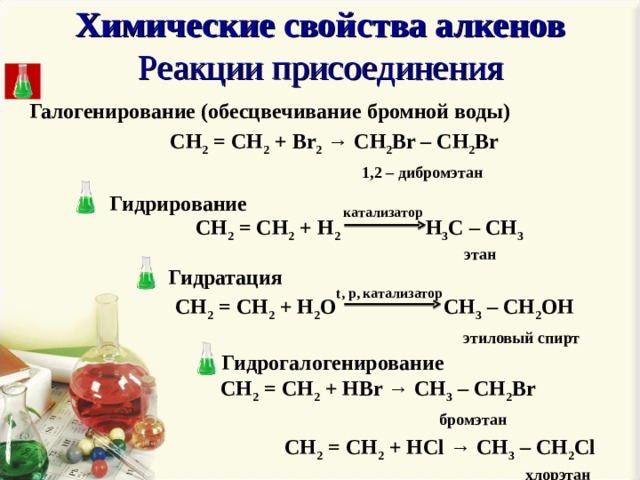
Химические свойства алкенов Реакции присоединения
Галогенирование (обесцвечивание бромной воды)
Гидрирование
Гидратация
Гидрогалогенирование
CH 2 = CH 2 + Br 2 → CH 2 Br – CH 2 Br
1,2 – дибромэтан
катализатор
CH 2 = CH 2 + H 2 H 3 C – CH 3
э тан
t , p , катализатор
CH 2 = CH 2 + H 2 O CH 3 – CH 2 OH
этиловый спирт
CH 2 = CH 2 + HBr → CH 3 – CH 2 Br
бромэтан
CH 2 = CH 2 + HCl → CH 3 – CH 2 Cl
хлорэтан
![Химические свойства алкенов Реакции окисления Горение на воздухе Мягкое окисление (обесцвечивание раствора K M nO 4 ) Частичное окисление этилена кислородом воздуха CH 2 = CH 2 + 3O 2 → 2CO 2 + 2H 2 O CH 2 = CH 2 + [O] + H 2 O → HO – CH 2 – CH 2 – OH э тиленгликоль 2 CH 2 = CH 2 + O 2 → 2CH 2 – CH 2 O о ксид этилена](https://fsd.multiurok.ru/html/2020/04/03/s_5e86b88b5c2a9/img4.jpg)
Химические свойства алкенов Реакции окисления
Горение на воздухе
Мягкое окисление (обесцвечивание раствора K M nO 4 )
Частичное окисление этилена кислородом воздуха
CH 2 = CH 2 + 3O 2 → 2CO 2 + 2H 2 O
CH 2 = CH 2 + [O] + H 2 O → HO – CH 2 – CH 2 – OH
э тиленгликоль
2 CH 2 = CH 2 + O 2 → 2CH 2 – CH 2
O
о ксид этилена

Химические свойства алкенов Реакции полимеризации
t , p , катализатор
n CH 2 = CH 2 ( - CH 2 – CH 2 - ) n
этилен полиэтилен

Физические свойства алкенов
Этилен – бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде, растворим в спирте и диэтиловом эфире
Формула - название
t кип., 0 С
C 2 H 4 – этилен
Агрегатное состояние
-103,8
C 3 H 6 - пропилен
-47,7
газы
C 4 H 8 - бутен
-6,3 (бутен-1)
C 5 H 10 - пентен
+30,1 (пентен-1)
C 6 H 12 - гексен
жидкие
+63,5
C 7 H 14 - гептен
+93,6
C 18 H 36 - октадецен
C 19 H 38 - нонадецен
твердые
При увеличении молекулярной массы соединений закономерно повышаются температуры кипения и плавления

Применение алкенов
Этилен: исходное вещество для производства этанола, этиленгликоля, эпоксидов, дихлорэтана, полиэтилена (упаковочная пленка, посуда, трубы, электроизоляционные материалы).
Пропилен: глицерин, ацетон, изопропанол, растворители, полипропилен.
н.









 140 0 С, H 2 SO 4 (конц) дегалогенирование дигалогеналканов CH 3 – CHBr – CHBr – CH 3 + Zn → CH 3 – CH = CH – CH 3 + ZnBr 2 2,3 – дибром бутан бутен - 2 дегидрогалогенирование галогеналканов CH 3 – CHBr – CH 2 – CH 3 + NaOH CH 3 – CH = CH – CH 3 + NaBr + H 2 O 2 – бромбутан бутен - 2 спирт, t " width="640"
140 0 С, H 2 SO 4 (конц) дегалогенирование дигалогеналканов CH 3 – CHBr – CHBr – CH 3 + Zn → CH 3 – CH = CH – CH 3 + ZnBr 2 2,3 – дибром бутан бутен - 2 дегидрогалогенирование галогеналканов CH 3 – CHBr – CH 2 – CH 3 + NaOH CH 3 – CH = CH – CH 3 + NaBr + H 2 O 2 – бромбутан бутен - 2 спирт, t " width="640"

![Химические свойства алкенов Реакции окисления Горение на воздухе Мягкое окисление (обесцвечивание раствора K M nO 4 ) Частичное окисление этилена кислородом воздуха CH 2 = CH 2 + 3O 2 → 2CO 2 + 2H 2 O CH 2 = CH 2 + [O] + H 2 O → HO – CH 2 – CH 2 – OH э тиленгликоль 2 CH 2 = CH 2 + O 2 → 2CH 2 – CH 2 O о ксид этилена](https://fsd.multiurok.ru/html/2020/04/03/s_5e86b88b5c2a9/img4.jpg)













