
ГАПОУ СО «Калининский техникум агробизнеса»
Тема урока:
«Элементы I А-группы»
Подготовила: преподаватель химии
высшей квалификационной категории
Данилова Таисия Викторовна

ЦЕЛЬ УРОКА:

РАЗМИНКА
Al
Самый распространенный металл в земной коре -
Cr
Самый твердый металл -
Самый тяжелый металл -
Os
Основной компонент чугуна и стали -
Fe
Hg
При обычных условиях этот металл жидкий -
Самый тугоплавкий металл -
W

СТРОЕНИЕ АТОМА
Li
Na
K
Rb
Cs
Fr
+3
1
+11
- Растет число энергетических уровней
1
+19
1
- Увеличивается радиус атома
+37
- Увеличиваются металлические и восстановительные свойства
1
+55
1
+87
1

СТЕПЕНЬ ОКИСЛЕНИЯ
- 1 е
Li 0
Na 0
K 0
Rb 0
Cs 0
Fr 0
Li +1
+3
1
- 1 е
Na +1
+11
1
- 1 е
K +1
+19
1
- 1 е
Rb +1
+37
1
- 1 е
Cs +1
+55
1
- 1 е
Fr +1
+87
1

ЗАПОМНИ!
Степень окисления металлов I группы главной подгруппы в соединениях постоянная и равна +1
NaOH, K 2 O, Li 3 PO 4 ,
K 2 CO 3 , NaCl, Na 2 O 2
+1
+1
+1
+1
+1
+1

ПРОСТЫЕ ВЕЩЕСТВА
Литий
t пл,С
180,6
Натрий
t кип,С
Калий
97,8
г/см 3
1342
Рубидий
63,07
0,534
883
39,5
Цезий
0,986
759
28,4
Франций
0,856
688
20
1,532
671
1,90
690
1,87
температуры плавления и кипения понижаются
плотность металлов увеличивается
- Серебристо-белые, с характерным металлическим блеском, но быстро тускнеют (окисляются) на воздухе;
- Мягкие, легко режутся ножом;
- Хорошо проводят тепло и электрический ток;
- Легкие ( Li, Na, K – легче воды);
- Легкоплавкие

ХИМИЧЕСКИЕ СВОЙСТВА
- Металлы I группы главной подгруппы –
наиболее активные металлы ,
обладают высокой восстановительной способностью
- В ряду Li - Na - K - Rb - Cs- Fr
химическая активность увеличивается
- Образуют соединения с ионной связью и ионной кристаллической решеткой
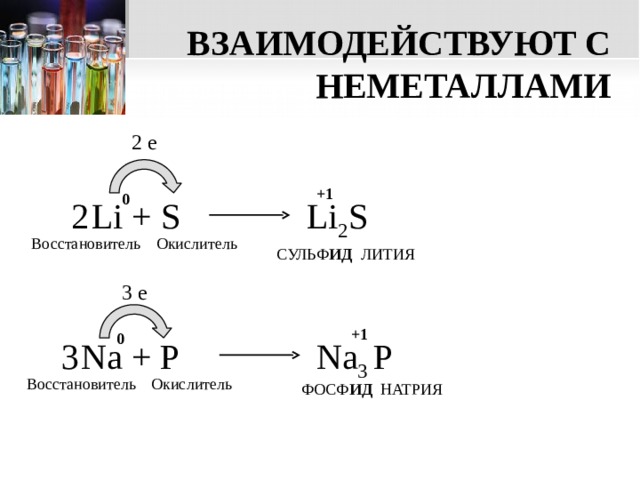
ВЗАИМОДЕЙСТВУЮТ С НЕМЕТАЛЛАМИ
2 e
+1
0
Li + S
2
Li 2 S
Восстановитель
Окислитель
СУЛЬФ ИД ЛИТИЯ
3 e
+1
0
Na + P
Na 3 P
3
Окислитель
Восстановитель
ФОСФ ИД НАТРИЯ
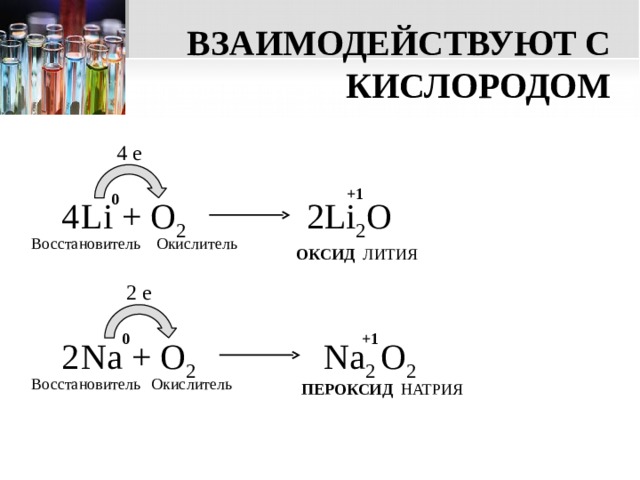
ВЗАИМОДЕЙСТВУЮТ С КИСЛОРОДОМ
4 e
+1
0
Li + О 2
4
2Li 2 O
Восстановитель
Окислитель
ОКСИД ЛИТИЯ
2 e
0
+1
Na + O 2
Na 2 O 2
2
Окислитель
Восстановитель
ПЕРОКСИД НАТРИЯ

ВНИМАНИЕ!
При взаимодействии с кислородом
только литий образует оксид .
Другие металлы I группы главной подгруппы при взаимодействии с кислородом образуют пероксиды и надпероксиды .
ПЕРОКСИД НАТРИЯ
Na O O Na
+1
+1
- 1
- 1

A ЗНАЕТЕ ЛИ ВЫ?
При взаимодействии пероксида натрия с углекислым газом протекает процесс, обратный дыханию - углекислый газ связывается, а кислород выделяется:
2Na 2 О 2 + 2 СО 2 → 2Na 2 CО 3 + О 2
На этой реакции основано применение пероксида натрия для получения кислорода на подводных лодках и для регенерации воздуха в закрытых помещениях.

ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ
Металлы I группы главной подгруппы реагируют с водой бурно, с выделением теплоты. В результате взаимодействия образуется щелочь и выделяется водород
Так как гидроксиды металлов I группы главной подгруппы образуют щелочи, то их групповое название – ЩЕЛОЧНЫЕ МЕТАЛЛЫ

ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ
2 e
+1
0
2Li + 2H 2 О 2LiOH + H 2
Окислитель
Восстановитель
ГИДРОКСИД ЛИТИЯ
2 e
0
+1
2
Na + H 2 О
2 NaOH + H 2
2
ГИДРОКСИД НАТРИЯ
Восстановитель
Окислитель

ХРАНЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Так как щелочные металлы легко окисляются и обладают высокой химической активностью, их хранят под слоем керосина
Беречь от воды
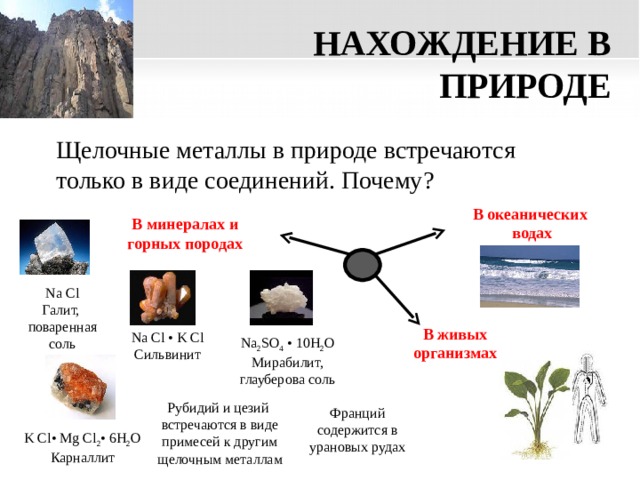
НАХОЖДЕНИЕ В ПРИРОДЕ
Щелочные металлы в природе встречаются только в виде соединений. Почему?
В океанических
водах
В минералах и горных породах
Na Cl
Галит, поваренная соль
В живых организмах
Na Cl • K Cl
Сильвинит
Na 2 SO 4 • 10H 2 O
Мирабилит, глауберова соль
Рубидий и цезий встречаются в виде примесей к другим щелочным металлам
Франций содержится в урановых рудах
K Cl • Mg Cl 2 • 6H 2 O
Карналлит
17
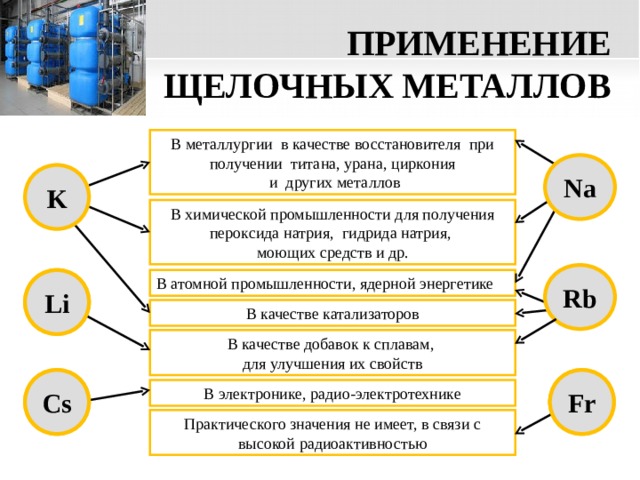
ПРИМЕНЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ
В металлургии в качестве восстановителя при получении титана, урана, циркония
и других металлов
Na
K
В химической промышленности для получения пероксида натрия, гидрида натрия,
моющих средств и др.
Rb
В атомной промышленности, ядерной энергетике
Li
В качестве катализаторов
В качестве добавок к сплавам,
для улучшения их свойств
Cs
Fr
В электронике, радио-электротехнике
Практического значения не имеет, в связи с высокой радиоактивностью
18

ИЗ ИСТОРИИ
18

ВЫБЕРИ ПРАВИЛЬНЫЙ ОТВЕТ
1. Щелочной металл
a ) Mg
a ) Ba
a ) Al
a ) Rb
2. Наиболее ярко выражены металлические свойства
a ) Fr
a ) K
a ) Li
a ) Cs
3. При взаимодействии с кислородом образует пероксид
a ) Ca
a ) Na
a ) Li
a ) Mg
4. Степень окисления щелочных металлов
a ) +2
a ) +1
a ) +3
a ) +4

НАЙДИ СООТВЕТСТВИЕ
1. Li
А ) В атоме 6 энергетических уровней
2 . Na
Б ) Заряд ядра + 37
3 . K
В ) Самый легкий металл
4 . Rb
Г ) Общее число электронов в атоме 19
Д ) Входит в состав поваренной соли
5 . Cs
1
В
2
3
Д
4
Г
5
Б
А

ВЫБЕРИТЕ СВОЙСТВА ХАРАКТЕРНЫЕ ДЛЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ
А ) не взаимодейсвуют с кислородом
Б ) в соединениях проявляют переменную степень окисления
В ) быстро окисляются
Г ) имеют металлическую кристаллическую решетку
Д ) при взаимодействии с водой образуют щелочи
Е ) хорошие окислители
В
Г
Д

ДОМАШНЕЕ ЗАДАНИЕ
Сделать презентацию об открытии щелочных металлов и/или применении


















































