

- Проверка знаний учащихся.
1. Как называют соли азотной кислоты?
2. Какова среда раствора аммиака в воде – кислая, щелочная или нейтральная?
3. Какие соединения называют селитрами?
4. Как «по – химически» называется нашатырный спирт?
5. В каком из перечисленных соединений азота степень окисления равна +3:
- 1. NH3 2. HNO3 3. HNO2 4. NO2
6. Взаимодействие медной стружки с концентрированной азотной кислотой приводит к образованию газа:
- 1. NO2 2. N2O 3. NO 4. NH3
7. С какими веществами аммиак вступает в реакции соединения:
- 1. кислоты 2. кислород
- 3. щелочи 4. соли

Закончить уравнения реакций:
б) NH 4 Cl + AgNO 3 =
в) N 2 + H 2 =
г) NH 4 Cl + KOH =

Прав ли был Артур Конан-Дойл?

Открытие фосфора
Гамбургский алхимик
Хеннинг Бранд
1669 год
«Фосфор» -
от греческого «светоносный»

Фосфор как химический элемент
период
группа
валентных электронов
степени окисления
высший оксид
водородное соединение

Сравните физические свойства
АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
Р
БЕЛЫЙ
КРАСНЫЙ
ЧЕРНЫЙ

ХИМИЧЕСКИЕ СВОЙСТВА
Ca + P =
P + O 2 =
P + S =

- с бертолетовой солью при ударе взрывается, воспламеняется :
KClO 3 + P = P 2 O 5 + KCl
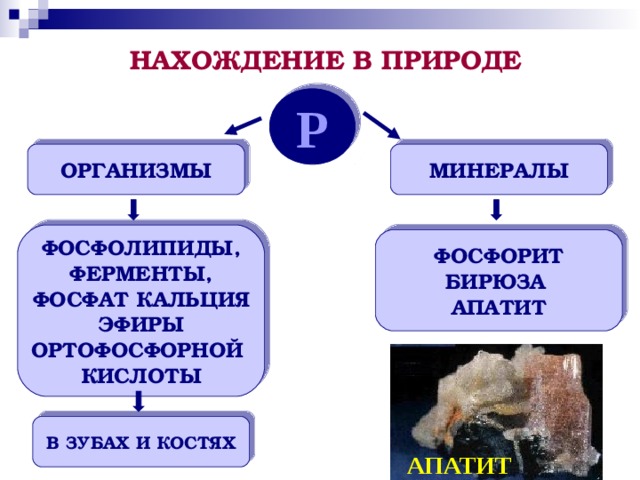
НАХОЖДЕНИЕ В ПРИРОДЕ
Р
ОРГАНИЗМЫ
МИНЕРАЛЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
ФОСФОРИТ
БИРЮЗА
АПАТИТ
В ЗУБАХ И КОСТЯХ
АПАТИТ

Физиологическое действие белого фосфора
Результат применения чрезмерного количества фосфора
Появление лягушек с уродствами -результат применения фосфорных удобрений, которые смываются в реки и пруды ,
Фосфорный некроз – поражение челюстей

Получение фосфора
нагреванием смеси фосфорита, угля и
песка в электропечи:
Ca 3 (PO 4 ) 2 + C + SiO 2 → P 4 + CaSiO 3 + CO
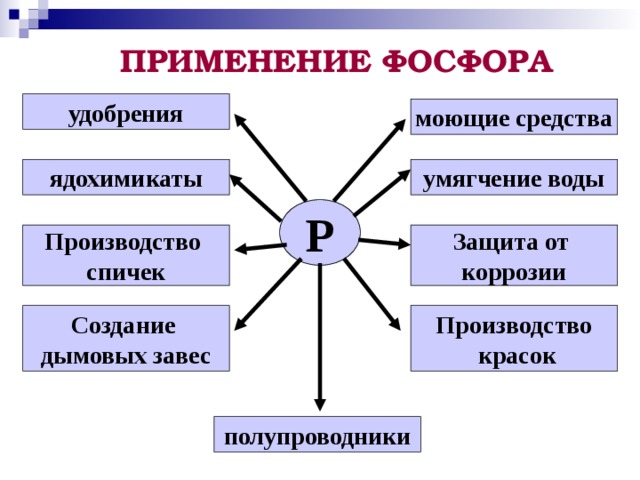
ПРИМЕНЕНИЕ ФОСФОРА
удобрения
моющие средства
умягчение воды
ядохимикаты
Р
Защита от
коррозии
Производство
спичек
Производство
красок
Создание
дымовых завес
полупроводники

ДОМАШНЕЕ ЗАДАНИЕ
§ .
ПОВТОРИМ?

Войска США
использовали фосфорные
Бомбы
в Ираке,
2004 г.

БЕЛЫЙ ФОСФОР
Молекулы P 4 имеют форму тетраэдра. Это легкоплавкое t (пл)=44,1 о С, t (кип)=275 о С, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в сероуглероде и ряде других органических растворителей. Ядовит, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды.
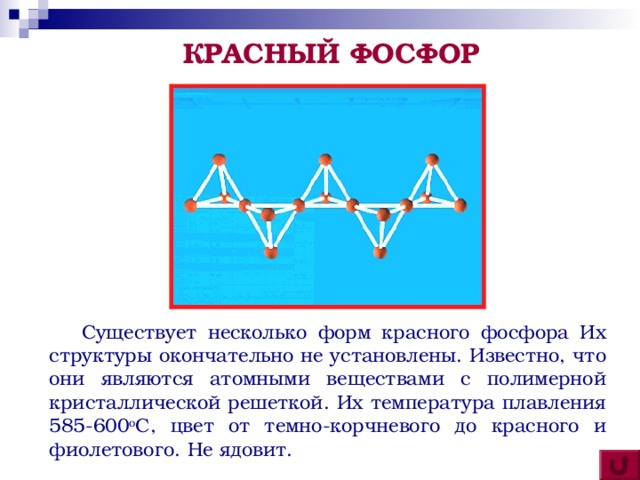
КРАСНЫЙ ФОСФОР
Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами с полимерной кристаллической решеткой. Их температура плавления 585-600 о С, цвет от темно-корчневого до красного и фиолетового. Не ядовит.
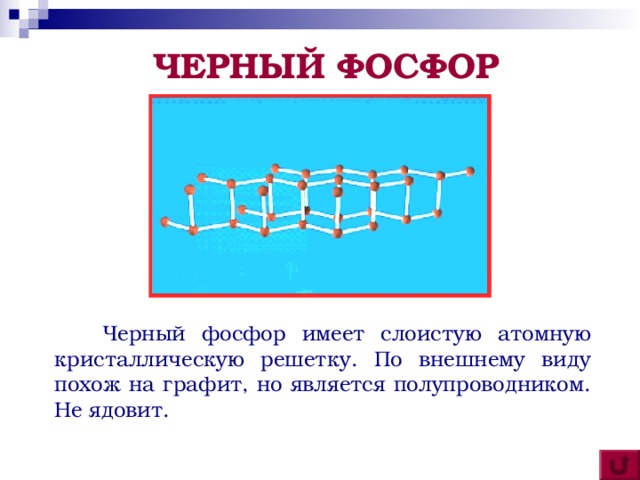
ЧЕРНЫЙ ФОСФОР
Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником. Не ядовит.

Фосфор как химический элемент
период
III
V А
группа
валентных электронов
5
степени окисления
-3, +3, +5
высший оксид
Р 2 О 5
водородное соединение
РН 3

ПОВТОРИМ
1.ЗАКОНЧИТЕ УРАВНЕНИЯ : Р + F 2 = Al + P = Укажите окислитель и восстановитель
2 . Задача:
Какова масса фосфора в вашем теле, если известно, что фосфор составляет ≈1% от массы тела?
3 .Осуществите превращения:
Р РН 3 Р 2 О 5 Н 3 РО 4














































