
Коррозия металлов
ХИМИЯ – 11
Автор: Кунова Г.В. – учитель химии ГОАОУ ЦОРиО, г. Липецк

Общее понятие
Металлы и сплавы подвержены коррозии под воздействием окружающей среды. Причина этого разрушения лежит в химических свойствах металлов – в их способности вступать в окислительно-восстановительные реакции с веществами окружающей среды и окисляться.
- Коррозия (от латинского «corrodere» разъедать) – самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Общеизвестным примером коррозии является ржавление железа.
- Существуют разные виды коррозии металлов и их сплавов. Наиболее распространены два вида: химическая и электрохимическая.

Химическая коррозия
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металл – происходит химическая коррозия.
- Химическая коррозия – это коррозия, обусловленная взаимодействием металлов и сплавов с веществами, содержащимися в окружающей среде, при этом происходит окислительно-восстановительное разрушение металла без возникновения электрического тока в системе.
К химической коррозии относятся:
- газовая коррозия ;
- коррозия в жидкостях-неэлектролитах.

Газовая коррозия
- Газовая коррозия – это вид коррозии, обусловленный непосредственным взаимодействием металла или сплава с сухими газами, жидкостями, не являющимися электролитами, твёрдыми веществами.
- Суть её заключена в окислении металла в процессе непосредственного химического взаимодействия с веществами окружающей среды (газовая, жидкостная коррозия).
- Примером газовой коррозии может служить окисление железа в атмосфере хлора:
2Fe + 3Cl 2 = 2FeCl 3
- Окисление кислородом воздуха:
2Fe + O 2 = 2FeO
4Fe + 3O 2 = 2Fe 2 O 3
3Fe + 3O 2 = FeO·Fe 2 O 3 (смешанный оксид железа (II, III) )
4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3 (на воздухе в присутствии влаги)
3Fe + 4H 2 O(пар) = Fe 3 O 4 + 4H 2
- Химически чистое железо почти не корродирует. Вместе с тем техническое железо, которое содержит различные примеси, например в чугунах и сталях, ржавеет, так как одной из причин возникновения коррозии является наличие примесей в металле, его неоднородность.

Химическая коррозия в жидкостях-неэлектролитах
- Жидкости-неэлектролиты - это жидкие среды, которые не являются проводниками электричества.
К ним относятся:
- органические (бензол, фенол, хлороформ, спирты, керосин, нефть, бензин);
- неорганического происхождения (жидкий бром, расплавленная сера и т.д.).
Чистые неэлектролиты не реагируют с металлами, но с добавлением даже незначительного количества примесей процесс взаимодействия резко ускоряется.
Для защиты конструкций от химической коррозии в жидкостях-неэлектролитах на ее поверхность наносят покрытия, устойчивые в данной среде.

Электрохимическая коррозия
- Это наиболее распространённый вид коррозии, приносящий наибольший вред металлам и изделиям из них.
- В этом случае образуется гальванический элемент, электродами которого и являются металлы, находящиеся в растворе электролита (вода, в которой растворён углекислый газ, кислоты и др.). Возникает электрохимический процесс, т.е. наряду с химическими процессами связанными с отдачей электронов и окислением металла, протекают и электрические (перенос электрона от одного участка металла к другому).
- Электрохимическая коррозия – это вид коррозии, связанный с протеканием электрохимических реакций на поверхности металла или его сплава при их контакте с раствором электролита.
Fe → Fe 2+

Электрохимическая коррозия
АНОД (более активный металл) – разрушается в процессе окисления.
КАТОД (менее активный металл или примесь неметалла, способного + ē) – восстанавливается.
Ме 0 – nē → Me n+ (процесс окисления)
кислая среда : 2H + + 2ē → H 2 (процесс восстановления)
влажный воздух : O 2 + 2H 2 O + 4ē → 4OH - (процесс восстановления)
Электрохимическая коррозия железной детали с примесями меди во влажном воздухе.
А: Fe 0 - 2ē → Fe 2+ (Окисление)
К: O 2 + 2H 2 O + 4ē → 4OH - (процесс восстановления)
Итог: 2Fe + O 2 + 2H 2 O = 2Fe(OH) 2 (белая ржавчина)
4Fe(OH) 2 + 2H 2 O + O 2 = 4Fe(OH) 3 (бурая ржавчина)

Электрохимическая коррозия
- При возникновении гальванической пары сила возникающего электрического тока тем больше, чем дальше стоят друг от друга металлы в ряду напряжений. При этом поток электронов от более активного металла идёт к металлу менее активному. Более активный металл при этом разрушается.
- Примеры электрохимической коррозии:
В паре Fe — Zn разрушается цинк
В паре Fe — Sn
разрушается железо
- Электрохимическая коррозия усиливается в присутствии сильных электролитов, при наличии в металле примесей, в том числе другого металла.
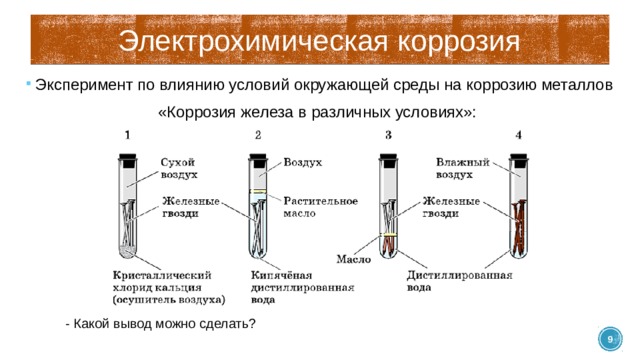
Электрохимическая коррозия
- Эксперимент по влиянию условий окружающей среды на коррозию металлов
«Коррозия железа в различных условиях»:
- Какой вывод можно сделать?

Способы защиты от коррозии
1. Поверхностные защитные покрытия металлов:
- анодное – покрытие более активным металлом Zn, Cr;
- катодное – покрытие менее активным металлом Ni, Sn, Ag, Au.
Белая жесть (лужёное железо) – не защищает от разрушения в случае нарушения покрытия.
- Неметаллические покрытия:
- органические (лаки, краски, пластмассы, резина - гумирование, битум);
- неорганические (эмали).

Способы защиты от коррозии
2. Создание сплавов, стойких к коррозии.
- Достигается введением в состав стали хрома, марганца, никеля (нержавеющая сталь).
- Изготавливают антикоррозийные сплавы, содержащие до 12% Cr, а также сплавы с добавками никеля, кобальта, меди и других металлов.
«Нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля.

Способы защиты от коррозии
3. Протекторная защита.
- Сущность протекторной защиты заключается в том, что металлическую конструкцию (подземный трубопровод, корпус судна и т. д.), находящуюся в растворе электролита (подземные и почвенные воды, морская вода и т. д.), соединяют с протектором – более активным металлом, чем металл защищаемой конструкции.
- В процессе коррозии протектор служит анодом и разрушается , предохраняя от разрушения конструкцию.
- В качестве протектора для стальных конструкций обычно используют алюминий, цинк, магний и их сплавы.
Разрушение цинковых накладок на корпусе корабля.
ПРОТЕКТОРЫ
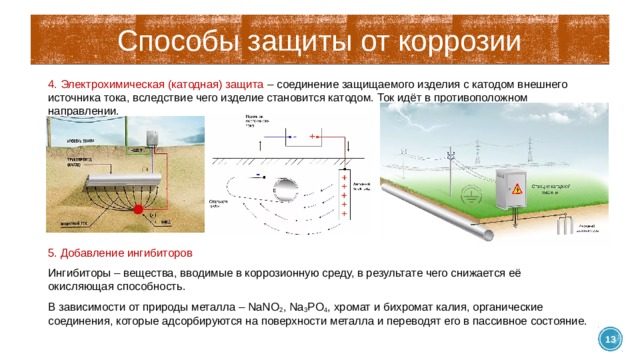
Способы защиты от коррозии
4. Электрохимическая (катодная) защита – соединение защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Ток идёт в противоположном направлении.
5. Добавление ингибиторов
Ингибиторы – вещества, вводимые в коррозионную среду, в результате чего снижается её окисляющая способность.
В зависимости от природы металла – NaNO 2 , Na 3 PO 4 , хромат и бихромат калия, органические соединения, которые адсорбируются на поверхности металла и переводят его в пассивное состояние.

Задания:
1. Какой из компонентов загрязненного городского воздуха является наиболее коррозионно-активным по отношению к металлам, особенно при повышенной влажности:
а) N 2 ;
б) СО;
в) SO 2 .
2. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?

Источники
- Интернет-ресурсы: фото и рисунки.
































