
Молярный объем газов
Учитель химии, биологии и обществознания
Кривобок
Эллада Николаевна

1 вариант
2 вариант
1. Какую массу занимают 5 моль О 2 при н.у.?
1. Какое количество вещества занимает 0,2 моль N 2 при н.у.?
2. Вычислите массу метана СН 4 , количество которого равно 3 ммоль.
2. Вычислите массу кислорода, количество которого 2,5 кмоль
3. В какой массе содержится
12,04 ·10 -23 молекул углекислого газа - СО 2 ?
3. В какой объеме содержится
4. Сколько молекул содержится в 8 г кислорода - О 2 ?
3·10 -23 молекул водорода Н 2 ?
4. Сколько молекул содержится в 64г сернистого газа - SО 2 ?

Молярная масса – масса 1 моль вещества
M(H 2 O) = 18 г/моль
M(H 2 SO 4 ) = 98 г/моль
M(SO 2 ) =64 г/моль
M(KOH) = 56 г/моль
M(Al(NO 3 ) 3 ) = 213 г/моль


Молярный объем - 1 моль вещества
V m
Молярный объем воды H 2 O равен 18 г/моль.
Плотность воды 1 г/мл


1 моль любого газа при нормальных условиях занимает объем равный 22,4 л
н. у. - 0ºC и 760 мм рт. ст. или 1 атм. или 101,3 кПа

Соотношение некоторых физических величин и их единиц измерения
Единица
Единица
измерения
Масса
Масса
измерения
Наиболее часто применяемая при изучении химии
Наиболее часто применяемая при изучении химии
(m)
(m)
г
Количество
В 1000 раз
г
В 1000 раз
Количество
большая
большая
мг
Число
вещества
мг
вещества
Число
моль
В 1000 раз
моль
В 1000 раз
Авогадро
Авогадро
кг
кг
меньшая
(n)
Молярная
(n)
меньшая
ммоль
Молярная
ммоль
6,0210 23
(N A )
Объем
1/моль
масса
(N A )
масса
6,0210 26
Объем
кмоль
г/моль
кмоль
г/моль
(V)
(V)
1/ммоль
Молярный
мг/ммоль
Молярный
6,0210 20
л
мг/ммоль
(m)
л
(m)
объем
мл
объем
мл
1/кмоль
22,4
кг/кмоль
22,4
кг/кмоль
22,4
м 3
л/моль
(V m )
м 3
22,4
л/моль
(V m )
мл/ммоль
мл/ммоль
22,4
22,4
м 3 /кмоль
м 3 /кмоль

Один моль молекул любого вещества в газообразном состоянии при одинаковых температурах и давлениях занимает один и тот же объем
V = V m × n
n =
V m =
Лоренцо Авогадро (1776 – 1856 гг.)
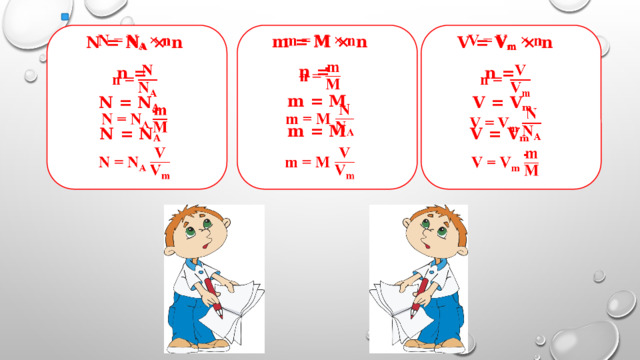
V = V m × n
N = N A × n
m = M × n
n =
n =
n =
V = V m
m = M
N = N A
m = M
V = V m
N = N A

Задача 1. Определите массу 11,2 м 3 аммиака – NH 3 (при н.у.)
Дано
Дано
m(NH 3 ) - ?
Решение
m = M × n
M(NH 3 ) = 14 + 3 = 17(кг/кмоль)
V (NH 3 ) = 11,2м 3
V (NH 3 ) = 11,2м 3
m =
н.у.
н.у.
= 22, 4 м 3 /кмоль
m(NH 3 ) =
Ответ: m(NH 3 ) = 8,5 кг

Задача 2. Определите массу и объем (при н.у.) 36 × 10 20 молекул сероводорода – H 2 S.
Дано
Дано
m(H 2 S) - ?
N(H 2 S) = 36 × 10 20 молекул
N(H 2 S) = 36 × 10 20 молекул
Решение
m = M ; V = V m
V(H 2 S) - ?
н.у.
н.у.
M(H 2 S) = 34 кг/кмоль
m(H 2 S) = 34 = 204(кг)
V m = 22,4 м 3 /кмоль
N A = 6 10 20 1/кмоль
V ( H 2 S) = 22,4 = 134,4(м 3 )
Ответ: m(H 2 S) = 204 кг, V ( H 2 S) 134,4м 3

1 вариант
1. Рассчитайте:
2 вариант
а) плотность (н.у.) оксида углерода (IV) СО 2 (г/л);
1. Рассчитайте:
б) относительную плотность оксида азота (II) NO по водороду.
а) плотность (н.у.) метана СН 4 (г/л);
б) относительную плотность сероводорода H 2 S по кислороду.
2. Рассчитайте, какой объём (н.у.) займут:
3. Сколько молекул содержится в 38кг молекулярного фтора F 2 ?
а) 6 ммоль азота N 2 ;
2. Рассчитайте, какой объём (н.у.) займут:
а) 2 кмоль водорода Н 2 ;
б) 2 г кислорода O 2 .
3. Сколько атомов содержится в 40 г кальция Са ?
4. Рассчитайте массу 0,6·10 23 атомов серы.
б) 4 мг азота N 2 .
4. Рассчитайте массу 12·10 20 молекул кислорода O 2 .

д/з §17 учить, упр. 1а, 2б,5б письменно, §16 повторить, таблицу знать































