
ТЕМА 1. Важнейшие химические понятия и законы
Урок 1. Атом, Химический элемент. Изотопы. Простые и сложные вещества. Основные законы
химии.

Урок 1.
1. Что изучает химия?
Химия – это наука о веществах,
их свойствах и превращениях
веществ.
Урок 1.
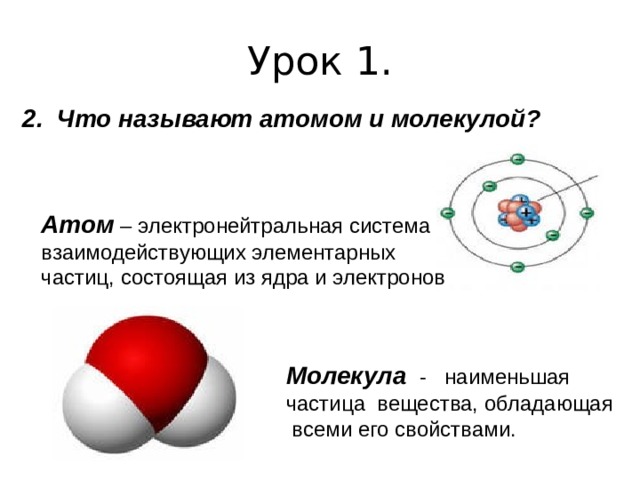
2. Что называют атомом и молекулой?
Атом – электронейтральная система
взаимодействующих элементарных
частиц, состоящая из ядра и электронов
Молекула - наименьшая
частица вещества, обладающая
всеми его свойствами.

Урок 1.
- 3. Что такое абсолютная и относительная атомная и молекулярная массы?

Урок 1
- Относительная атомная масса (см. атомная масса химического элемента) А r
- Относительная молекулярная масса ( сумма относительных атомных масс всех атомов, образующих молекулу вещества) Mr
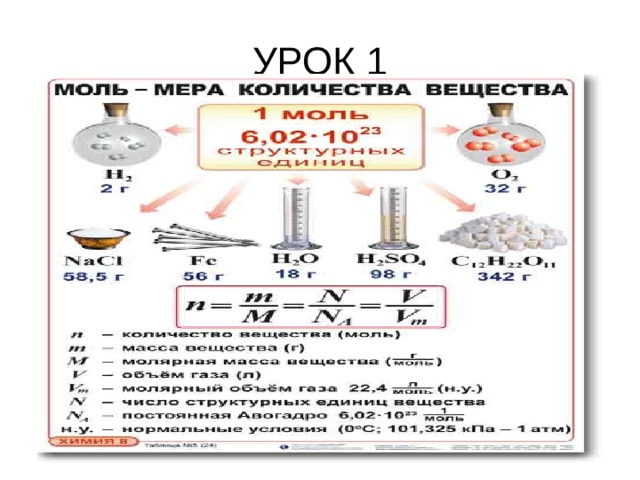
- КОЛИЧЕСТВО ВЕЩЕСТВА – число атомов, молекул или других формульных единиц вещества
( моль)

УРОК 1
- Молярная масса – масса 1 моль вещества
(г моль, кг моль) М
- Молярный объем – объем 1 моль газа при н.у.
V m = 22,4 л/моль

УРОК 1

УРОК 1
УРОК 1

УРОК 1
1.Какое количество вещества ( моль) содержит 12,04 · 10 ²³ атомов натрия?
2.Какова масса 2 моль азота?
3.Какой объем занимают 1,5 моль кислорода?
4.Какова масса 3 литров гелия?

1. n = N/ Na = 12, 04 · 10 ²³ / 6,02 · 10²³ = 2 моль
2 . m = n · M ( N₂ ) = 2 моль · 28 г/ моль = 56 г .
3 . V= n · Vm = 1,5 моль · 22,4 л/моль = 33,6 л.
4. m= n · M = V/Vm · M(He)= 3 л ./ 22,4л/моль · 4г/моль =
= 0,54 г.

Урок 1.
- 4. Основные положения атомно-молекулярного учения.
Атомно-молекулярное теория базируется на следующих законах и утверждениях:
- Все вещества состоят из атомов
- Атомы одного химического вещества ( химический элемент ) обладают одинаковыми свойствами, но отличаются от атомов другого вещества
- При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества )
- При физических явлениях молекулы не изменяются, при химических происходит изменение их состава
- Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества

Урок 1.
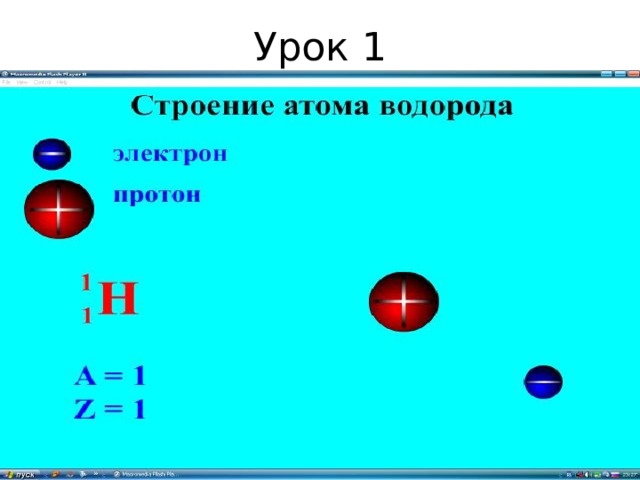
- Ядро : протоны и нейтроны
- Электроны

Урок 1
Урок 1

Урок 1.
- 6. Химический элемент, изотопы.
Химический элемент – совокупность атомов с одинаковым
зарядом ядра ( числом протонов).
Изотопы - разновидность атомов одного
химического элемента с разным
числом нейтронов в ядре.

Урок 1
- Каков порядковый номер калия?
- Сколько протонов в его ядре?
- Сколько электронов в атоме калия?
- Сколько нейтронов в ядре калия?
- Чему равно массовое число атома калия?
№ = 19
р = 19
е = 19
n = 20
Ar(K) = 39
Урок 1
7.Вещество.
Это вид материи; физическая субстанция со специфи-
ческими химическими свойствами.

8. Простые и сложные вещества

ТЕСТЫ
- мельчайшая химически неделимая электронейтраль-
ная частица вещества
- виды элементарных частиц?
- что называют массовым числом?
- вид атомов с одинаковым зарядом ядра?
- разновидность атомов с одинаковым зарядом ядра,
но разной массой?
ТЕСТЫ
Найдите соответствие :
- Химический элемент А) состоит из атомов одного вида, обладает
2. Простое вещество постоянными физическими свойствами
3. Сложное вещество Б) состоит из атомов разных видов, имеет
4. Смесь постоянные свойства
В) состоит из разных веществ, которые
отличаются по свойствам
Г) один вид атомов, физические свойства
которого обычно не характеризуются
Только сложные вещества перечислены в ряду :
- воздух, вода, кислород 2) серная кислота, водород, озон
3) поваренная соль, вода, сероводород 4) кислород, азот, хлор
Только простые вещества перечислены в ряду:
1) железо, кислород, соляная кислота 2) оксид натрия, вода, азот
3) фтор, кислород, сера 4) углерод, вода, сера
ОТВЕТ: 1 – Г; 2 - А;
3 – Б; 4 - В
ОТВЕТ: 1 - 3
ОТВЕТ: 3

Урок 1
- Закон постоянства состава вещества:
- каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
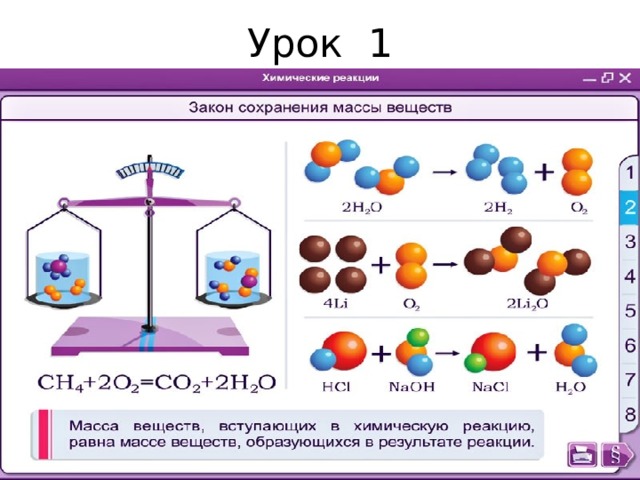
Урок 1
- Закон сохранения массы веществ в реакциях















































