Просмотр содержимого документа
«Презентация по теме "Алканы"»

ГАПОУ НСО «Барабинский медицинский колледж»
Алканы
Автор: Дъячук Л.В.

- Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями, состав которых выражается общей формулой C n H 2n+2 , где n – число атомов углерода.
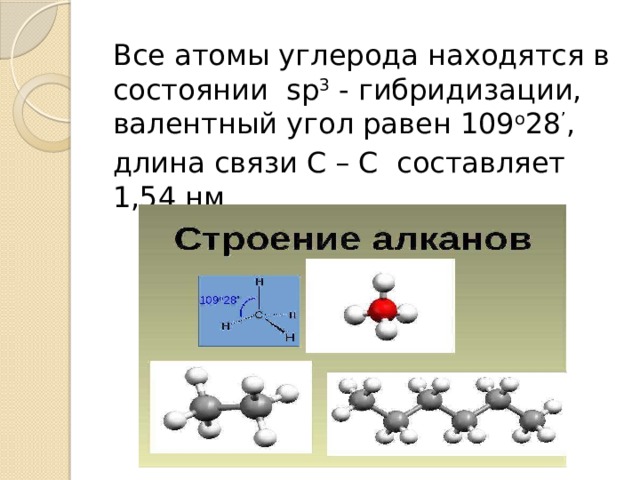
Все атомы углерода находятся в состоянии sp 3 - гибридизации, валентный угол равен 109 о 28 ’ ,
длина связи С – С составляет 1,54 нм


Строение молекулы метана
- В молекуле метана по месту одинарной связи атомы углерода находятся в состоянии sp 3 - гибридизации, т.е. у атома углерода гибридизации подверглись орбитали одного s и трёх р –электронов и образовались 4 одинаковые гибридные орбитали.
- В результате перекрывания этих орбиталей атома углерода и s – орбиталей атомов водорода образуется тетраэдрическая молекула метана с четырьмя одинаковыми ϭ – связями, расположенными под углом 109 о 28 ’ ,
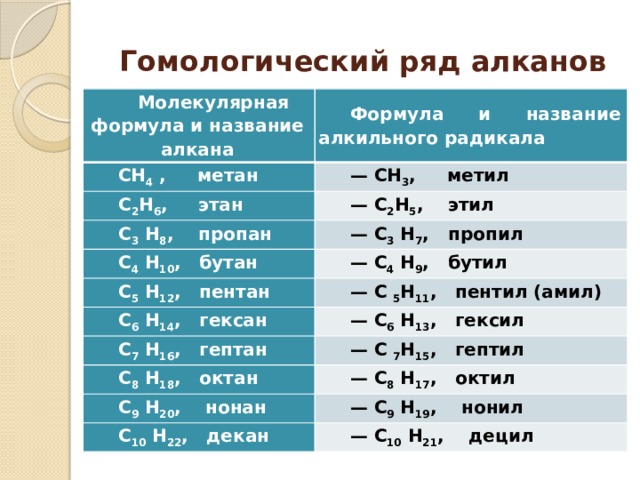
Гомологический ряд алканов
Молекулярная формула и название алкана
Формула и название алкильного радикала
СН 4 , метан
— СН 3 , метил
С 2 Н 6 , этан
— С 2 Н 5 , этил
С 3 Н 8 , пропан
— С 3 Н 7 , пропил
С 4 Н 10 , бутан
С 5 Н 12 , пентан
— С 4 Н 9 , бутил
— С 5 Н 11 , пентил (амил)
С 6 Н 14 , гексан
— С 6 Н 13 , гексил
С 7 Н 16 , гептан
— С 7 Н 15 , гептил
С 8 Н 18 , октан
— С 8 Н 17 , октил
С 9 Н 20 , нонан
— С 9 Н 19 , нонил
С 10 Н 22 , декан
— С 10 Н 21 , децил

Номенклатура алканов
- Для простейших алканов (С 1 -С 4 ) приняты тpивиальные названия: метан, этан, пpопан, бутан.
- Начиная с пятого гомолога, названия нормальных (неpазветвленных) алканов стpоят в соответствии с числом атомов углеpода, используя гpеческие числительные и суффикс -ан : пентан, гексан, гептан, октан, нонан, декан и т.д.
- В основе названия разветвленного алкана лежит название входящего в его конструкцию нормального алкана с наиболее длинной углеродной цепью.
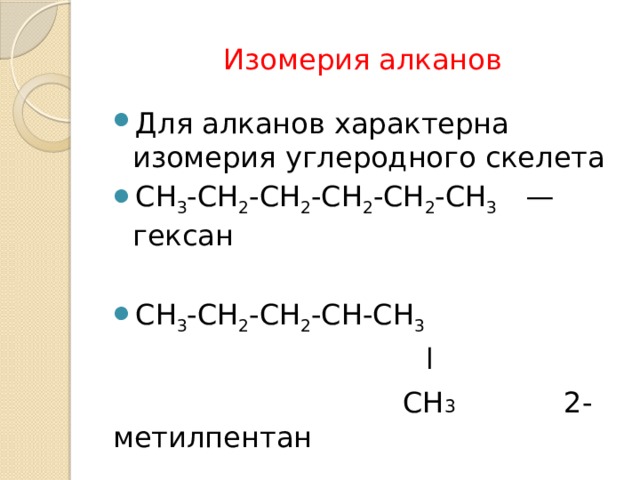
Изомерия алканов
- Для алканов характерна изомерия углеродного скелета
- СН 3 -СН 2 -СН 2 -СН 2 -СН 2 -СН 3 — гексан
- СН 3 -СН 2 -СН 2 -СН-СН 3
l
СН 3 2-метилпентан
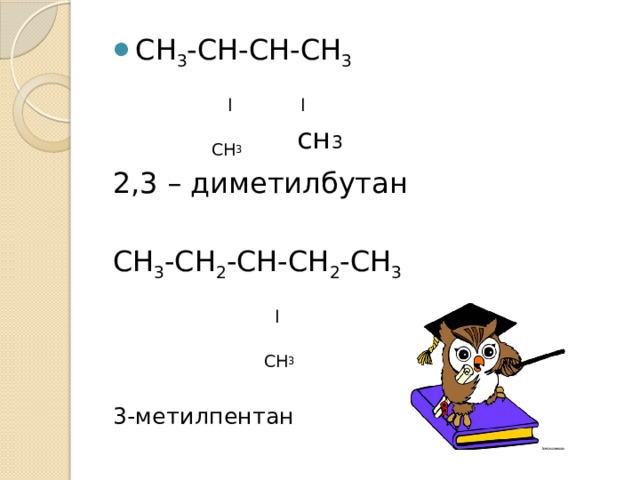
l l
СН 3 сн 3
2,3 – диметилбутан
СН 3 -СН 2 -СН-СН 2 -СН 3
l
СН 3
3-метилпентан

Спосoбы получения алканов
- 1. По реакции Вюрца – действием металлического натрия на галогеналканы
2СН 3 – СI + 2Nа → СН 3 – СН 3 + 2NаСI
- 2. Сплавлением натриевых солей карбоновых кислот с едкими щелочами:
СН 3 –СН 2 – СООNа + NаОН → СН 3 –СН 3 + Nа 2 СО 3 .

Спосoбы получения алканов
- 3. Гидролиз карбида алюминия , получается метан:
АI 4 С 3 + 12Н 2 О → 3СН 4 + 4АI(ОН) 3 .
- 4. Гидрирование непредельных углеводородов в присутствии катализаторов.
С 2 Н 4 + Н 2 → С 2 Н 6
- 5. Синтез из оксида углерода (II) и водорода:
СО + 3Н 2 → CH 4 + Н 2 О


Химические свойства алканов
- 1. Галогенирование (реакция радикального замещения):
- СН 4 + СI 2 → СН 3 СI + HCl
- СН 3 СI + Сl 2 →CH 2 Cl 2 + HCl
- CH 2 Cl 2 + Сl 2 → CHCl 3 + HCl
- CHCl 3 + Cl 2 → CCl 4 + HCl
- Полученные вещества используются как растворители и исходные соединения в органических синтезах

- 2. Нитрование (реакция М.И.Коновалова)
СН 4 + НNO 3 → CH 3 NO 2 + H 2 O
Реакция применяется для получения нитросоединений – растворителей, исходных веществ для многих синтезов.
- 3. Реакции окисления
- а) неполное окисление
2СН 4 + 3О 2 → 2СО + 4Н 2 О
СН 4 + 2О 2 → СО 2 + 2Н 2 О
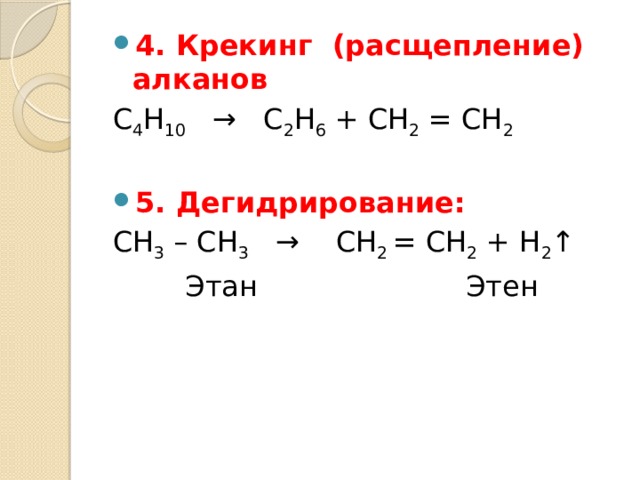
- 4. Крекинг (расщепление) алканов
С 4 Н 10 → С 2 Н 6 + СН 2 = СН 2
СН 3 – СН 3 → СН 2 = СН 2 + Н 2 ↑
Этан Этен

- 6. Реакции термического расщепления метана:
- При нагревании метана до температуры 1000 градусов начинается пиролиз метана – разложение на простые вещества:
СН 4 → С + 2Н 2
- При нагревании до температуры 1500 градусов возможно образование ацетилена:
2СН 4 → С 2 Н 2 + 3Н 2
- 7. Изомеризация
- При нагревании линейных углеводородов с катализатором образуются алканы с разветвлённым углеродным скелетом.
СН 3 -СН 2 -СН 2 -СН 2 -СН 3 → СН 3 -СН-СН 2 -СН 3
׀
СН3


Применение алканов
- Метан используется в основном в качестве дешевого топлива. При горении он дает почти бесцветное пламя.
- Средние члены гомологического ряда используют как горючее для двигателей (бензин, керосин), а также в качестве растворителей.
- Высшие алканы – топливо для дизельных двигателей, смазочные масла и сырье для производства моющих средств.

Задания для закрепления знаний по теме «Алканы»
- Задание 1
- Осуществите превращения:
С→СН 4 →СН 3 Br→C 2 H 6 →CO 2

Эталоны ответов
- 1) С + 2Н 2 → СН 4
- 2) СН 4 + Br 2 → CH 3 Br + HBr
- 3) 2CH 3 Br + 2Na → C 2 H 6 + 2NaBr
- 4) 2C 2 H 6 + 7O 2 → 4CO 2 + 6H 2 O

- Задание 2.
- Ответьте на вопросы:
- 1) Какие химические связи между атомами углерода в молекулах алканов?
- 2) Какая общая формула у алканов?
- 3) Какой тип изомерии характерен для алканов?
- 4) В какие реакции вступают алканы?
- 5) Назовите гомологи метана

Предварительный контроль новых знаний
- Выберите правильный ответ:
- 1. Общая формула Алканов:
а) Сn Н2n;
б) Сn Н2n+2;
в) Сn Н2n-2.
- 2. В Алканах связи С-С и С-Н:
а) сигма;
б) пи.

- 3. Пространственное строение метана:
а) кубическое;
б) цилиндрическое;
в) тетраэдрическое.
- 4. Вещество с формулой СН3-СН2-СН2-СН3 называется:
а) этан;
б) пропан;
в) метан;
г) пентан;
д) бутан.

- Напишите продолжение утверждения:
- 5. Первый представитель гомологического ряда Алканов - ………
- 6. Структура пропана -…………..
- 7. Вещество СН3-СН(СН3)-СН2-СН2-СН3 называется …………

- 8. Установить соответствие (записать в виде сочетания цифр и букв):
- Вещество: Формула:
- 1. метан а) СН3-СН3;
- 2. пропан б) СН4;
- 3. этан в) СН3-СН2-СН3.
- 9. Установить соответствие (записать в виде сочетания цифр и букв):
- Реакция: Реактив:
- 1. горение; а) СL2;
- 2. хлорирование; б) HNO3;
- 3. нитрование; в) О2;

- 10. Установить соответствие:
- Формула: Название:
1. СО; а) нитрометан;
2. СН3-СН2-NO2; б) хлорпропан;
3. СН3NО2; в) угарный газ;
4. С3Н7СL; г) нитроэтан;

Эталоны ответов
- 1.б
- 2.а
- 3.в
- 4.д
- 5.метан
- 6.зигзагообразная
- 7.2-метилпентан
- 8.1б; 2в;3а
- 9.1в; 2а; 3б
- 10.1в; 2г; 3а; 4б
![Задание для самостоятельной внеаудиторной работы студентов Изучите текст учебника, выполните письменно задание: [1,§10, упр. 3б]](https://fsd.multiurok.ru/html/2020/01/16/s_5e20396c49eba/img27.jpg)
- Задание для самостоятельной внеаудиторной работы студентов
- Изучите текст учебника, выполните письменно задание: [1,§10, упр. 3б]
![Список использованных источников 1. Габриелян, О.С. Химия. 10 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с. 2. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с. 3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с. 4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz](https://fsd.multiurok.ru/html/2020/01/16/s_5e20396c49eba/img28.jpg)
Список использованных источников
- 1. Габриелян, О.С. Химия. 10 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с.
- 2. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с.
- 3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с.
4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz

































![Задание для самостоятельной внеаудиторной работы студентов Изучите текст учебника, выполните письменно задание: [1,§10, упр. 3б]](https://fsd.multiurok.ru/html/2020/01/16/s_5e20396c49eba/img27.jpg)
![Список использованных источников 1. Габриелян, О.С. Химия. 10 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с. 2. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с. 3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с. 4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz](https://fsd.multiurok.ru/html/2020/01/16/s_5e20396c49eba/img28.jpg)










