АЛКАНЫ
Строение, номенклатура, изомерия, химические и физические свойства.
2022 год
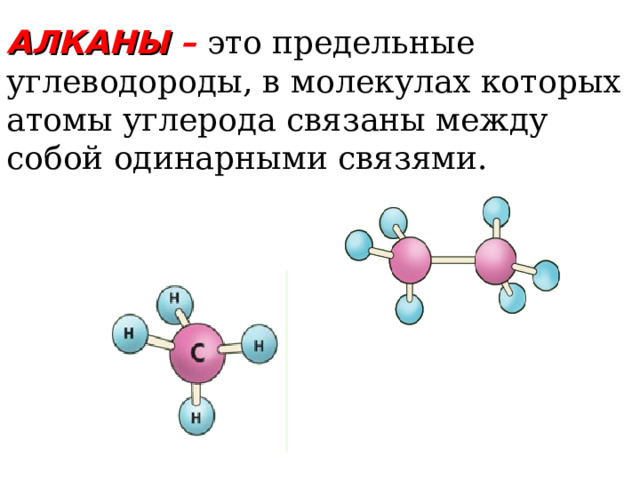
АЛКАНЫ – это предельные углеводороды, в молекулах которых атомы углерода связаны между собой одинарными связями.

Общая формула
С n H 2n+2 , где n=1,2,3…
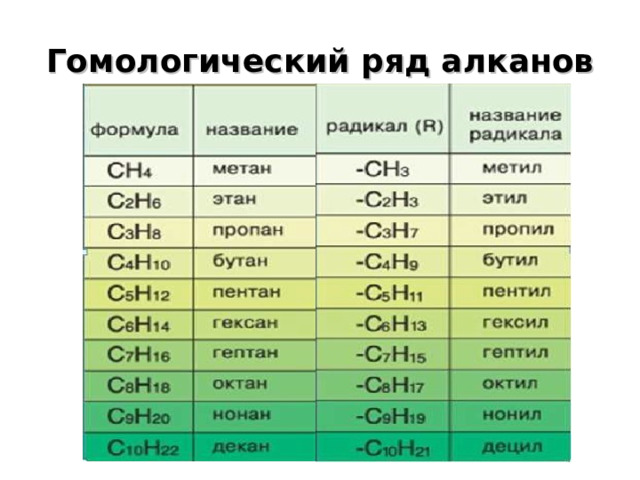
Гомологический ряд алканов
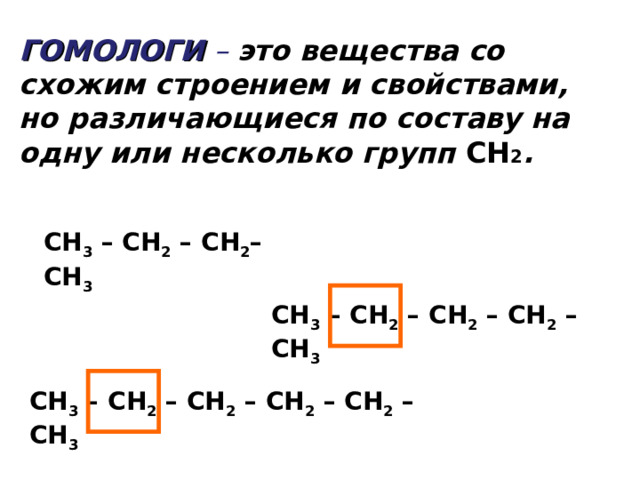
ГОМОЛОГИ – это вещества со схожим строением и свойствами, но различающиеся по составу на одну или несколько групп CH 2 .
СН 3 – СН 2 – СН 2 – СН 3
СН 3 – СН 2 – СН 2 – СН 2 – СН 3
СН 3 – СН 2 – СН 2 – СН 2 – СН 2 – СН 3

ИЗОМЕРЫ – вещества, имеющие одинаковый состав молекул, но различное химическое строение и обладающие поэтому разными свойствами.
Виды изомерии алканов:
структурная(изомерия углеродного скелета), поворотная, оптическая(зеркальная)
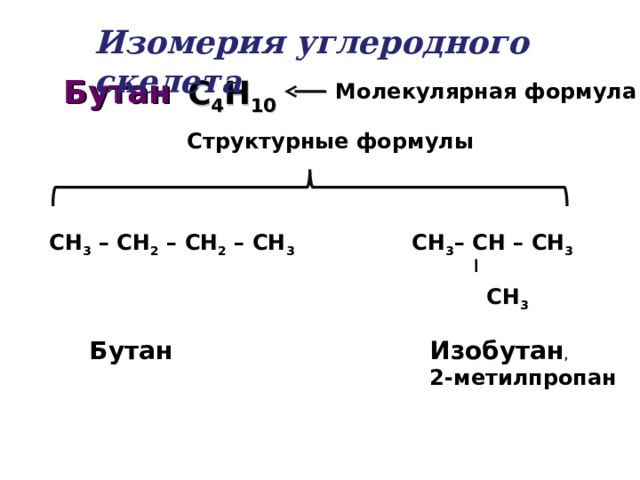
Изомерия углеродного скелета
Бутан
С 4 Н 10
Молекулярная формула
Структурные формулы
СН 3 – СН – СН 3
СН 3
СН 3 – СН 2 – СН 2 – СН 3
Бутан
Изобутан ,
2-метилпропан
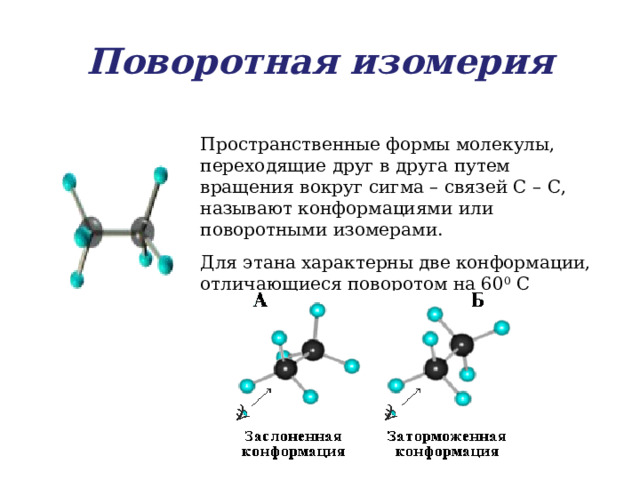
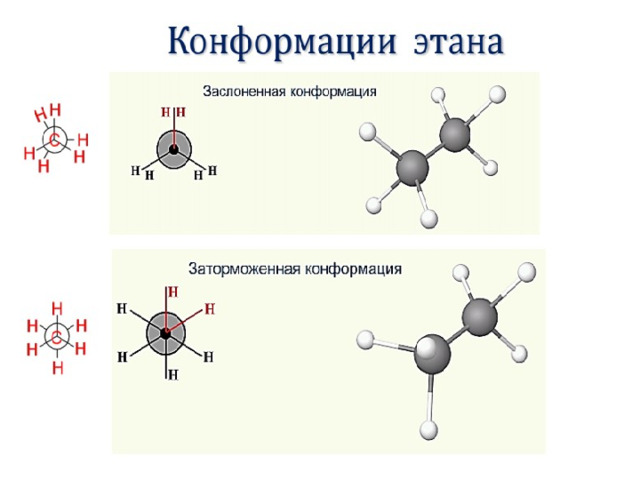
Поворотная изомерия
Пространственные формы молекулы, переходящие друг в друга путем вращения вокруг сигма – связей С – С, называют конформациями или поворотными изомерами.
Для этана характерны две конформации, отличающиеся поворотом на 60 0 С
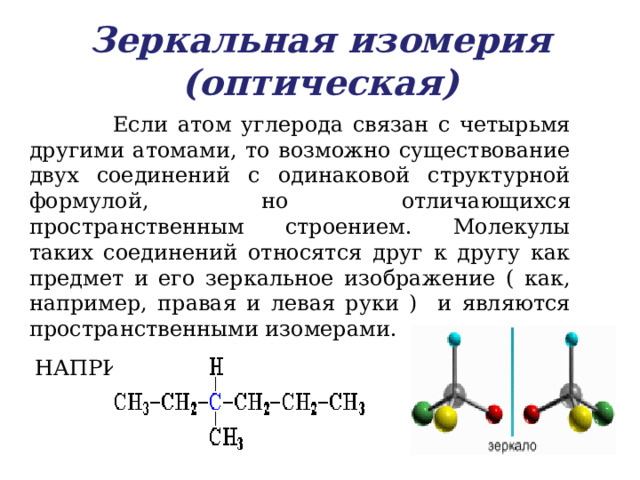
Зеркальная изомерия (оптическая)
Если атом углерода связан с четырьмя другими атомами, то возможно существование двух соединений с одинаковой структурной формулой, но отличающихся пространственным строением. Молекулы таких соединений относятся друг к другу как предмет и его зеркальное изображение ( как, например, правая и левая руки ) и являются пространственными изомерами.
НАПРИМЕР, 3 - метилгексан

Алгоритм:
- Выбор главной, самой длинной цепи :
CH 3 – CH - CH 2 - CH 3
│
CH 3
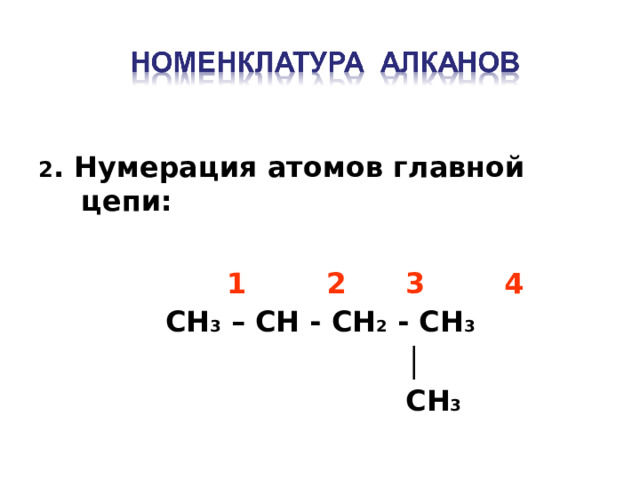
2 . Нумерация атомов главной цепи :
1 2 3 4
CH 3 – CH - CH 2 - CH 3
│
CH 3
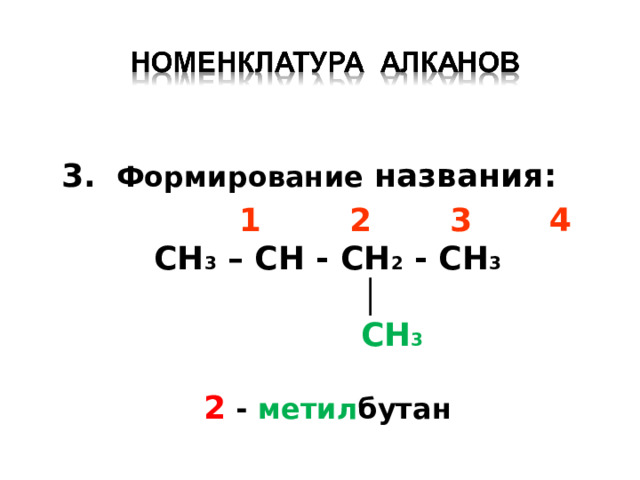
3. Формирование названия :
1 2 3 4
CH 3 – CH - CH 2 - CH 3
│
CH 3
2 - метил бутан
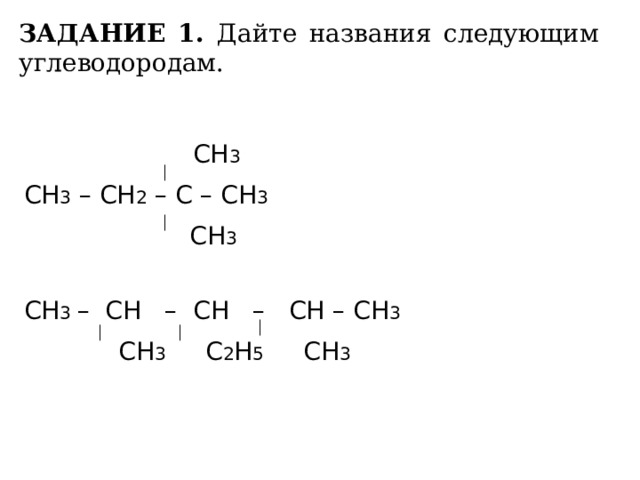
ЗАДАНИЕ 1. Дайте названия следующим углеводородам.
СН 3
СН 3 – СН 2 – С – СН 3
СН 3
СН 3 – СН – СН – СН – СН 3
СН 3 С 2 Н 5 СН 3
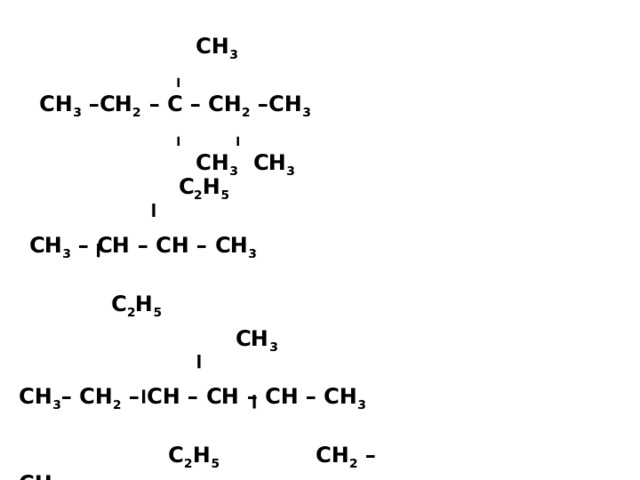
СН 3
І
СН 3 –СН 2 – С – СН 2 –СН 3
І І
СН 3 СН 3
С 2 Н 5
СН 3 – СН – СН – СН 3
С 2 Н 5
СН 3
СН 3 – СН 2 – СН – СН – СН – СН 3
С 2 Н 5 СН 2 – СН 3

ЗАДАНИЕ 2. Составьте структурные формулы следующих веществ:
1. 2,3 – диметилпентан;
2. 3,3,4 – триметилгексан;
3. 2,5-диметилгексан;
4. 3,3,5,5-тетраметилоктан;
5. 2,2-диметил-4-хлорпентан.
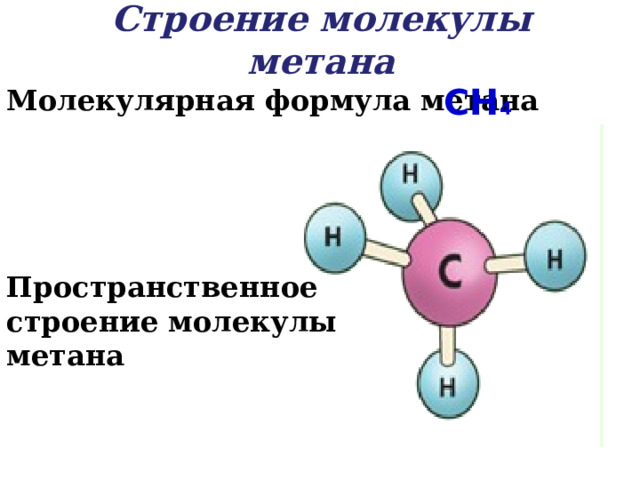
Строение молекулы метана
CH 4
Молекулярная формула метана
Пространственное строение молекулы метана
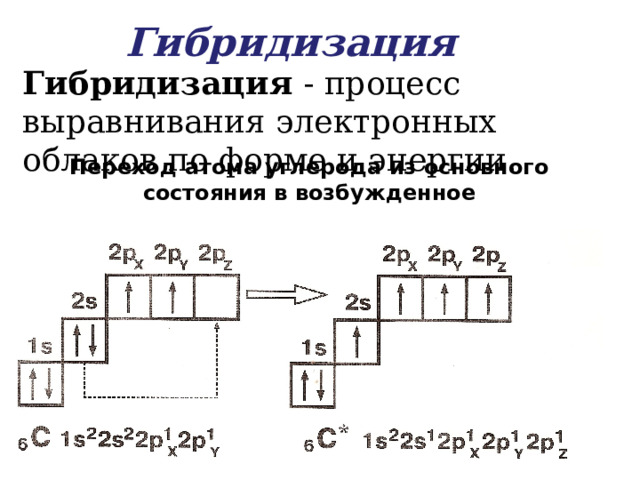
Гибридизация
Гибридизация - процесс выравнивания электронных облаков по форме и энергии.
Переход атома углерода из основного состояния в возбужденное
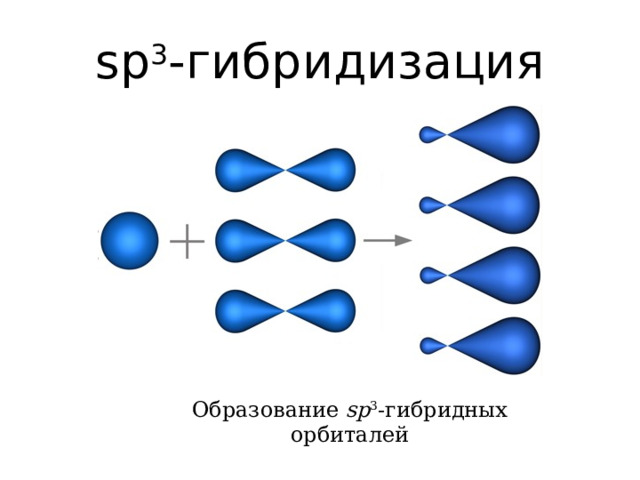
sp 3 - гибридизация
Образование sp 3 -гибридных орбиталей
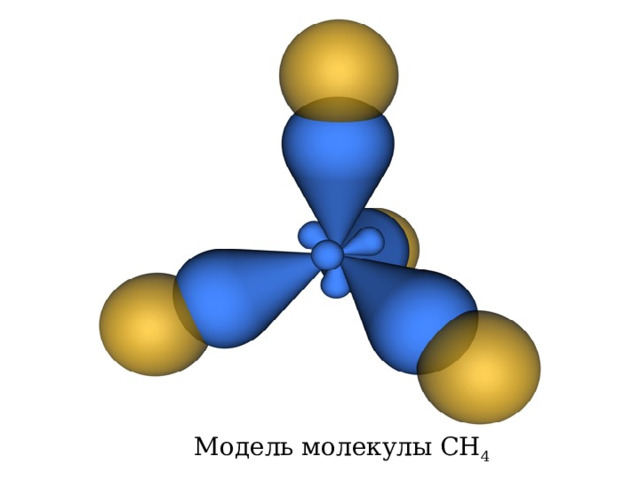
Модель молекулы CH 4
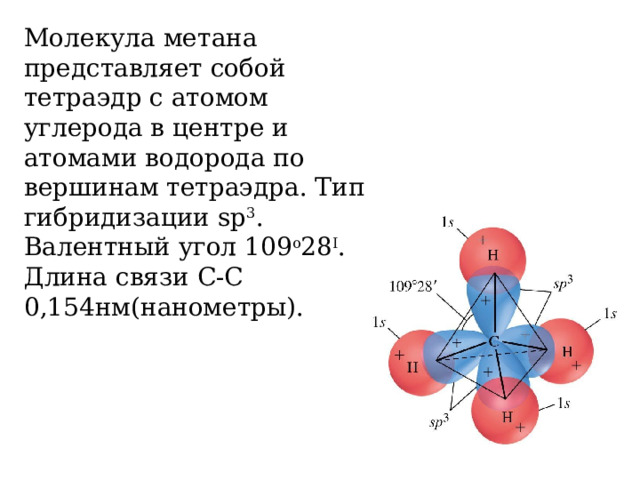
Молекула метана представляет собой тетраэдр с атомом углерода в центре и атомами водорода по вершинам тетраэдра. Тип гибридизации sp 3 . Валентный угол 109 о 28 I . Длина связи С-С 0,154нм(нанометры).
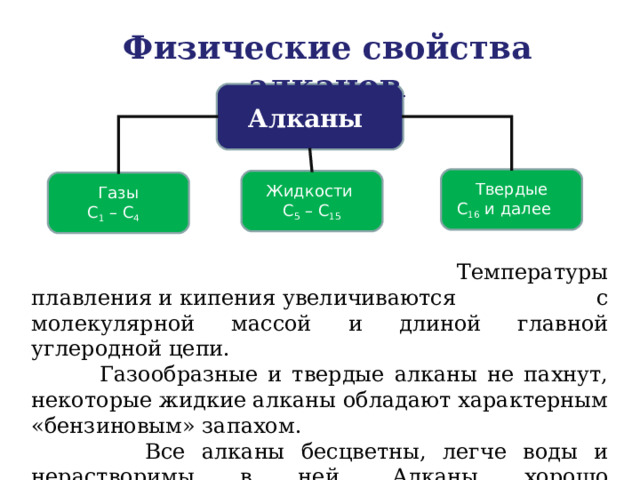
Физические свойства алканов .
Алканы
Твердые
С 16 и далее
Жидкости
С 5 – С 15
Газы
С 1 – С 4
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи.
Газообразные и твердые алканы не пахнут, некоторые жидкие алканы обладают характерным «бензиновым» запахом.
Все алканы бесцветны, легче воды и нерастворимы в ней. Алканы хорошо растворяются в органических растворителях, жидкие алканы (пентан, гексан) используются как растворители.

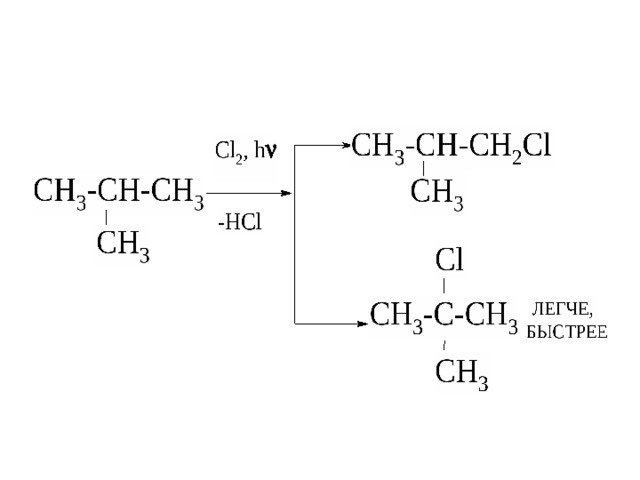
1. Реакции замещения
Протекают по механизму радикального замещения .
а) с галогенами (с Cl 2 – на свету, с Br 2 – при нагревании).
Хлорирование метана
22


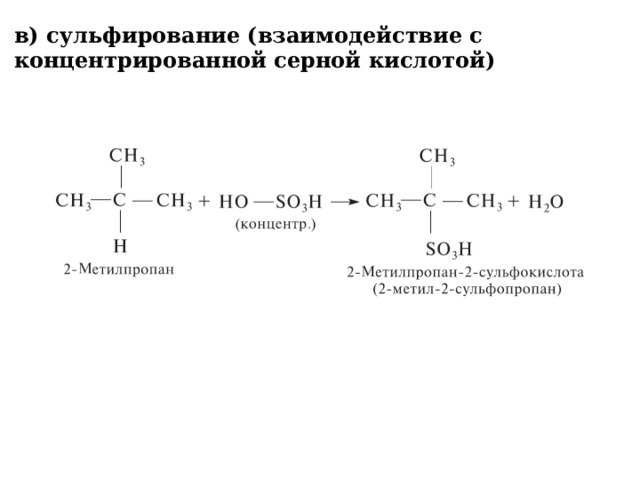
в) сульфирование (взаимодействие с концентрированной серной кислотой)

2. Реакции окисления
а) горение:
C n H 2n+2 + (3n+1)/2O 2 → nCO 2 + (n+1)H 2 O
CH 4 + 2O 2 → CO 2 + 2H 2 O
C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O
б) неполное окисление:
2C 3 H 8 + 7O 2 → 6CO + 8H 2 O
CH 4 + O 2 → C + 2H 2 O
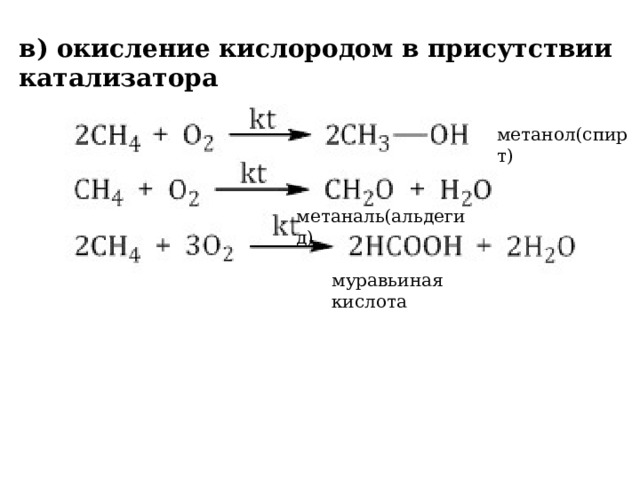
в) окисление кислородом в присутствии катализатора
метанол(спирт)
метаналь(альдегид)
муравьиная кислота

3. Термические превращения алканов
а) дегидрирование(отщепление водорода) в присутствии катализатора при высоких температурах :
Pt , t°
CH 3 – CH 3
CH 2 =CH 2 + H 2
этилен
Пиролиз - промышленный способ получения ацетилена.
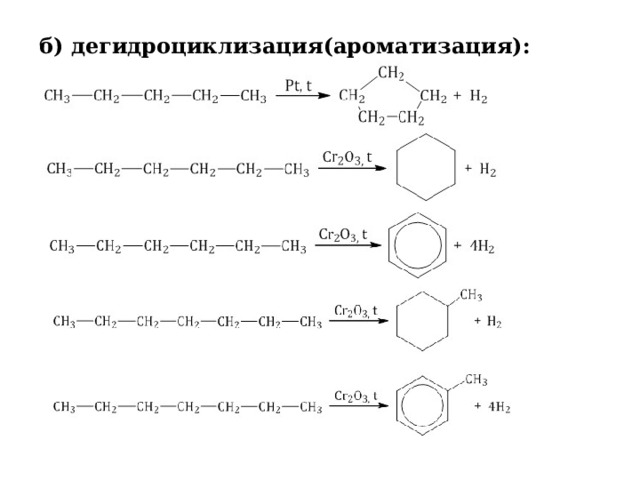
б) дегидроциклизация(ароматизация):

в) крекинг - это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
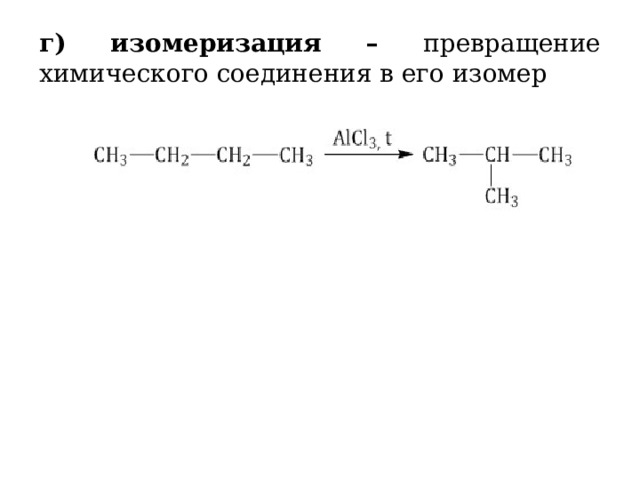
г) изомеризация – превращение химического соединения в его изомер

Способы получения


1926 г. Фишер-Тропш




Задания для самостоятельной работы:
Задание 1. Назовите вещества
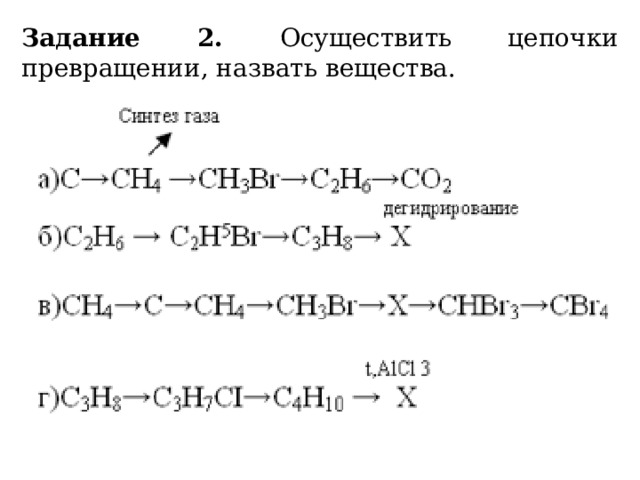
Задание 2. Осуществить цепочки превращении, назвать вещества.

Домашние задание

Спасибо за внимание!!!