© 2021, Кривенко Алина Александровна 1249 28


СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Была в сети 25.09.2024 10:29

Кривенко Алина Александровна
ОБПОУ "КЭМТ"
29 лет
Специализация












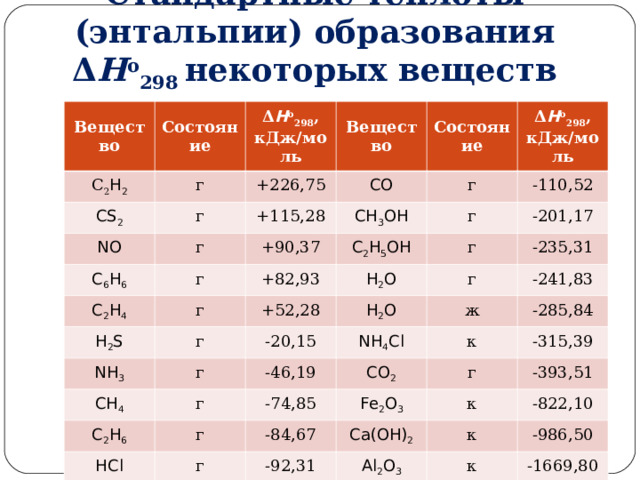
 0 ( H 2 H 1 ) . В дальнейшем тепловые эффекты всюду выражаются через Δ Н . " width="640"
0 ( H 2 H 1 ) . В дальнейшем тепловые эффекты всюду выражаются через Δ Н . " width="640"
 0, и убывает в экзотермическом, Н " width="640"
0, и убывает в экзотермическом, Н " width="640"