
Всё познаётся в сравнении.
Гидролиз солей
11 класс

Цели урока:
- Ознакомиться с понятием гидролиза солей.
- Рассмотреть типы гидролиза.
- Научиться составлять ионные уравнения гидролиза солей.
- Научиться определять тип гидролиза соли по её формуле.

 [OH – ] [H+] pH =7 pH pH 7 " width="640"
[OH – ] [H+] pH =7 pH pH 7 " width="640"
Среды водных растворов электролитов
Типы сред
Кислотная
Нейтральная
Щелочная
[H + ] = [OH – ]
[H+] [OH – ]
[H+]
pH =7
pH
pH 7

Определение типа среды с помощью индикаторов
Индикатор
Окраска индикатора в среде
нейтральной
кислотной
щелочной
красная
фиолетовая
Лакмус
синяя
розовая
оранжевая
Метиловый оранжевый
желтая
Фенол- фталеин
бесцветная
бесцветная
малиновая
 7 32 Кислотная pH розовая бесцветная красная ZnSO 4 46 Na 2 SO 4 фиолетовая оранжевая бесцветная Нейтральная pH = 7 " width="640"
7 32 Кислотная pH розовая бесцветная красная ZnSO 4 46 Na 2 SO 4 фиолетовая оранжевая бесцветная Нейтральная pH = 7 " width="640"
Лабораторный опыт Таблица № 1
Окраска индикатора
Соли
Среда,
pH
Фенол-фталеин
Лакмус
Метил-оранж
37
желтая
Na 2 CO 3
синяя
малиновая
Щелочная
pH 7
32
Кислотная
pH
розовая
бесцветная
красная
ZnSO 4
46
Na 2 SO 4
фиолетовая
оранжевая
бесцветная
Нейтральная
pH = 7

Что такое гидролиз?
( от греческого hydro – вода ;
lysis – разложение )

Классификация солей
СОЛИ,
образованные
Na 2 SO 4
Zn SO 4
Na 2 CO 3
сильным основанием и слабой кислотой
слабым основанием и сильной кислотой
сильным основанием и сильной кислотой

Сущность гидролиза
1. Na 2 CO 3 2Na + + CO 3 2 -
( катион) (анион)
H 2 O ⇄ OH - + H +
2. Zn SO 4 Zn 2 + + SO 4 2 -
( катион) (анион)
H 2 O ⇄ OH - + H +
3. Na 2 SO 4 2Na + + SO 4 2 -
( катион) (анион)
H 2 O ⇄ OH - + H +
Гидролиз
по аниону
Гидролиз
по катиону
Гидролиз
не протекает

Определение гидролиза
- Гидролиз соли – это химическая реакция обмена соли с водой ,
в результате которой ионы слабого электролита, входящие в состав соли, соединяются с составными частями воды : H + и OH - .
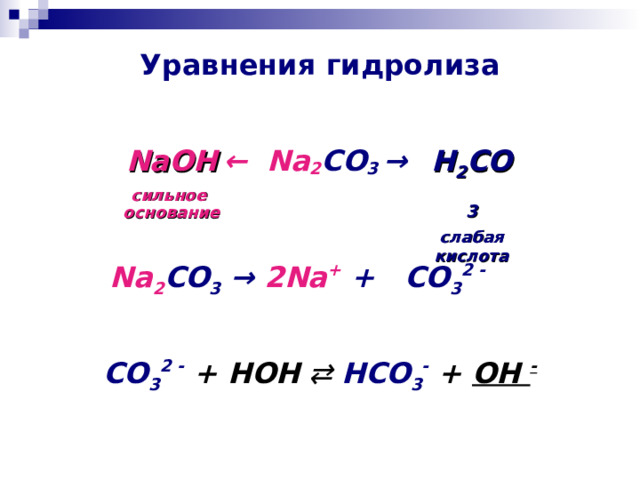
Уравнения гидролиза
← Na 2 CO 3 →
NaOH
сильное основание
H 2 CO 3
слабая кислота
Na 2 CO 3 → 2Na + + CO 3 2 -
CO 3 2 - + HOH ⇄ HCO 3 - + OH -

Уравнения гидролиза
← Zn S O 4 →
Zn (ОН) 2
слабое основание
H 2 SO 4
сильная кислота
Zn SO 4 → Zn 2+ + SO 4 2 -
Zn 2 + + HOH ⇄ ZnOH + + H +
 7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) не подвергаются гидролизу Сильным основанием 3. сильная кислотой " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) не подвергаются гидролизу Сильным основанием 3. сильная кислотой " width="640"
Гидролиз солей
№
Соли, образованные
Реакция среды, pH
Тип гидролиза
1.
щелочная ( pH 7)
гидролиз по аниону
слабой кислотой
Сильным основанием
кислотная ( pH
2.
Слабым основанием
гидролиз по катиону
сильной кислотой
нейтральная среда ( pH = 7)
не подвергаются гидролизу
Сильным основанием
3.
сильная кислотой

Задание. Определите реакцию среды водных растворов солей. Таблица № 2
III ряд
№
II ряд
I ряд
KCl
NaNO 2
Li 2 SO 4
1.
Н
Н
Щ
Na 2 SO 3
2.
CuSO 4
FeCl 3
Щ
К
К
3.
KI
KMnO 4
K 3 PO 4
Щ
Н
Н
NH 4 NO 3
LiNO 3
NaClO 4
4.
Н
К
Н
Na 2 SiO 3
K 2 S
5.
NaNO 3
Щ
Щ
Н
н -нейтральная; к – кислотная; щ - щелочная

Экспериментальная задача
- В трех пронумерованных пробирках даны растворы солей : ZnCl 2 , K 2 S , KCl .
а) Исследуйте каждый из них универсальной индикаторной бумагой;
б) распознайте данные вещества;
в) укажите тип гидролиза;
г) напишите ионные уравнения гидролиза.

Таблица № 3
№
Окраска индикатора
1.
Формула соли
2.
Тип гидролиза
3.
Ионное уравнение
 7) Индикатор не изменяет окраску ( pH =7) 2 - KCl 1 - K 2 S Индикатор красный ( pH 3 – ZnCl 2 " width="640"
7) Индикатор не изменяет окраску ( pH =7) 2 - KCl 1 - K 2 S Индикатор красный ( pH 3 – ZnCl 2 " width="640"
Экспериментальная задача
Индикатор синий
( pH 7)
Индикатор не изменяет окраску
( pH =7)
2 - KCl
1 - K 2 S
Индикатор красный
( pH
3 – ZnCl 2
 7) гидролиз по аниону слабой кислотой Сильным основанием гидролиз по катиону 2. кислотная ( pH сильной кислотой Слабым основанием 3. нейтральная среда ( pH = 7) не подверга-ются гидро-лизу Сильным основанием сильная кислотой ? гидролиз по катиону и аниону слабой кислотой 4. Слабым основанием " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием гидролиз по катиону 2. кислотная ( pH сильной кислотой Слабым основанием 3. нейтральная среда ( pH = 7) не подверга-ются гидро-лизу Сильным основанием сильная кислотой ? гидролиз по катиону и аниону слабой кислотой 4. Слабым основанием " width="640"
Гидролиз солей
№
Соли, образованные
Реакция среды
Тип гидролиза
1.
Щелочная ( pH 7)
гидролиз по аниону
слабой кислотой
Сильным основанием
гидролиз по катиону
2.
кислотная ( pH
сильной кислотой
Слабым основанием
3.
нейтральная среда ( pH = 7)
не подверга-ются гидро-лизу
Сильным основанием
сильная кислотой
?
гидролиз по
катиону и
аниону
слабой кислотой
4.
Слабым основанием

Готовимся к ЕГЭ
1. Установите соответствие:
Формула соли Тип гидролиза
1. FeCl 2 А. по катиону
2. Ba(NO 3 ) 2 Б. по аниону
3. KF В. не гидролизуется
4. Na 3 PO 4
Ответ:
1А;
2В;
3Б;
4Б

Готовимся к ЕГЭ
2. Установите соответствие:
Формула соли Среда раствора
1. K 2 SO 4 А. кислотная
2. Li 2 CO 3 Б. щелочная
3. NH 4 Br В. нейтральная
4. CrCl 3
Ответ:
1В;
2Б;
3А;
4А
 7 3. CuCl 2 В. pH = 7 4. NaCl Ответ: 1Б; 2В; 3А; 4В " width="640"
7 3. CuCl 2 В. pH = 7 4. NaCl Ответ: 1Б; 2В; 3А; 4В " width="640"
Готовимся к ЕГЭ
3. Установите соответствие:
Формула соли Значение pH
1. K 2 SiO 3 А. pH
2. LiNO 3 Б. pH 7
3. CuCl 2 В. pH = 7
4. NaCl
Ответ:
1Б;
2В;
3А;
4В

Человек рождается на свет,
Чтоб творить, дерзать – и не иначе,
Чтоб оставить в жизни добрый след
И решить все трудные задачи.
Человек рождается на свет…
Для чего? Ищите свой ответ!

Всё познаётся в сравнении.

Домашнее задание
- § 16 с. 163 – 168, упр. 3,4










 [OH – ] [H+] pH =7 pH pH 7 " width="640"
[OH – ] [H+] pH =7 pH pH 7 " width="640"

 7 32 Кислотная pH розовая бесцветная красная ZnSO 4 46 Na 2 SO 4 фиолетовая оранжевая бесцветная Нейтральная pH = 7 " width="640"
7 32 Кислотная pH розовая бесцветная красная ZnSO 4 46 Na 2 SO 4 фиолетовая оранжевая бесцветная Нейтральная pH = 7 " width="640"






 7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) не подвергаются гидролизу Сильным основанием 3. сильная кислотой " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) не подвергаются гидролизу Сильным основанием 3. сильная кислотой " width="640"



 7) Индикатор не изменяет окраску ( pH =7) 2 - KCl 1 - K 2 S Индикатор красный ( pH 3 – ZnCl 2 " width="640"
7) Индикатор не изменяет окраску ( pH =7) 2 - KCl 1 - K 2 S Индикатор красный ( pH 3 – ZnCl 2 " width="640"
 7) гидролиз по аниону слабой кислотой Сильным основанием гидролиз по катиону 2. кислотная ( pH сильной кислотой Слабым основанием 3. нейтральная среда ( pH = 7) не подверга-ются гидро-лизу Сильным основанием сильная кислотой ? гидролиз по катиону и аниону слабой кислотой 4. Слабым основанием " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием гидролиз по катиону 2. кислотная ( pH сильной кислотой Слабым основанием 3. нейтральная среда ( pH = 7) не подверга-ются гидро-лизу Сильным основанием сильная кислотой ? гидролиз по катиону и аниону слабой кислотой 4. Слабым основанием " width="640"


 7 3. CuCl 2 В. pH = 7 4. NaCl Ответ: 1Б; 2В; 3А; 4В " width="640"
7 3. CuCl 2 В. pH = 7 4. NaCl Ответ: 1Б; 2В; 3А; 4В " width="640"













