
Ионная химическая связь

Восемь электронов на внешнем уровне предельное число для каждого элемента Периодической системы Д.И. Менделеева (кроме Н и Нe)
- Добиваются этого атомы либо отдавая электроны с внешнего уровня, либо принимая
- Атомы металлов имеют тенденцию к отдаче электронов с внешнего уровня,т.к у них алое число е
- Атомы неметаллов имеют тенденцию к принятию электронов недостающих до завершения уровня, т. К число е от 4 до 8

Свойства атомов химических элементов изменятся с увеличением порядкового номера

Частица, отдающая электроны,
превращается в положительный ион ( катион )
0
+1
-
Na
Na
1e
атом
ион
Частица, принимающая электроны,
превращается в отрицательный ион (анион).
Использован слайд из презентации Баженова А.А. «Ионы и ионная связь» в исправленном виде http://www.alekseibazhenov.narod.ru/proektor8chem.html
0
+
-1
Cl
Cl
1e
атом
ион
4

Строение атома
е
-
Na
11
+ 11
Отдать
1 электрон
+ 11
У атома Na
на внешнем энергетическом уровне
1 электрон
Na легко может отдать его
Тогда внешним становится второй,
заполненный 8 электронами,
энергетический уровень

Строение атома
Cl
-
е
17
-
-
е
е
+ 17
-
Принять
1 электрон
е
-
-
е
е
-
-
е
е
-
е
+ 17
-
е
е
-
е
-
е
-
-
е
е
Атом СL имеет
на внешнем энергетическом уровне
7 электронов
Для завершения внешнего энергетического уровня
не хватает 1 электрона
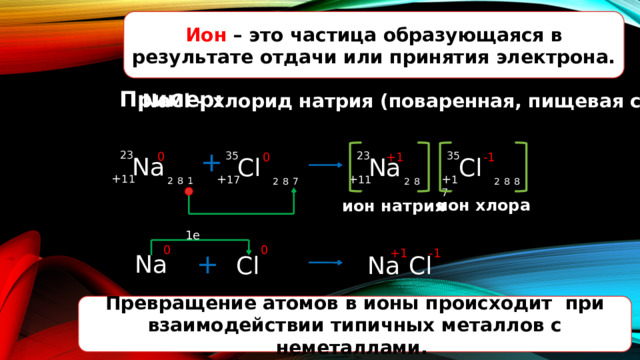
Ион – это частица образующаяся в результате отдачи или принятия электрона.
Пример:
NaCl – хлорид натрия (поваренная, пищевая соль)
+
23
0
23
35
35
0
+1
-1
Na
Cl
Na
Cl
+ 11
+ 17
+ 17
+ 11
1
2
8
2
8
7
8
8
2
2
8
ион хлора
ион натрия
1e
Использован слайд из презентации Баженова А.А. «Ионы и ионная связь» в исправленном виде http://www.alekseibazhenov.narod.ru/proektor8chem.html
0
0
-1
+1
+
Na
Cl
Cl
Na
Превращение атомов в ионы происходит при взаимодействии типичных металлов с неметаллами.
7

Механизм образования ионной связи
Na
CI
+
+11
+17
2
8
1
7
8
2
Na
CI
+17
+11
8
8
8
0
2
2

Ион
Ио́н (греч.) - «идущий»
Заряженные частицы, которые образуются
при потере или присоединении электронов
Положительно заряженный ион – КАТИОН( кто отдает)
Отрицательно заряженный ион – АНИОН) кто принимает
-
+
Na
Cl
катион натрия
анион хлора
![Механизм образования ионной связи Na 2- + + ] [ S Na Na S + Na](https://fsd.multiurok.ru/html/2021/11/23/s_619c7a181f879/img9.jpg)
Механизм образования ионной связи
Na
2-
+
+
]
[
S
Na
Na
S
+
Na

Алгоритм (последовательность) действий при записи схемы образования ионной связи
1.Кальций - элемент главной подгруппы II группы, металл.
Он отдаёт два электрона.
Ca 0 2 е Ca 2+
2. Хлор – элемент главной подгруппы VII группы, неметалл.
Он принимает один электрон.
Cl 0 + 1е Cl -
3. Находим наименьшее общее кратное между зарядами (равно 2)
4. Определяем, сколько атомов кальция нужно взять, чтобы они отдали два электрона (один атом) и сколько атомов хлора, чтобы они смогли принять 2 электрона (два атома )
5. Составляем схему реакции
Ca 0 + 2Cl 0 Ca 2+ Cl 2 -

Типы химических связей
Вид связи
Тип связываемых элементов
Вид связываемых частиц
Механизм образования связи
Пример
NaCl
Переход ē от
атомов металлов.
Ca F 2
Li 2 O
к атомам
неметаллов( прием и отдача е )
Металл
– неметалл
Ионная
Ионы

Упражнение 1
- Запишите схемы образования ионной связи в следующих веществах:
а) CaS
б) MgCl 2
в) Na 3 N

Упражнение 2
- Запишите схемы образования ковалентной связи в следующих веществах:
а) N 2
б) CH 4
в) HF

Химическая связь
Металлическая связь характерна только для металлов!!, которые не связаны с другими элементами

Металлическая связь характерна для…
Только в жидком и твердом состоянии!

Ме легко отдают ē
Ме 0 – n ē ⇆ Me n+
атомы ионы
металла металла

Свойства металлов, обусловленные металлической связью
- Электропроводность (Ag, Cu, Au, Al)
- Пластичность ( Au, Ag, Cu)
- Металлический блеск (Al, Ag, Pd)

- https:// www.youtube.com/watch?v=cmOafAVGaZw
- https:// www.youtube.com/watch?v=UoVOLOPzqt0















![Механизм образования ионной связи Na 2- + + ] [ S Na Na S + Na](https://fsd.multiurok.ru/html/2021/11/23/s_619c7a181f879/img9.jpg)



















