Тема:
Соли

Содержание
- Состав солей
- Что такое соли?
- Алгоритм составления формулы соли бескислородной кислоты
- Алгоритм составления формулы соли кислородсодержа-щей кислоты
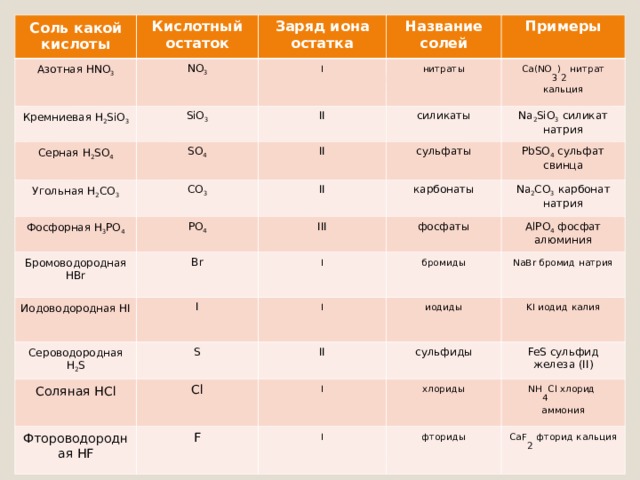
- Названия солей бескислородных кислот
- Названия солей кислородсодержащих кислот
- Номенклатура солей
- Физические свойства

Состав солей
NaCl , BaO , HCl , NaOH , Na 3 PO 4 .
1.Соли –это сложные или простые вещества?
2.Проанализируйте состав солей.
3.Сформулируйте определение данного класса
соединений.

Что такое соли?
Соли – это сложные вещества, состоящие
из ионов металлов и кислотных остатков.
Соли образуются при замещении атомов
водорода в кислоте на ионы металлов.
Например:
HCl Na Cl HNO 3 NaNO 3
H 2 S Na 2 S H 2 SO 4 Na 2 SO 4
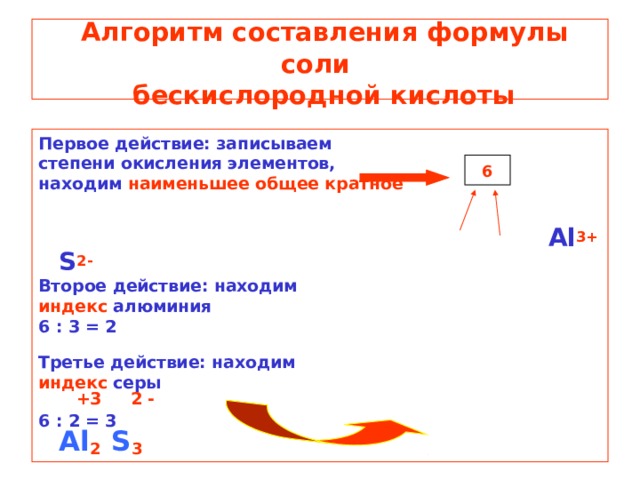
Алгоритм составления формулы соли бескислородной кислоты
Первое действие: записываем
степени окисления элементов,
находим наименьшее общее кратное
Al 3+ S 2-
Второе действие: находим
индекс алюминия
6 : 3 = 2
Третье действие: находим
индекс серы +3 2 -
6 : 2 = 3 Al 2 S 3
6
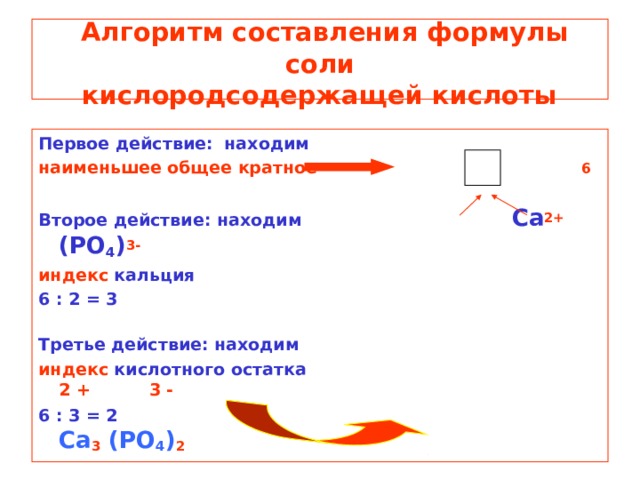
Алгоритм составления формулы соли кислородсодержащей кислоты
Первое действие: находим
наименьшее общее кратное 6
Второе действие: находим Ca 2+ (PO 4 ) 3-
индекс кальция
6 : 2 = 3
Третье действие: находим
индекс кислотного остатка 2 + 3 -
6 : 3 = 2 Ca 3 (PO 4 ) 2

Названия солей бескислородных кислот
Составление названия солей, образованных от бескислородных кислот:
- называем электроотрицательную часть соединения – неметалл , его латинское название с суффиксом – ид
(в именительном падеже);
- называем электроположительную часть – металл
(в родительном падеже).
NaCl – хлор ид натрия
Al 2 S 3 – сульф ид алюминия
FeBr 2 – бром ид железа ( II )
FeBr 3 – бром ид железа ( III )

Названия солей кислородсодержащих кислот
Составление названия солей, образованных от кислородсодержащих кислот:
- называем электроотрицательную часть соединения –
ион кислотного остатка (в именительном падеже);
ион кислотного остатка- латинское название с суффиксами:
-ат для высшей степени окисления;
-ит для низшей степени окисления.;
- называем электроположительную часть – металл
(в родительном падеже).
Na 2 SO 4 – сульф ат натрия
Na 2 SO 3 - сульф ит натрия
Fe (NO 2 ) 2 – нитр ит железа ( II )
Fe (NO 3 ) 3 – нитр ат железа ( III )

Номенклатура солей
- F – фторид
- Cl – хлорид
- Br – бромид
- I – йодид
- S 2- сульфид
- SO 3 2- сульфит
- SO 4 2- сульфат
- CO 3 2- карбонат
- SiO 3 2- силикат
- NO 3 – нитрат
- NO 2 – нитрит
- PO 4 3- ортофосфат
- PO 3 – метафосфат
- ClO 4 – хлорат
Na F Фтор ид натрия
Na Cl Хлор ид натрия
Na Br Бром ид натрия
Na I Иод ид натрия
Na 2 S Сульф ид натрия
Na 2 SO 3 Сульф ит натрия
Na 2 SO 4 Сульф ат натрия
Na 2 CO 3 Карбон ат натрия
Na 2 SiO 3 Силик ат натрия
Na NO 3 Нитр ат натрия
Na NO 2 Нитр ит натрия
Na 3 PO 4 Орто фосф ат натрия
Na PO 3 Мета фосф ат натрия
NaClO 4 Хлор ат натрия

Номенклатура солей
- F – фторид SiO 3 2- силикат Cl – хлорид
- Br – бромид
- I – йодид
- S 2- сульфид
- SO 3 2- сульфит
- SO 4 2- сульфат
- CO 3 2- карбонат
- NO 3 – нитрат
- NO 2 – нитрит
- PO 4 3- ортофосфат

Типы солей
- Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример.
- Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример.
- Осно́вные соли — гидроксогруппы основания (OH - ) частично замещены кислотными остатками. Пример.
- Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример.
- Смешанные соли — в их составе присутствует два различных аниона. Пример.
- Гидратные соли (кристаллогидраты ) — в их состав входят молекулы кристаллизационной воды. Пример.
- Комплексные соли — в их состав входит комплексный катион или комплексный анион.
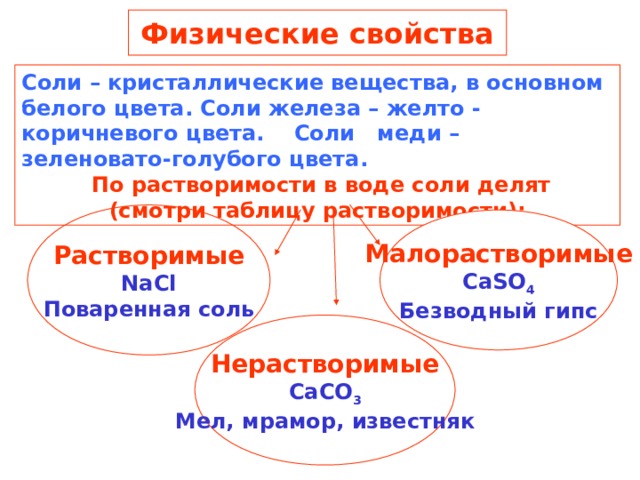
Физические свойства
Соли – кристаллические вещества, в основном белого цвета. Соли железа – желто - коричневого цвета. Соли меди – зеленовато-голубого цвета.
По растворимости в воде соли делят
(смотри таблицу растворимости):
Растворимые
NaCl
Поваренная соль
Малорастворимые
CaSO 4
Безводный гипс
Нерастворимые
CaCO 3
Мел, мрамор, известняк

Применение солей
- Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды. Хлорид калия используют в сельском хозяйстве как калийное удобрение.

Применение солей
- Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.

Применение солей
- Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.

Применение солей
- Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия (соду) применяют в производстве стекла и при варке мыла. Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.