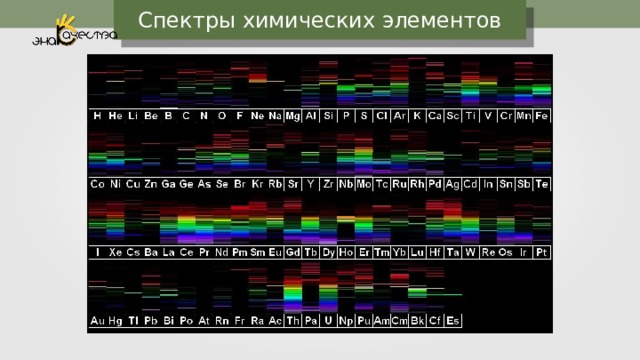
Спектры химических элементов

Датский физик.
Основатель квантовой механики.
Нильс Бор
1885–1962 гг.

Что нам известно о строении атома вещества?

Опыт, благодаря которому была предложена планетарная модель строения атома.
Эрнест Резерфорд
1871–1937 гг.
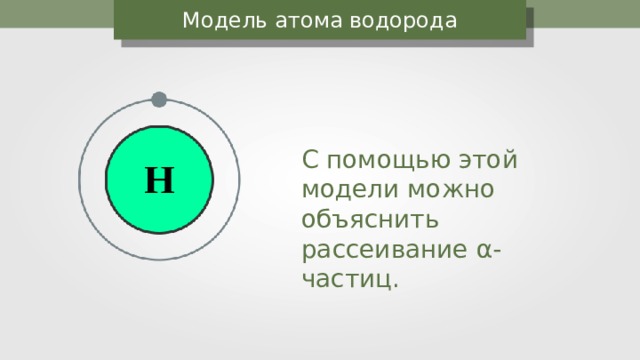
Модель атома водорода
С помощью этой модели можно объяснить рассеивание α -частиц.

Почему спектр атома водорода линейчатый?

Предложил теорию, согласно которой атомы могут находиться как в основном (невозбуждённом) состоянии, так и в возбуждённом состоянии.
Нильс Бор
1885–1962 гг.
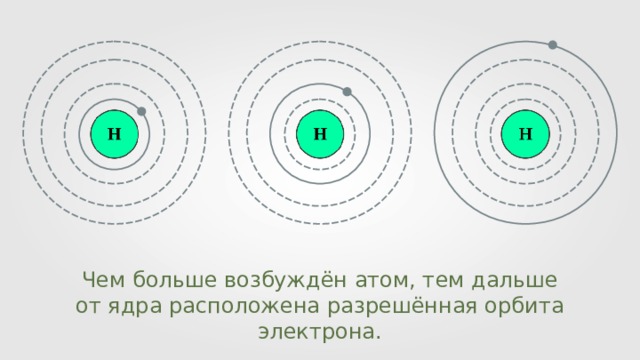
Чем больше возбуждён атом, тем дальше от ядра расположена разрешённая орбита электрона.

Первый постулат Бора
Атом может длительно пребывать только в особых стационарных состояниях, каждому из которых соответствует определённое значение энергии. В стационарном состоянии атом не излучает и не поглощает электромагнитные волны.
k
n
n, k и т.д. — номера орбит

Второй постулат Бора
h ν = E k – E n
Излучение света происходит лишь при переходе атома из стационарного состояния с большей энергией Е k
в стационарное состояние с меньшей энергией Е n .
E k – E n
где
— разность энергий стационарных состояний
h ν
— порция энергии, которая выделяется при переходе электрона с более высокой орбиты стационарного состояния на более низкую

Говорил, что если вы поняли, что значит квантовый скачок, то вы думали об этом не достаточно.
E k
E n
Нильс Бор
1885–1962 гг.
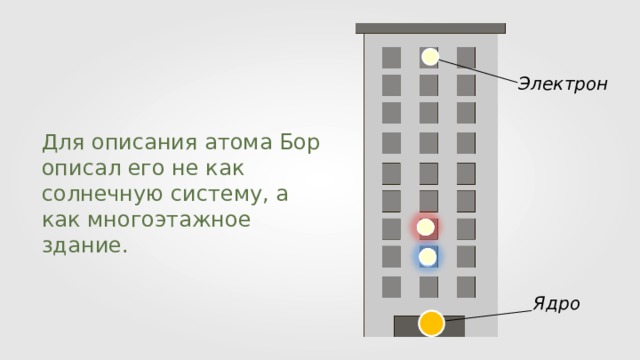
Электрон
Для описания атома Бор описал его не как солнечную систему, а как многоэтажное здание.
Ядро
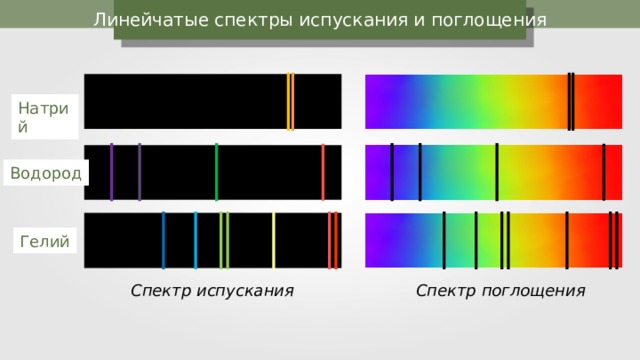
Линейчатые спектры испускания и поглощения
Натрий
Водород
Гелий
Спектр испускания
Спектр поглощения

На основании теории Бора оказалось возможным построить количественную теорию спектра водорода.
Нильс Бор
1885–1962 гг.

Лазеры












































