
ОКСИГЕН, СУЛЬФУР ТА ЇХ СПОЛУКИ.
ОДЕСЬКИЙ АВТОМОБІЛЬНО – ДОРОЖНИЙ КОЛЕДЖ
Автор А.А.ЗАЛЕВСЬКА

O Оксиген
На нашій планеті більш за все кисню,
необхідного для дихання всіх живих організмів.
Він складається з атомів Оксигену.

АЛОТРОПНІ МОДИФІКАЦІЇ ОКСИГЕНУ
Оксиген може утворювати дві прості речовини – кисень О 2 та озон О 3 .
Це - алотропні модифікації, або видозміни Оксигену.

ПОШИРЕННЯ У ПРИРОДІ

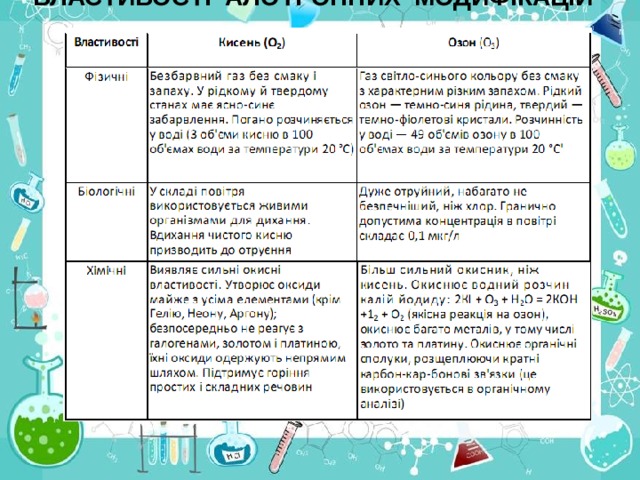
ВЛАСТИВОСТІ АЛОТРОПНИХ МОДИФІКАЦІЙ

Одержання алотропних модифікацій Оксигену.
Кисень утворюється в результаті розкладання:
• деяких солей: 2КМ n О 4 = К 2 МnO 4 +МnО 2 +О 2 ↑
• пероксидів: 2Н 2 О 2 =2Н 2 О+О 2 ↑
• оксидів важких металів
Озон утворюється із звичайного кисню під дією електричного розряду (розряд блискавки, робота
електротрансформаторів) або ультрафіолетового
випромінювання (сонячне світло, робота ксерокса), О 2 +О ↔ О 3
а також у процесах, що супроводжуються виділенням атомарного кисню (розклад пероксидів).

Характеристика елементу Оксигену
Порядковий номер — 8.
Відносна атомна маса — 16.
+8, 8е, 8р, 8 n
розташований в 2-му періоді, VI групі ПСХЕ ﴿ ﴿
2 6
Електронна конфігурація атома Оксигену:
1 S 2 2 S 2 2 Р 4
В атомі Оксигену два неспарені електрони, отже, він двовалентний. В Оксигену висока електронега тивність, тому у сполуках для нього характерний ступінь окиснення -2 , окрім сполук із Флуором (ступінь окиснення +1 і +2 ) і пероксидів (ступінь окиснення -1 ).

ХІМІЧНІ ВЛАСТИВОСТІ КИСНЮ:
Кисень - силь ний окисник.
1) Взаємодія з металами: 2Ва+ О 2 =2ВаО
2) Взаємодія з неметалами: 4Р + 5О 2 =2Р 2 О 5
3) Горіння складних речовин: СН 4 +2О 2 =СО 2 + 2Н 2 О
- Окиснення складних речовин (цей процес не відноситься до горіння):
4 F е(ОН) 2 +О 2 +2Н 2 О = 4Fе(ОН) 3
+б

АЛОТРОПНІ МОДИФІКАЦІЇ СУЛЬФУРУ

Характеристика елементу Сульфуру
Порядковий номер — 16. Відносна атомна маса — 32.
+16, 16е, 16р, 16 n
Сульфур розташований в 3 періоді, VI групі ПСХЕ ﴿ ﴿ ﴿
2 8 6
Електронна конфігурація атома Сульфуру:
1S 2 2S 2 2р 6 3S 2 3р 4
З урахуванням можливості переходу електронів з S- та Р-підрівнів на вільний d - підрівень для Сульфуру у сполуках характерні ступені окиснення -2, +4, +6, рідше
+2.

ХІМІЧНІ ВЛАСТИВОСТІ СІРКИ:
1) При взаємодії з неметалами сірка виявляє окисні і відновлювальні властивості.
• Із простими речовинами, утвореними більш електронегативними елементами (Оксигеном, Флуором, Хлором, Бромом), сірка виступає в ролі відновника:
S + О 2 =SО 2 ↑ — сульфур(І V ) оксид
• Із простими речовинами, утвореними менш електронегативними елементами, сірка виступає в ролі окисника:
С + 2 S = СS 2 — карбон( VI ) сульфід

Бінарні сполуки сірки, у яких вона виявляє ступінь окиснення -2, називають сульфідами.
1)Н 2 + S = Н 2 S↑ — гідроген сульфід (сірководень)
2) Взаємодія з металами.
2Zn + S = 2ZnS — цинк сульфід
Fе + S = FеS — ферум(ІІ) сульфід
Усі сульфіди, крім НgS, утворюються при нагріванні.
Із ртуттю сірка взаємодіє вже при кімнатній температурі: Нg+S = НgS — меркурій( II ) сульфід
Ця властивість використовується для видалення розлитої ртуті, випаровування якої дуже токсичні.

Застосування кисню і сірки.
Кисень використовується для інтенсифікації процесів горіння (наприклад, при виплавці сталі), підвищення температури горіння (при зварюванні), як окисник в інших реакціях, у медицині (киснева подушка).
Озон має дезинфікуючу та відбілюючу дію. Головне застосування озону — знезаражування водопровідної води.
Сірка застосовується для одержання сульфатної кислоти, вулканізації каучуку, боротьби із сільськогосподарськими шкідниками, одержання сірників, пороху. У медицині виготовляють сірчані мазі для лікування шкірних хвороб.

СПОЛУКИ СУЛЬФУРУ ТА ОКСИГЕНУ
Сульфур(ІV) оксид SО 2 - (сірчистий газ, сірчистий ангідрид, сульфур діоксид) — безбарвний газ із різким запахом, скраплюється при -10 °С . Негорючий, легко розчиняється у воді. Водний розчин SО 2 називають сульфідною кислотою - Н 2 SО 3.
Сульфур(VІ) оксид SО 3
- ( сульфур три оксид)
У температурному інтервалі від 400 до 700 °С розкладається на сульфур(ІV) оксид і к исень: 2 S О 3 →2SО 2 ↑+О 2 ↑
Як типовий кислотний оксид, взаємодіє: • з оксидами, утвореними металами: СаО + SО 3 =СаSО 4
• з основами: Bа(ОH) 2 + SО 3 =BаSО 4 ↓+Н 2 О
• з водою утворює відповідну кислоту: SО 3 +Н 2 О= Н 2 SО 4
Застосування сульфур(VІ) оксиду.
Сульфур(VІ) оксид застосовується в основному у виробництві сульфатної кислоти; у лабораторії як водовід'ємний засіб.

Сульфатна кислота. Сульфати. Якісна реакція на сульфат-йон
Фізичні властивості сульфатної кислоти.
Сульфатна кислота Н 2 SО 4 — важка безбарвна масляниста рідина (стара назва сульфатної кислоти — купоросна олія). При звичайній температурі вона не летюча і не має запаху. Безводна сульфатна кислота не проводить електричний струм. Дуже гігроскопічна. Поглинає вологу з виділенням великої кількості теплоти, тому до концентрованої кислоти не можна доливати воду — відбудеться розбризкування кислоти.
Сульфатну кислоту потрібно доливати невеликими порціями до води.
Сульфатна кислота — їдка рідина: при потраплянні на шкіру чи одяг її необхідно змити великою кількістю води і нейтралізувати розчином соди.

Хімічні властивості розведеної сульфатної кислоти.
Сульфатна кислота як двоосновна кислота утворює два ряди солей: кислі — гідрогенсульфати (утворюються при надлишку кислоти) і середні — сульфати.
1) Ступенева дисоціація:
Н 2 SО 4 = H + +НSО 4 - ; 2НSО 4 - = 2H + +SО4 2-
2) Взаємодія з розчинними і нерозчинними основами (реакція нейтралізації). При цьому утворюються гідрогенсульфати :
NaОН + Н 2 SО 4 = NаНSО 4 + Н 2 О натрій гідро ген сульфат
або сульфати :
2NаОН + Н 2 SО 4 = Nа 2 SО 4 +2Н 2 О натрій сульфат

3) Взаємодія з металами, що знаходяться в електрохімічному ряді напруг до водню:
Н 2 S О 4 + Zn= ZnSО 4 + Н 2 ↑
4) Взаємодія з оксидами металів:
СаО + Н 2 SО 4 = СаSО 4 + Н 2 О
5) Взаємодія із солями, утвореними більш слабкими або летючими кислотами:
СаСО 3 + Н 2 SО 4 = СаSО 4 + Н 2 О + СО 2 ↑
Якісною реакцією на сульфат-йон SО 4 2- є іони барію Ва 2+
Ва 2 + + SО 4 2- →Ва SО 4 ↓
Утворюється білий осад барій сульфату.

Хімічні властивості концентрованої сульфатної
кислоти.
1) Взаємодія з металами. Концентрована сульфатна кислота при нагріванні реагує з багатьма металами, у тому числі тими, що стоять в електрохімічному ряді напруг після водн я. При цьому виділяється не водень, а сульфур(VІ) оксид (з менш активними металами), сірка (з металами середньої активності) або сірководень (з активними металами):
Сu + 2Н 2 S О 4 = СuSО 4 + SО 2 ↑ + 2Н 2 О
4Н 2 SО 4 (конц) + 3Zn = 3ZnSО 4 + S + 4Н 2 О
5Н 2 SО 4 + 4Са = 4СаSО 4 + Н 2 S ↑ +4Н 2 О

Алюміній, залізо і хром пасивуються концентрованою сульфатною кислотою на холоді, при нагріванні реагують з нею.
- Безводна сульфатна кислота розчиняє до 70 % сульфур( V І) оксиду, при цьому утворюється олеум.
- При нагріванні відщеплює сульфур( V І) оксид сірки доти, поки не утвориться розчин з масовою часткою сульфатної кислоти 98,3%: Н 2 S О 4 =Н 2 О + S О 3
- Обвуглює органічні речовини — цукор, папір, дерево.
- Як сильна , нелетка кислота, витискує інші кислоти з їхніх сухих солей

Одержання сульфатної кислоти. Найбільше значення має контактний спосіб одержання сульфатної кислоти. Процес складається з трьох стадій.
1) Одержання сульфур(ІV) оксиду. Сировиною є сульфурвмісні руди, сірка, сірководень:
4 F еS 2 +11O 2 =2Fе 2 О 3 +8SО 2
S + О 2 =SО 2 ; 2Н 2 S + ЗО 2 =2SО 2 +2Н 2 О
2) Окиснення сульфур(ІV) оксиду в сульфур(VІ) оксид: 2SО 2 + О 2 = 2SО 3 (реакція йде під тиском, при підвищеній температурі й у присутності каталізаторів).
3) Одержання сульфатної кислоти. При цьому сульфур( V І) оксид поглинають розведеною сульфатною кислотою, одержуючи олеум, який потім розбавляють до потрібної концентрації:
SО 3 + Н 2 SО 4 = Н 2 S 2 О 7





































