
Химическая связь.
Виды химической связи
Подготовила :
Трубникова Елена Евгеньевна
учитель химии и биологии
МБОУ «Клюквинская средняя общеобразовательная школа»
Курского района Курской области

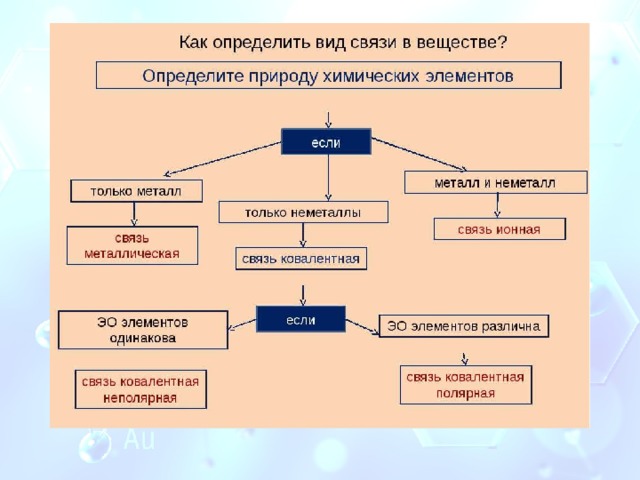
Что такое химическая связь?
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами.
При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа.

Причины образования химической связи:
Неустойчивость атомов с незавершённым внешним уровнем и стремление к его заполнению.
Стремление к минимуму энергии.
По современным данным химическая связь определяется взаимодействием положительно заряженных ядер и отрицательно заряженных электронов.
Значит, природа химической связи электростатическая.

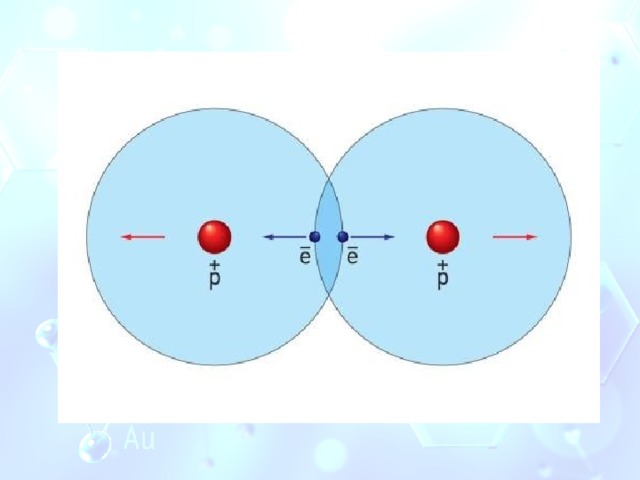
В свободном атоме электроны притягиваются только к ядру собственного атома.
Когда два атома приближаются друг к другу, между их ядрами и электронами начинают действовать силы отталкивания.
Но появляются также силы притяжения между ядром одного атома и электронами другого.
Силы отталкивания уравновешиваются силами притяжения и атомы удерживаются вместе. Так возникает химическая связь.

Что такое электроотрицательность?
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях, называется электроотрицательностью (ЭО).
Значения электроотрицательности элементов позволяют определить:
- заряды атомов в соединении;
- сдвиг электронов при образовании химической связи.

Изменение электроотрицательности в Периодической системе
С увеличением порядкового номера элементов ЭО изменяется периодически.
В периоде она растёт слева направо при накоплении электронов на внешнем слое.
В группе она убывает сверху вниз при увеличении числа электронных слоёв и увеличении атомных радиусов.
Наибольшей ЭО в каждом периоде обладают самые маленькие атомы с семью внешними электронами — атомы галогенов (инертные газы соединений не образуют).
Наименьшая ЭО в периоде у самого большого атома с одним внешним электроном — атома щелочного металла.


Ионная связь
Ионная связь — связь между положительно и отрицательно заряженными ионами.
Ионы — заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов

Механизм образования ионной связи
(на примере хлорида натрия NaCl)

Обрати внимание!
Соли аммония не содержат металла, но образованы ионной связью.
Свойства веществ с ионной связью
Притяжение между ионами достаточно сильное, поэтому ионные вещества имеют высокие температуры кипения и плавления.
Все ионные соединения при обычных условиях твёрдые вещества.

Ковалентная связь
Ковалентная связь — это связь между атомами неметаллов, образованная за счёт общих электронных пар.
Ковалентная связь образуется при взаимодействии неметаллов. Атомы неметаллов имеют высокую электроотрицательность и стремятся заполнить внешний электронный слой за счёт чужих электронов. Два таких атома могут перейти в устойчивое состояние, если объединят свои электроны.
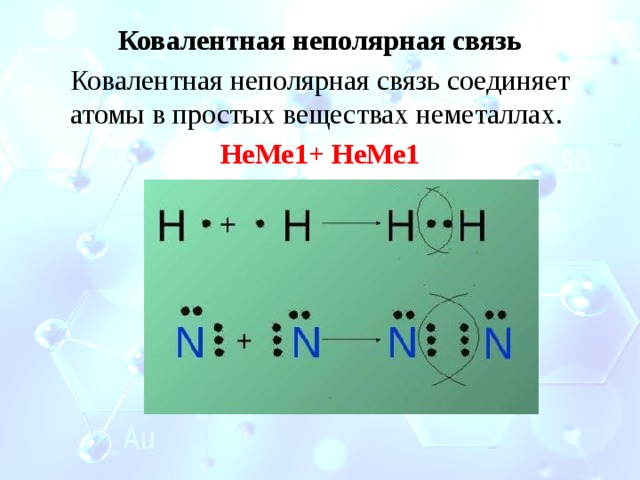
Ковалентная неполярная связь
Ковалентная неполярная связь соединяет атомы в простых веществах неметаллах.
НеМе1+ НеМе1

Образование молекулы водорода
Каждый атом водорода имеет один электрон. Для перехода в устойчивое состояние ему необходим ещё один электрон.
При сближении двух атомов электронные облака перекрываются. Образуется общая электронная пара, которая связывает атомы водорода в молекулу.
В пространстве между двумя ядрами общие электроны бывают чаще, чем в других местах. Там формируется область с повышенной электронной плотностью и отрицательным зарядом. Положительно заряженные ядра притягиваются к ней и образуется молекула.
При этом каждый атом получает завершённый двухэлектронный внешний уровень и переходит в устойчивое состояние.

Ковалентная связь за счёт образования одной общей электронной пары называется одинарной .
Общие электронные пары (ковалентные связи) образуются за счёт неспаренных электронов, расположенных на внешних энергетических уровнях взаимодействующих атомов.
У водорода один неспаренный электрон. Для других элементов их число равно 8 - № группы .
Неметаллы VIIА группы (галогены) имеют на внешнем слое один неспаренный электрон.
У неметаллов VIА группы (кислород, сера) таких электронов два .
У неметаллов VА группы (азот, фосфор) три неспаренных электрона.

Образование ковалентных связей показывают структурные (графические) формулы, в которых общая электронная пара обозначается чертой. Одна черта между атомами обозначает одинарную связь, две черты — двойную, три черты — тройную
Н-Н, Cl-Cl , O=О, N ≡ N
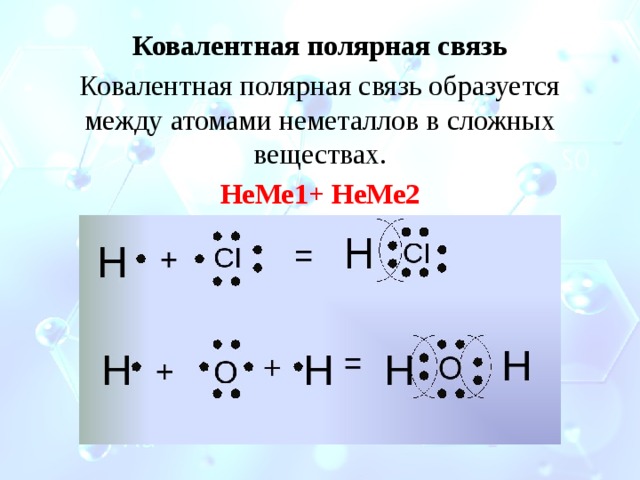
Ковалентная полярная связь
Ковалентная полярная связь образуется между атомами неметаллов в сложных веществах.
НеМе1+ НеМе2

Если ковалентная связь образуется между разными атомами, то общая электронная пара смещается к тому из них, который имеет более высокую электроотрицательность (ЭО). Он получает частичный отрицательный заряд. Атом, имеющий меньшую ЭО, становится заряжённым положительно. В этом случае образуется полярная ковалентная связь.

Образование молекулы хлороводорода
У атома водорода на внешнем уровне один электрон. У хлора на внешнем уровне семь электронов, один из которых неспаренный.
Образуется одна общая электронная пара, которая смещена к атому хлора. В результате
появляются частичные заряды: на атоме хлора отрицательный а на атоме водорода — положительный.
Сдвиг электронной плотности принято обозначать греческой буквой дэльта δ
Структурная формула хлороводорода H−Cl.
Подобным образом соединяются атомы в молекулах других галогеноводородов

Характеристики ковалентной связи
Важнейшими характеристиками ковалентной связи являются длина, полярность и прочность . Эти характеристики определяют физические и химические свойства вещества: их температуры плавления и кипения, растворимость, химическая активность.

Длина ковалентной связи — это расстояние между ядрами связанных атомов.
Длина химической связи зависит от радиусов атомов: чем больше радиусы атомов, тем длиннее связь между ними.
Кратность связи тоже влияет на её длину.
Чем больше общих электронных пар у атомов, тем короче связь.

Прочность ковалентной связи — устойчивость общей электронной пары к разрыву .
Прочность связи определяет химическую активность вещества: чем меньше прочность связи, тем легче вещество вступает в химические реакции.
Прочность связи зависит от её длины и кратности.
Чем меньше длина связи, тем она прочнее.
Чем больше кратность связи, тем выше её прочность.

Полярность ковалентной связи — значения частичных зарядов на связанных атомах.
Полярность ковалентной связи зависит от разности электроотрицательностей этих атомов.
Чем сильнее отличаются атомы по электроотрицательности, тем больше полярность связи.

Металлическая связь
Металлическая связь — это связь между положительными ионами и атомами металлов посредством обобществлённых электронов.

Особенность атомов металлов — небольшое число электронов на внешнем уровне и сравнительно большие радиусы . Поэтому атомы металлов в отличие от атомов неметаллов легко отдают наружные электроны и превращаются в положительные ионы:
Оторвавшиеся от атомов электроны перемещаются от одного иона к другому. Соединяясь с ионами, электроны временно превращают их в атомы
Потом электроны снова отрываются и присоединяются к другим ионам и так далее.
Между электронами и положительными ионами возникает электростатическое взаимодействие. Отрицательные электроны удерживают слои положительных ионов.

Кристалл металла можно представить как большое количество катионов, погруженных в «море» свободных электронов.
Благодаря свободным электронам металлы хорошо проводят тепло и электрический ток, имеют характерный блеск и ковкость.
Металлическая связь характерна для чистых металлов и для смесей различных металлов — сплавов (бронза, сталь, чугун, латунь и т. д.), если они находятся в твёрдом или жидком состоянии.

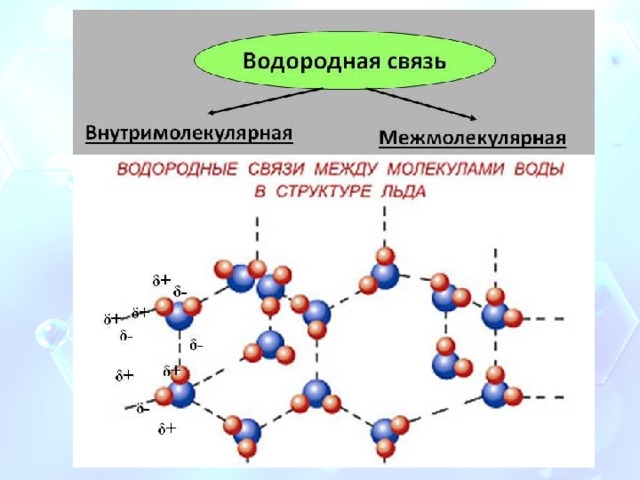
Водородная связь
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F.

Использованные источники
Габриелян О.С. Химия 8 класс. Учебник для общеобразовательных учреждений. М.:Дрофа , 2015. 71с
Жилин Д.М.. Химия. 8 класс.Учебник для общеобразовательных учреждений. М.:Бином . Лаборатория знаний, 2011. 245с.
http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch1_4.html
https://studfiles.net/preview/3617257/
http://www.poznavayka.org/himiya/himicheskaya-svyaz-opredelenie-tipyi-svoystva/
http://chemege.ru/chembonds/
http://www.yaklass.ru/p/himija/89-klass/stroenie-veshchestva-18844/tipy-khimicheskoi-sviazi-18860/re-bd8ad0ba-1fcf-451f-aee2-4f5a32afafc2
https://yandex.ru/images/search?text= механизм%20образования%20металлической%20связи& noreask =1&img_url=https%3A%2F%2Fds02.infourok.ru%2Fuploads%2Fex%2F01f3%2F00013a72-d228d1a7%2F1%2Fimg7.jpg&pos=1&rpt= simage&lr =8















































