

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Преимущества обучения в Великобритании
- Британские сертификаты, дипломы и присуждаемые степени считаются во всём мире лучшими и, безусловно, самыми престижными. Образование, полученное в Англии - надежная основа для любой карьеры и гарантия высокой зарплаты (даже стартовой)!
- Самые современные методы обучения, постоянно модернизируемое оборудование учебных заведений и, главное, профессиональные преподаватели британских школ, колледжей и университетов помогают полностью раскрыть академический и творческий потенциал студентов.
- Качество британского образования признано во всём мире. Британские университеты, частные школы и языковые центры – в «топах» всех образовательных рейтингов. Многие страны мира взяли за основу именно британскую модель образования.
- Знания, полученные на курсах английского языка, лягут в основу вашей будущей карьеры или залогом успешной учёбы в собственной стране. Во всем мире английский язык используется в сфере бизнеса, науки, информационных технологий. Учеба в Великобритании позволит полностью погрузиться в языковую среду, научиться говорить и думать на английском. Метод погружения в языковую среду - самый эффективный и для 8-летнего ребёнка, и для студента вуза, и для тех, кто выбирает курсы «для тех, кому за…»
- Обучение в Великобритании на поверку оказывается не намного дороже обучения в других странах. Британские программы по получению степени бакалавра и магистра длятся всего 3 и 1 год соответственно по сравнению с 4 и 2 годами в большинстве других стран. Таким образом, за счёт интенсивности учёбы, сокращается её срок, а значит, и расходы на обучение и проживание.
Просмотр содержимого документа
«Преимущества обучения в Великобритании»
ХАРАКТЕРИСТИКА И ГЕНЕТИЧЕСКИЙ АНАЛИЗ СИЛЬНО КУСТЯЩЕГОСЯ НИЗКОРОСЛОГО МУТАНТА
РИСА (ORYZA SATIVA L.)
Тезис
DHANANJAY MANI
Представленный Office Исследований Мензурки Техаса A&M университет
в частичном выполнении требований для степени
ВЛАДЕЛЕЦ НАУКИ
Август 2008
Основной предмет: Растениеводство
ХАРАКТЕРИСТИКА И ГЕНЕТИЧЕСКИЙ АНАЛИЗ ОЧЕНЬ ВЫСОКО КУСТЯЩЕГОСЯ И НИЗКОРОСЛОГО МУТАНТА
РИСА (ORYZA SATIVA L.)
Тезис
DHANANJAY MANI
Представленный Office Исследований Мензурки Техаса A&M университет
в частичном выполнении требований для степени
ВЛАДЕЛЕЦ НАУКИ
Одобренный:
Сопредседательствует Комитета, Родэйнта Э. Тэбина
Скотт А. Финлэйсон
Орган Комитета, Уильям Д. Парк
Глава Отдела, Дэвид Д. Бэлтенсперджер
Август 2008
Основной предмет: Растениеводство
РЕЗЮМЕ
Характеристика и Генетический Анализ Очень Высоко Кустистящегося и Низкорослого Мутанта Риса (Oryza sativa L.). (Август 2008)
Dhananjay Mani, B.Sc. (Hons)., Пенджаб Сельскохозяйственный университет, Лудхияна, Индия
Сопредседательствует Совещательного комитета: доктор Родэйнт Э. Тэбин, Доктор Скотт А. Финлэйсон
Это исследование сосредоточилось на том, чтобы охарактеризовать и определить модель наследования признаков очень высокой кустистости и низкорослости у мутантов риса. Чтобы охарактеризовать, новый мутант, полевые фенотипические исследования в тепличных условиях, были проведены на двух мутантных линиях (М. 13662 и М. 13684) на трех уровнях азота (179, 202, 224 - кг/га) и пяти густотах (1, 2, 3, 4, 5 холмов растений 1). Отдельное исследование было выполнено, чтобы определить отзывчивость двух мутантных линий на применение гибберелловой кислоты (GA). Мутанты были 50-55 см высотой и сформировали 89-121 побегов/растение к уборке. Карликовость мутантов должна была составить в среднем укорачивания четырех верхних междоузлий так же как сжатием 2-3 базальных междоузлий. Первый побег появился на стадии 4-го листа, тогда как ни один побег не было отмеченно у полукарликового сорта риса, Cocodrie. Результаты показывают, что формирование большого числа побегов было результатом вывода пазушных почек из состояния покоя, а не заложения дополнительных пазушных почек. Мутанты позднее созревали, чем контроль (Cocodrie & Zhe733). Метелки были очень короткими (10-12 см) и имели 25-30 мелких зерен. Большинство побегов мутантов следовало модели dn-типа низкорослости, основанной на классификации Тэкеды, но у нескольких растений был другой тип низкорослости, не включенный в классификацию. Обе мутантные линии, как выяснилось, были сходные агрономические признаки, но были сильно отличающимися от стандарта. Способность к кущению мутантов была под воздействием пяти различных густот посадки так же и трех уровней азота. Мутанты сформировали больше побегов, и продуктивных и не продуктивных, при низкой густоте растений. Самые длинные и самые короткие метелки наблюдались при 202 кг/га и 179 кг/га, соответственно. Вариация других агрономических признаках была признана не существенной. Отзывчивость мутанта на применение GA был сходна с сортом Cocodrie, и таким образом считался GA отзывчивым. Предварительные данные ДНК, с использованием маркерных генов SSR, подтвердили предположение происхождения мутантов, а генетический анализ указал, что один рецессивный ген контролирует признаки и низкорослости и очень высокого кущения.
Этот тезис посвящен моему дедушке, бабушке, маме, и папе.
ПОДТВЕРЖДЕНИЯ
Я искренне признаю и выражаю оценку многим особям для помощи в завершении этого исследования. Я благодарю доктора Родэйнта Э. Тэбина, Сопредседателя моего комитета, который непрерывно поддерживал научно-исследовательскую работу с добротой и поддержкой. Он всегда поощрял меня и обеспечивал способное руководство, которое подняло мои академические стандарты и стандарты исследования всюду по моей программе MS. Я благодарен, что он предоставил мне такая большая возможность сделать кое-что в научной арене.
Я также благодарю доктора Скотта А. Финлэйсона, cо-советника и доктора Уильяма Д. Парка, орган комитета, для их руководства и поддержки всюду по моей программе MS. Оценка также выражена доктору Шэннону Пинсону и доктору Ли Тарпли, который позволил мне работать в их лаборатории. Я также благодарил бы доктора Омара П.Б. Samonte и Yogesh для того, чтобы помочь мне в статистическом анализе. Я благодарю Арфиста Chersty, Патрика Франка и группу размножения риса для их ценной помощи во время поведения моей работы исследования. Я также благодарю всех своих друзей за их поддержку и помощь во время моей курсовой работы и подготовки к тезису.
Наконец, я выражаю свою оценку для моральной и духовной поддержки, и поддержку от моих родителей, без которых не был бы закончен этот проект.
ОГЛАВЛЕНИЕ
Страница
РЕЗЮМЕ iii
ПОСВЯЩЕНИЕ v
ПОДТВЕРЖДЕНИЯ vi
ОГЛАВЛЕНИЕ vii
СПИСОК ЧИСЕЛ ix
СПИСОК ТАБЛИЦ x
ГЛАВА
Я ВВЕДЕНИЕ 1
Распределение и важность риса 1
Морфология растения риса 5
Корень 5
Соломина 6
Лист 6
II ОБЗОР ЛИТЕРАТУРЫ 7
Формирование побега 7
Кустистость в рисе 7
Отношения между побегами и урожаем 8
Кустистость воздействия факторов и зерновая продуктивность в рисе 9
Азот 9
Густота 11
Срок посева 12
Регуляторы роста 12
2.5 Факторы, затрагивающие высоту растения, густоту метелки и
зерновая продуктивность 13
Азот 13
Густота 14
Регуляторы роста 16
2.6 Описание и классификация различных видов риса
остановите развитие мутантов 16
2.6.1 Мутанты имели отношение с кустистостью 19
ГЛАВА Страница
III МАТЕРИАЛЫ И МЕТОДЫ 22
Источник мутанта 22
Фенотипичная характеристика 23
Разрушительное осуществление выборки, чтобы описать способность к кущению
две очень высоких кустистости и низкорослые линии мутанта риса 24
3.4 Влияние гибберелловой кислоты (GA) на втором листе
удлинение влагалища 25
3.5 Генетический анализ 26
Развитие F1 отбирает 26
Поколение популяции F2 27
Растения для генетического анализа 27
Ответ агрономических признаков мутанта риса к переменным уровням азота и густоты растения в оранжерее обусловливает 28
Статистический анализ 31
IV РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ 32
Фенотипичное описание 32
Ответ очень высокой кустистости и низкорослого риса
мутанты (М. 13662 & М. 13684) к гибберелловой кислоте 49
Генетический анализ 53
Ответ очень высокой кустистости и низкорослых мутантов риса (М. 13662 & М. 13684), Cocodrie и Zhe733
к переменным уровням азота и плотностей популяции 56
V РЕЗЮМЕ И ЗАКЛЮЧЕНИЯ 69
ССЫЛКИ 73
КРАТКАЯ БИОГРАФИЯ 86
СПИСОК ЧИСЕЛ
ФИГУРИРУЙТЕ Страница
1 Схематическая диаграмма происхождения очень высокой кустистости
и низкорослый мутант риса 22
2 Деревянная бадья, используемая в оранжерее, экспериментирует, чтобы держать
горшки затоплены 30
3 Фенотипичные различия между очень высокой кустистостью и карликом
линии мутанта риса и нормальное растение риса 33
Еженедельно прорастите производство выращенных полем очень высоко кустистость и низкорослые мутанты риса (М. 13662 & М. 13684) по сравнению с обычными сортами (Zhe733 & Cocodrie) с полукарликом (sd-1) ген 37
Сравнение длины метелки и число метелки зерен 1 между очень высокой кустистостью и низкорослыми мутантами риса (М. 13662
& М. 13684) и средства управления (Cocodrie & Zhe 733) 40
Появление 1-ого побега на 4-ой стадии листа 44
Сравнение интенсивности производства побега на 6-ой стадии листа Cocodrie и двух очень высоких кустистостей и низкорослых мутантов риса (М. 13662 & М. 13684) 45
Схематическая диаграмма формирования побега в очень высокой кустистости и низкорослых мутантах риса (М. 13662 & М. 13684) 47
Образец удлинения лучших четырех междоузлий в немутантном типе и очень высокой кустистости и низкорослых мутантах риса (М. 13662 & М. 13684) 48
СПИСОК ТАБЛИЦ
ТАБЛИЦА Страница
1 Агрономические признаки линий мутанта и средств управления (Cocodrie
& Zhe 733) в полевых условиях 34
Влияние гибберелловой кислоты (GA) на удлинении второго влагалища листа. Подразумевайте ± SD, n=10 52
Chi-квадратный анализ отношений расщепления популяции F2 произошел от мутанта и скрещивания Cocodrie 55
Квадраты средств ANOVA показ влияний N-уровней, генотипа, плотности популяции и их взаимодействия на числе производительных побегов, числе непроизводительных побегов, числе полных побегов, высоты растения, длины флагового листа, длины метелки, заполнили метелку зерен 1, незаполненная метелка зерен 1, полная метелка зерен 1, растение зерновой продуктивности - и длина выхода метелки 57
Средства агрономических признаков очень высокой кустистости и низкорослых мутантов риса (М. 13662 & М. 13684), Cocodrie и Zhe733 через три уровня азота и пять различной густоты растения 59
Влияния густоты растения, чтобы означать агрономические признаки через
четыре генотипа и три уровня N 64
Работа очень высокой кустистости и низкорослых мутантов риса, Cocodrie и Zhe733 как под влиянием пяти прививающей густоты 65
Работа очень высокой кустистости и низкорослых мутантов риса, Cocodrie и Zhe733 как под влиянием трех уровней азота 68
ГЛАВА I
ВВЕДЕНИЕ
1.1 РАСПРОСТРАНЕНИЕ И ЗНАЧЕНИЕ РИСА: Рис (Oryza sativa L.) один из самых важных основных зерновых пищевых культур Азии, Африки, и Южной Америки, он служит основным источником питания более чем половины мирового населения (Khush, 2005). Это - главный источник 35-60 % диетических калорий, потребляемых больше чем 3 миллиардами человек (Fageria и др., 2003). Его рассматривают, как наиболее распространенную культуру в мире он является, вероятно, самой универсальной культурой. Он выращивается ниже уровня моря в Керале, Индии, на возвышении на больше чем 3000 м. в Гималаях, и на уровне моря в дельтах азиатских рек. Его можно найти с 530 Севера в Северо-восточном Китае до 350 Юга в Новом Южном Уэльсе, Австралия. (Mae, 1997; Santos et al., 2003). Есть два вида культурного риса, Oryza sativa и Oryza glaberrima. Oryza sativa выращивается во всем мире, а Oryza glaberrima выращивается главным образом в Западной Африке. Oryza sativa далее делится на три подвида, основанных на географическом распределении и морфологических признаках: подвид japonica, indica, и javanica (Takahashi, 1984). Подвид japonica и indica главным образом выращивается в умеренных и тропических/субтропических районах, соответственно. Javanica также известен как "тропический подвид японики" (Mae, 1997) обычно выращивается в США. Первые пробные посевы риса в США были предприняты в Вирджинии в 1609, но промышленное возделывание началось в Южной Каролине в 17-ом веке. Сегодня, рис выращивается в шести штатах: Арканзас, Калифорния, Луизиана, Миссиссипи, Миссури, и Техас.
Основываясь на типе зерна, американский рис можно классифицирован на длиннозерный, среднезерный и короткозерный. Длиннозерный рис обычно выращивается в Южных штатах в небольшом количестве в Калифорнии, в то время как среднезерный рис в основном выращивается в Арканзасе, Калифорнии, и Луизиане. Короткозерный рис главным образом выращивают в Калифорнии. В 2007, USDA-ERS сообщил, что 72 % валового сбора риса в Америке было длинннозерным рисом. США - четвертая большая страна экспортирующая рис. Валовой сбор риса, включая длинно-, средне-, и короткозерный составил 197,911 (1000 центнеров) в 2007 (Childs, 2007), Техас внес 4.94 % валового сбора риса. Подобно азиатским странам, посевная площадь всего американского риса уменьшается. Общая площадь посевов риса в США составила 2748 (1000 акров) в 2007, что на 3.17 %, меньше чем в 2006. Только 5.31 % посевных площадей было в Техасе в 2007. Средняя зерновая продуктивность с гектара в Техасе (7499.90 кг/га) занимает пятое место после Калифорнии (9346.90 кг/га), Миссиссипи (8227.50 кг/га), Арканзас (8059.60 кг/га), и Миссури (7611.83 кг/га) согласно обзору 2007, проведенного Economic Research Service, USDA. Из-за экспоненциальной интенсивности прироста населения, считается, что 40%-ое увеличение урожайности риса необходимо к 2030, чтобы удовлетворить растущие потребности, не затрагивая ресурсную базу (Khush, 2005). Сельскохозяйственные угодья для производства продуктов ежегодно уменьшаются из-за роста городов и деградации земли, следовательно, производство риса необходимо увеличить с имеющегося или еще меньшего количества земли. Новые высокоурожайные сорта риса, ультрасовременные методы культивирования риса и технологии должен быть разработаны, чтобы удовлетворить увеличивающуюся потребность в рисе, чтобы накормить весь мир. Сегодняшняя ситуация подобна условиям, в которых начиналась 'Зеленая Революция' в конце 1960-ых, которая накормила растущее народонаселение, посевом полукарликовых, отзывчивых на азот, и иммунных сортов пшеницы и риса (Peng и др., 1999).
Кустистость, высота растения и морфология метелки - очень важные агрономические признаки, которые определяют зерновую продуктивность риса. Общее количество побегов включает и продуктивные и не продуктивные побеги. Число продуктивных побегов определяет число метелок, которое, в конечном счете, влияет урожайность и общую продуктивность культуры. Высота растения главным образом определяется структурой удлинения междоузлий и метелки, а это зависит от сорта и окружающей среды. Рис, как большинство злаковых растений, удлиняет междоузлия в определенной стадии развития. Верхние междоузлия начинают последовательное удлинение, в то время как остальная часть нижних междоузлий остается не удлиненной во время формирования метелки у скороспелых сортов риса, но у позднеспелых сортов, удлинение междоузлий предшествует формированию метелки. Поэтому, исследование взаимоотношений между удлинением междоузлия и числом междоузлий необходимо в каждом из сортов (Takeda, 1977). Гены низкорослости играют очень важную роль в уменьшении длины междоузлия и/или числа удлиненных междоузлий, что влияет на продуктивность культуры. Введением гена полукарликовости в пшеницу и рис началась Зеленая Революция (Peng и др., 1999).
Различные виды мутантов риса были идентифицированы и включены в селекционные программы риса как источники генплазмы, а новые были введены как ресурсы для новых генных открытий, такие как tos 17, группа мутанта T-ДНК (Hirochika и др., 2004). Вообще, сокращение длины соломины приводит к сокращению длины метелки у зерновых культур, но у риса длина метелки сильнее коррелирует с верхними междоузлиями, чем с нижними. Снижение удлинения третьего и четвертого междоузлия от вершины имело очень слабое влияние на уменьшение длины метелки (Takeda, 1975; Takeda, 1977). Много низкорослых мутантов риса имели плейотропные фенотипы, такие как мелкие метелки, мелкие зерна, обилие побегов и деформированная форма листа. Эти высоко кустящиеся низкорослые мутанты риса, хотя идентифицировано давным-давно, как правило, полностью не охарактеризованы из-за их плохого габитуса, некоторых недостатков, и отсутствия экономической значимости. Ранее низкорослые мутанты, и нормальные сорта риса классифицировались на шесть групп (N, dn-, dm-, d6-, nl - и sh тип) основываясь на структуре удлинения четырех верхних междоузлий (Takahashi и Takeda, 1969; Takeda, 1977). С 1980-ых много различных видов мутантов риса были идентифицированы и охарактеризованы, чтобы установить взаимоотношения между генами, ответственными за такую специфическую морфологию и фенотип (Itoh и др., 2005). Поэтому, идентификация и характеристика различных видов мутантов будет полезна в определении функции генов полностью секвенированного генома риса.
Высоко кустящийся низкорослый мутант риса был недавно выделен в расщепляющейся популяции, выращенной в Бомонте, Техас. Этот мутант низкорослый и имеет колоссальную способность формировать очень большое число продуктивных побегов. Высокое число продуктивных побегов и высота растения - два важных агрономических признака у некоторых зерновых культур, а взаимодействие между высокой кустистостью и высотой полностью не изучено (Zou и др., 2005). Поэтому, данный мутант может быть полезным генотипом в понимании генетики этих признаков и их взаимоотношения друг с другом. Следовательно, это исследование, нацеленное на фенотипическую характеристику мутанта, определение реакции мутанта на различные уровни азота, плотность популяции, регуляторы роста, и изучение характера наследования наблюдаемых фенотипов.
1.2 МОРФОЛОГИЯ РАСТЕНИЯ РИСА: Растение риса, Oryza sativa, принадлежит семейству злаковых. Рост растения риса главным образом подразделяется на три различных стадии: вегетативную, репродуктивную, и налива зерна или фаза созревания (Counce и др., 2000). Прорастание, всходы, формирование листа, укоренение всходов и формирование побега происходят в вегетативной стадии жизненного цикла растения. Репродуктивная стадия включает удлинение соломины, появление флаговых листьев, трубкование, выметывание, и цветение. Фаза созревания риса определяется как налив зерна или отвердевание зерен. Зерно содержит самое низкое количество влаги в фазе созревания. Все растение риса разделено на три вегетативных части: корень, соломина и лист.
1.2.1 Корень: корень всходов риса включает зародышевый корешок (первичный корешок), мезокотиль, и нодальный корень. Колеориза, покрывает зародышевый корешок, появляется первой из семени во время аэробного прорастания семян. Если семена прорастают в анаэробных условиях (в воде), колеоптиле, покрывает молодой побег, появляется сразу после появления колеоризы. Корневая система риса в основном состоит из придаточных корней (Yoshida, 1981). Корень или почва играют важную роль в формировании корневых волосков, которые отвечают за поглощение воды и питательных веществ. Корневая система горного или аэробного риса больше, более мощная, и имеет больше корневых волосков по сравнению с анаэробным затопляемым или орошаемым рисом. Рост корня до максимальной длины был посчитан, используя квадратную функцию с продвижением возраста растения с 19 до 120 дней после посева (Fageria, 2007).
Соломина: Мезокотиль - структура, которая помогает колеоптилю достичь поверхности почвы. Соломина является цилиндрической и полой кроме узлов. Узел или междоузлие имеет лист и одну почку.
Лист: Морфология листа, а именно длина, ширина, эректоидность, толщина, и крутизна, является очень важными характеристиками в определении продуктивности сорта. Эректоидные листья позволяют более равномерно распределять свет в сомкнутом листовом пологе, увеличивая фотосинтетическую эффективность растений. Нормальный лист риса состоит из листового влагалища, ушек и пластинки листа. У первого листа нет пластинки листа, но второй лист - настоящий лист с листовой пластинкой и листовым влагалищем. Оставщиеся листья растения риса нормальны, кроме флагового листа, который является самым верхним, или последним листом, сформировавшимся на главном стебле. Флаговый лист поставляет фотосинтетические продукты развивающимся метелкам. Воротник - структура, которая соединяет листовую пластинку и влагалище листа. Лист имеет параллельное жилкование. Ушки – ухо подобные структуры в основании пластинки, в то время как лигула - придаток листа, который находится в месте соединения листового влагалища и листовой пластинки. Активные почки в листовых влагалищах формируют побеги. Первичные побеги появляются на материнском побеге (главный стебель) и могут сформировать вторичные побеги, которые позже дают третичные побеги. Первичные побеги формируются поочередно на главном стебле
ГЛАВА II
ОБЗОР ЛИТЕРАТУРЫ
ФОРМИРОВАНИЕ ПОБЕГА: Архитектура растения главным образом характеризуется числом побегов, углом побега, высотой растения, и морфологией метелки (Wang и Li, 2005). У меристемы конуса нарастания (МКН) есть очень важная роль в формировании пазушных побегов. Она - источник листьев и побегов (Li, 1979; Wang и Li, 2005). Побеги появляются из пазушных меристем, которые находятся в листовых влагалищах растения. Образование побега зависит от инициирования пазушных меристем в листовом влагалище листа, и также от её последующей деятельности (Wang и Li, 2005). Конус нарастания сильно изменяется по размеру и форме. Форма, зависит от вида и генетического состава различных растений, может быть удлиненной, конической, в форме купола, плоской или даже немного вогнутой. МКН состоит из большого числа плюрипотентных исходных клеток, которые имеют различные функции. В МКН есть три различных зоны: центральная зона, периферийная зона, и зона ребра. Центральную зону рассматривают как источник недифференцированных исходных клеток, где наблюдается медленное деление клетки. Периферийная зона окружает центральную зону, в ней деление клетки происходит относительно быстрее, чем в центральной зоне. В третьей зоне, зоне ребра, интенсивность деления клетки подобна периферийной зоне. Листья, возникшие из периферийной зоны и зоны ребра, отвечают за формирование стеблей (Bowman и Eshed, 2000).
КУСТИСТОСТЬ РИСА: Ветви риса известны как побеги. Побеговые почки - пазушные почки, которые формируются в листовых влагалищах и формируют побеги после дифференцирования пазушных почек. Материнский стебель - источник питательных веществ для побеговых почек во влагалище листа, но после стадии третьего листа побеги начинают самостоятельно фотосинтезировать и способ их питания изменяется на автотрофный с гетеротрофного (Hanada, 1995). Обычно, кущение начинается спустя 15 - 20 дней после прорастания (стадия 4-х или 5-ти листьев) при благоприятных условиях, но формирование побегов тесно связано с числом листьев. Во время фазы кущения интенсивность синтеза белка была выше по сравнению с синтезом крахмала, лигнина, и клетчатки (Hayashi, 1995). Способность к кущению риса подвергнута влиянию окружающих условий, таким как свет, температура, густота растения, и питательные элементы (Wu и др., 1998). Хотя на кущение и влияют факторы внешней среды, число побегов отдельных сорта риса главным образом определяется их генетическим составом (Wang и Li, 2005).
2.3 ОТНОШЕНИЯ МЕЖДУ ПОБЕГАМИ И ПРОДУКТИВНОСТЬЮ: Кустистость - очень важный агрономический признак из-за процесса компенсации при биотических и абиотических стрессах. Больше чем 75 % всей массы были представлены побегами сильно кустящегося сорта (Teqing) при низкой стояния растения, по сравнению с 71 % и 69 % для умеренно кустящихся сортов, Gulfmont и Rosemont, соответственно (Wu и др., 1998). Fageria (2007) также сообщил, что высоко кустящиеся сорта были лучше чем низко кустящиеся сорта, особенно при низкой густоте стояния растения и неблагоприятных внешних условиях, потому что высоко кустящиеся сорта компенсируют урожай, недостающих растений при низкой густоте, формируя больше побегов. Однако, при благоприятных внешних условиях, не было существенного преимущества среди сильно кустящихся сортов и низко кустящихся сортов относительно урожайности. Способность к кущению растения риса оказала большое влияние на продуктивность метелки (Miller и др. 1991), которая сильно кореллирует с зерновой продуктивностью (Counce и Wells,, 1990; Miller и др., 1991). Зерновая продуктивность риса была выше, поскольку окончательная густота стеблестоя увеличилась до 700 побегов на м2 при постоянном затоплении и проточной системе агротехники (Miller и др., 1991). Недавнее исследования также показали, что число побегов, установленное в стадии инициирования роста метелки, более сильно коррелировало с зерновой продуктивностью, чем в любые другие стадии роста у орошаемого риса (Fageria, 2007). У яровой пшеницы, выращенной в Саскатуне, Hucl и Baker (1989) обнаружили, что 67 % зерновой продуктивности яровой пшеницы было от главного стебля и первичных побегов. Недавно, Goos и Johnson (2001) сообщили, что главный стебель и первичные побеги формируют 95 - 100 % зерновой продуктивности твердой красной яровой пшеницы.
2.4 ФАКТОРЫ ВОЗДЕЙСТВУЮЩИЕ НА КУСТИСТОСТЬ И ЗЕРНОВУЮ ПРОДУКТИВНОСТЬ РИСА
2.4.1 Азот: Азот - один из самых важных питательных элементов для растения риса, потому что он связан с хлоропластами и синтезом белка, которые физиологически необходимы во время накопления сухого вещества (Dalling, 1985). Однако, азот представляет один из самых дорогих вложений, и это – в основном ограничивает питательное вещества в затопляемом так же как и в горном незатопляемом производстве риса во всем мире (Becker и др., 1994; Baligar и Fageria, 1997). Азот играет важную роль в накоплении углеводов в соломине и влагалищах листьев во время стадии трубкования и во время налива зерна. Количество удобрений, необходимых во время роста растения, зависит от типа удобрений, типа почвы, сортов риса, климата, и способов применения (Mae, 1997). Нормы азота для оптимальной зерновой продуктивности изменяются согласно сорту и механическому составу почвы (Norman et al., 2005; Bond et al., 2006). Дополнительные дозы азота необходимы во время налива зерна, потому что азот, полученный на ранних стадиях или от минерализации неустойчивого органического вещества почвы, уже использован, для ускорения первоначального роста и увеличения числа побегов в конце фазы кущения (Mae, 1997). Более высокие дозы азота на ранних стадиях способствуют чрезмерному вегетативному росту, создают проблемы полегания и увеличения уровня лиственных патогенов (Bohlool и др., 1992), но внекорневая подкормка азотом в последней фазе формирования метелки увеличивает урожайность вместо того, чтобы стимулировать полегание (Mae, 1997). Внекорневая подкормка азота в фазе вымётывания очень важна, для улучшения зерновой продуктивности, так как растения риса активно абсорбируют азот ещё спустя две недели после выметывания, и более высокие дозы азота наряду с поднятыми концентрациями двуокиси углерода привели к более высокому формированию числа побегов и более высокой биомассе растений1 (Weerakoon и др., 1999). Преждевременное формирование побега было вызвано дозой азота и временем внесения азота не раньше отобранного водой риса, но независит от выбора срока азота и величины взаимодействия азота (Stevens и др., 2001). Применение азотных удобрений или в избыточном количестве или в недостаточном, чем оптимальные нормы, влияет на урожай и качество риса (Liu, 1991; Saito, 1991).
Mossedaq и Smith (1994) сообщили, что рост и развитие яровой пшеницы зависит от нормы и времени внесения азотного удобрения. Было найдено, что потребность в азоте была высока только перед выходом в трубку в период роста культуры. У риса по сообщению Fageria и Baligar (1999), норма и время внесения азотного удобрения сильно влияет на зерновую продуктивность, так же как и на накопление сухого вещества орошаемого риса. Fageria и Baligar (1996) наблюдали в центральной Бразилии на почвах в долине Амазонки, что урожайность орошаемого риса была значительно выше при 200 кг N га1 чем при 100 кг N га1. Влияние применения азота менялось в зависимости от времени внесения (Bacon и Lewin, 1990). Обычно для риса, азот вносится в три дробных применения. Это позволяет более эффективно использовать азота в различные стадии роста растения, поскольку это обеспечивает определенное количество питательных элементов в течение сельскохозяйственного сезона и уменьшает выщелачивание нитратов из почвы. Strong (1986) сообщил, что образование побегов было выше, когда азот был применен перед посевом или во время процесса кущения яровой пшеницы. Поэтому, оптимальное количество азота, выбор времени внесения, и способа применения должны быть определенны для каждой культуры для достижения потенциальной зерновой продуктивности. Формирование непродуктивных побегов изменяется согласно количеству внесенного азота и сорта (Amin и др., 2006). Разумное использование доступных передовых технологий и создание новых сортов могут помочь достигнуть желательного потенциала продуктивности для любой культуры.
2.4.2 Густота: Норма высева - также один из основных факторов, влияющих на способность формирования побегов (Counce и др., 1992) и общее число побегов и стеблей, возрастающих с увеличением густоты посева, в то время как число вторичных и третичных побегов уменьшается с увеличением густоты посева у изученных сортов риса (Nuruzzaman и др., 2000). Было установлено, что густота посева обратно пропорциональна числу вторичных и третичных побегов (Hoshikawa, 1989; Wu и др., 1998). Число продуктивных побегов - очень важный агрономический признак, однако, на него влияет густота стояния. Ottis и Talbert (2005) сообщили, что число продуктивных побегов было ниже при высокой густоте стояния. Азот и густота стеблестоя играют важную роль в формировании побегов и, в конечном счете, урожайности. Более высокая норма высева увеличивает густоту стеблестоя, но формирует низкое число зерен в колосе 1 у пшеницы (Done и Whittington, 1980). У риса густота стеблестоя значительно увеличивается с увеличением густоты стояния с 122 до 458 растений м2, в то время как вся биомасса выше почвы не имела достоверных различий среди популяций растений (Miller и др., 1991). Доля остановившихся в развитии побегов была увеличена за счет более высокого числа побегов, и существенная отрицательная корреляция (r =-0.86 **) была установленна между процентом продуктивных побегов и максимальным числом побегов (Schnier и др., 1990).
Срок посева: Срок посева играет важная роль в формировании побегов помимо азота и густоты стояния. Формирование побегов было снижено у твердой красной яровой пшеницы, что, привело к значительному уменьшению колосьев на м2 в случае позднего посева (Black и Siddoway, 1977), но с другой стороны, больше побегов отмечено в раннем посеве, что привело к существенному увеличению колосьев на м2 (Hucl и Baker, 1989). У риса задержка посева значительно снижает зерновую продуктивность на 0.88 т/га в случае с ароматическим рисом (Ghosh и др., 2004), однако, высокая густота стояния может компенсировать потерю урожайности, вызванную поздним посевом (Baloch и др., 2006).
Регуляторы роста: Деятельность пазушных почек управляется многочисленными генетическими, онтогенетическими и экологическими сигналами, и апикальное доминирование, которое подавляет рост пазушных почек, является одним из этих сигналов (Zou и др., 2006). Было сначала продемонстрировано, что удаление вершины ростка, главного участка биосинтеза ауксина, способствует росту спящих пазушных почек (Thimann и Skoog, 1933). Ауксин стимулирует апикальное доминирование побега, что препятствует деятельности пазушных почек, и с другой стороны, цитокинин активизирует рост пазушной почки. Роль цитокинина в формировании побега была подтверждена высоким уровнем цитокинина и кустистым фенотипом в различных исследованиях мутантов Арабидопсиса (Chaudhary и др., 1993; Catterou и др., 2002).
2.5. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЫСОТУ РАСТЕНИЯ, ПЛОТНОСТЬ МЕТЕЛКИ И ЗЕРНОВУЮ ПРОДУКТИВНОСТЬ: Высота растения риса - важный агрономический признак, потому что она улучшает индекс урожая, и она связана с полеганием растений. Высота растений полукарлика увеличивает индекс урожая (зерно/зерно + солома) и увеличивает производство биомассы (Khush, 1999). Высота растения определяется как расстояние от уровня почвы до кончика самого высокорослого листа у всходов, но это - расстояние от уровня почвы до верхушечной точки самой высокой метелки при уборке (Fageria, 2007). Она определяется общим количеством и длиной междоузлий и изменяется согласно генетическому составу растения и условиям окружающей среды (Wang и Li, 2005). Качественные гены и количественные локусы связаны с высотой растения (Huang и др., 1996). Успех зеленой революции был связан с полукарликовыми сортами пшеницы и риса, которые были очень отзывчивы к высоким дозам удобрений (Yoshida, 1981; Khush, 1999; Peng и др., 1999).
2.5.1 Азот: Азотные удобрения необходимы для более высокой зерновой продуктивности, но это также стимулирует удлинение листа и стебля, что увеличивает высоту растения. Высота растения, число продуктивных побегов холма-1, длина метелки положительно коррелируют с высокими дозами азота (Manzoor и др., 2006). Высота растения, число продуктивных побегов холма-1, длина метелки, число зерен метелки-1, вес с 1000 зерен, и урожайность возросла с 0 кг/га - 175 кг/га у сорта риса Basmati 2000. С другой стороны, полный урожай, число зерен метелки-1 и вес 1000 зерен начали уменьшаться после 175 кг N на га. Высокая густота метелок была результатом применения более высокой дозы азота (Bond и др., 2008). Так же у пшеницы (Triticum aestivum L.), азот увеличил высоту растения и число зерен колоса-1 (Khan и др., 2000; Iqtidar и др., 2006).
Стерильность колосков не желательна в программе усовершенствования культуры, так как это снижает зерновую продуктивность, и зависит от сорта, так же как и от уровня азота (Fageria, 2007). Зерновая продуктивность риса может быть увеличена на целых 15 %, если селекционеры риса устранят стерильность колоска. Применение достаточного количества азота составляло приблизительно 91%-ое варьирование метелок на м2, приблизительно 75%-ое варьирование по стерильности колоска, и приблизительно 73%-ое варьирование по массе 1000 зерен у орошаемого риса (Fageria и Baligar, 2001; Fageria, 2007). Количество азота и время внесения играют главную роль в улучшении зерновой продуктивности. Высоко урожайным сортам риса необходимо относительно более высокое количество азота чем средние урожайные сорта риса (Wada и др., 1986). Однако формирование каждого компонента урожая только не зависело от абсолютного количества азота, но и это также зависело от структуры внесения азота и процессов поглощения на каждой стадии роста для соответствующего компонента урожайности (Mae, 1997). Азот, внесенный во время трубкования или стадии цветения, не улучшал зерновую продуктивность, но он поддерживал листья риса более зелеными во время налива зерна. Число метелок и зерен было уже сформировано, когда азот был внесен в репродуктивной фазе (Castillo и др., 1992; Fageria и Baligar, 1999). Масса 1000 зерен не изменялась значительно с обогащением азотом и была очень устойчивым сортовым признаком при различных условиях роста (Yoshida, 1981; Fageria и Baligar, 1999).
2.5.2 Густота: Агрономические факторы, такие как высота растения и зерновая продуктивность чрезвычайно чувствительны к пространственному распределению растений у риса. Пространственное распределение растения изменяется согласно сортам. Коротко рослые или полукарликовые сорта были более высоко урожайными при близком пространственном размещении растений по сравнению с более высокорослыми сортами (Tanaka и др., 1964). Dofing и Knight (1994) сообщили, что более высокая высота растения и более слабая соломина вызваны высокой густотой стояния, и это может увеличить возможные потери из-за полегания и болезней у ячменя. Wells и Faw (1978) сообщили, что норма высева не оказала никакого существенного влияния на урожайность при низком уровне азота, но у низких норм высева была значительно более высокая урожайность при высокой дозе азота. Обратные взаимоотношения были обнаружены между размером метелки и плотностью метелки, потому что источник становится ограничивающим фактором, чтобы выполнить большой объем потребления, прежде всего при большом количестве метелок за единицу площади (Fageria, 2007). Были также обратные отношения между процентом от созревших колосков и густотой метелки (Yoshida, 1981). Сообщалось, что как только доля всходов риса увеличивается, наполненность метелки зернами уменьшается без изменения урожайности (Jones and Synder, 1987; Gravois and Helms, 1992). Fageria и Baligar (1999) сообщили, что стерильность колоска была выше когда число метелок, или число колосков на единицу площади возрастало, и это было отнесено к дисбалансу между более высоким объемом потребления (колосок) и сравнительно низкой способности источника (фотосинтез). Плотность метелки, число колосков в метелке, вес колоска, и выполненность зерна - главные компоненты урожайности, а плотность метелки ответственна за самую высокую вариацию зерновой продуктивности (Fageria, 2007). Отрицательная корреляция была найдена между стерильностью колоска и зерновой продуктивностью (Fageria и Baligar, 1999), и высокая положительная корреляция была выяленна между плотностью метелки и общей зерновой продуктивностью (Ottis и Talbert, 2005). Fageria (2007) сообщил, что плотность метелки играет главную роль в определении общей зерновой продуктивности. Окончательная густота стеблестоя была важным фактором в определении зерновой продуктивности риса в затопляемой, отобранной водой культурной системе с максимальной урожайностью при 700 побегах м2 (Miller и др., 1991). Поэтому, необходимо соответствующее число метелок и растений на единице площади, чтобы достигнуть максимальной урожайности.
2.5.3. Регуляторы роста: Два регулятора роста, гибберелловая кислота (GA) и brassinosteroid (BR), как известно, играют главную роль в управлении высотой растения риса (Yamamuro и др., 2000; Sasaki и др., 2002; Wang и Li, 2005). GA была впервые изолирована скрещиванием от Fusarium moniliforme Sheldon, стадия Gibberella fujikuroi (Saw.). Wr (Phinney, 1956). GA играет очень важную роль в активизировании удлинения клетки у многих высших растений, индуцируя гидролитические ферменты (амилаза) в алейроновом слое семян зерновых. Это, как было обнаружено, усиливает процесс деления клетки в интеркалярной меристеме глубоко затопленного риса, активизируя гистон киназу и cyclin генов во время индуцирования быстрого роста междоузлий (Sauter и др., 1995). GAs известна как основной растительный гормон, участвующий в стимуляции роста влагалища листа риса (Matsukura и др., 1998), также была обнаружена эффективность в задержке цветения и выхода метелки важных в производстве гибридных семян риса (Virmani и Sharma, 1993).
Брассиностероиды имеют большое влияние на высоту растения и на эректоидность листа у риса, которые являются очень важными агрономическими признаками в продуктивности культуры. Недавно, карликовый мутант риса, d61, был охарактеризован. Было обнаружено, что плейтропный ненормальный фенотип карлика с вертикальными листьями был связан с нарушениями в синтезе брассиностероидов (Yamamuro и др., 2000).
2.6. ОПИСАНИЕ И КЛАССИФИКАЦИЯ РАЗЛИЧНЫХ ВИДОВ МУТАНТОВ НИЗКОРОСЛОГО РИСА: Карликовость играет важную роль в устойчивости к полеганию. Большинство полукарликовых сортов высокоурожайны, так как они устойчивы к полеганию и имеют высокий уборочный индекс при интенсивных методах культивирования. Некоторые карликовые мутанты были обнаружены и охарактеризованы у риса, но большинство из них появилось в результате индуцированных мутаций (химических, радиационных). С другой стороны, селекционные популяций или большие производственные площади риса являются хорошими источником получения естественных мутантов, но эти мутанты обычно не обнаруживаются и не отбираются селекционерами/фермерами из-за их плохого вида или низкой агрономической ценности. Существует много мутантов, имеющих неправильную модель ветвления побега, большинство с нарушением в инициации пазушной меристемы или последующего её роста или все сразу, которые были идентифицированы и описаны в различных видов, таких как кукуруза, помидор, и арабидопсис (Doebley и др., 1995; Schumacher и др., 1999; Stirnberg и др., 1999; Shimizu-Sato и Mori, 2001; Hubbard и др., 2002; Ward и Leyser, 2004). QTL и молекулярный анализs показали, что ген TB1 регулирует ветвление у кукурузы (Doebley и др., 1995).
Исследования выявили много генов у риса, которые участвовали в инициировании и росте пазушных почек побегов или листьев риса во время вегетативной стадии (Komatsu и др., 2003; Li и др., 2003; Takeda и др., 2003). LAX и SPA были идентифицированы как основные регуляторы формирования пазушной меристемы у риса и мутантов (lax & spa) с этими признаками имевших меньшее количество ветвей метелки, что было вызвано подавлением заложения боковых ветвей (Komatsu и др., 2003).
Высота карлика растений тесно связана с GAs. Гены Зеленой революции wheat reduced height1 (Rhtl) и semi-dwarf1(sd-1) риса участвуют в передаче сигналов GA и биосинтезе GA, соответственно (Peng и др., 1999; Sasaki и др., 2002; Spielmeyer и др., 2002). sd-1, рецессивный ген полукарликовости, является одним из самых важных генов, используемых в селекции риса, первоначально идентифицированный у китайского сорта риса “Dee-geo-woo-gen”. Наличие этого гена приводит к уменьшению соломины, с высокой устойчивость к полеганию и высоким индексом урожая, с учетом повышенного использования азотных удобрений (Jennings, 1964). Сорт Зеленой революции риса IR8 был получен, скрещиванием Dee-geo-woo-gen с sd-1 геном и 'Peta' (высокорослый) в 1960 (IRRI, 1967). Этот сорт дал рекордные урожаи по всей Азии и сформировал основу для создания новых высокопродуктивных растений полукарликового типа. Идентификация и характеристика гена Зеленой революции (sd1) открыла дверь для создания высокопродуктивных полукарликовых сортов. После появления IR8 много полукарликовых сортов было выведено и выпущены в связи с агрономической значимостью этого признака в селекционных программах.
Обширные исследования были выполнены, чтобы объяснить механизм карликовости у карликовых мутантов риса и идентифицировать вовлеченные гены. Первый клонированный ген низкорослости мутантов у риса был d1, и его низкорослый фенотип был связан с не производством функционального GTP-необходимого белка, участвующего в трансдукции сигнала GA (Ashikari и др., 1999). Два низкорослости гена риса, d61 и d2, нарушали синтез и восприятие брассиностероидов (BR), соответственно (Yamamuro и др., 2000; Hong и др., 2003). d2 мутант был только 70-80 % от высоты растения дикого типа, низкорослость этого мутанта была вызванна полным или частичным сокращение длины второго междоузлия от вершины. Удлинение других междоузлий было не затронуто у этого мутанта (Hong и др., 2003). С другой стороны, два типа удлинения междоузлий (dm-тип и d6-тип) наблюдались у мутанта d61 (Yamamuro и др., 2000).
Takeda (1977) классифицировал низкорослые мутанты на шесть групп, основываясь на модели удлинения четырех верхних междоузлий. N представляет удлиненные междоузлия с нормальным растяжением, междоузлия которых укорачиваются от верхнего междоузлия до базального междоузлия. Dn-тип отражает модель удлинения некоторых карликов, последовательные междоузлия которых уменьшены однородно. С другой стороны, dm-тип и мутанты sh-типа имеют меньшую длину второго междоузлия и первого верхнего междоузлия, соответственно. Тип sh проявляет двойное влияние; сокращение длины верхнего междоузлия, и увеличение длины базальных междоузлий. d6 - другой тип, длина верхнего междоузлия которого больше чем половина всей длины соломины. Другая классификация низкорослых мутантов риса, дана Mitsunaga и др. (1994), основывается на ростовых реакциях от действия гиббереловой кислоты (GA). Низкорослые мутанты риса были классифицированы на три группы: T, D, и E. Группа T была представлена, мутанты лишенные GA, группа D состояла из мутантов нечувствительных к GA, тогда как те мутанты, которые не были ни лишенными GA, ни чувствительными к GA, представляли группу E.
2.6.1 Мутанты, связанные с кустистостью: Помимо низкорослого габитуса, кустистость - другой важный агрономический признак, который влияет на продуцирование метелки. Поэтому, несколько кустистых мутантов риса было обнаружено, но большинство из них полностью не охарактеризовано (Goto и др., 2005). Кустистые низкорослые мутанты характеризуются увеличением числа побегов а так же уменьшением высоты растения (Kinoshita и Takahashi, 1991). Пять кустистых низкорослых мутантов риса (d3, d10, d14, d17 и d27), которые имеют небольшую высоту растений и увеличенное число побегов, были описаны, а их фенотип был результатом уменьшения подавления роста пазушной почки побега (Ishikawa и др., 2005). Недавно были обнаружены, “fine culm 1” (fc1) мутант и одностебельный мутант названных “monoculm 1”, мутант (moc1) (Li и др., 2003; Takeda и др., 2003). fc1 мутант формирующий вдвое большее число побегов чем растение риса обычного типа, но характер цветения был не затронут (Goto и др., 2005). И d мутанты (d3, d10, d14, d17 и d27) и fc1 мутанты были низкорослыми с высокой кустистостью, но оба мутанта отличались друг от друга по структуре низкорослости. Низкорослость d мутантов была вызвана подавлением всех междоузлий, что привело к низкорослому фенотипу, тогда как существенное сокращение наблюдалось только в самом верхнем междоузлии у fc1 (Arite и др., 2007). Отсутствие способности к кущению у мутанта moc1 было вызвано утратой способности инициировать почки побега (Li и др., 2003). Местоположение MOC1 было нанесено на карту на длинном плече хромосомы 6. Основываясь на подобии последовательности с кукурузным Teosinte branched1 (TB1), который участвует в боковом ветвлении у кукурузы, другой ген кустистости риса, ген TBI (OsTB1) был идентифицирован (Takeda и др., 2003). Сообщалось, что перенасыщение OsTB1 сильно снижало боковое ветвление риса, в то время как его нефункционирующая мутация у мутанта fine culm 1 (fc1) способствовала росту побегов риса. Заложение пазушных почек, однако, не была затронуто у сверхэкспрессирующей OsTB1 трансгенной линии. Это указывает на то, что основная роль OsTB1 заключается в управлении ростом пазушных почек побега, а не инициировании пазушных почек (Takeda и др., 2003). В дополнение к регуляции апикального доминирования ген TB1, который сходен по последовательности с геном OsTB1 риса, был определен как имеющий роль в формировании соцветия у кукурузы (Doebley и др., 1997). TB1 - член TCP-обязательная группы доменов, регулирующих транскрипцию. Большое число членов группы TCP участвует в контроле деления и роста клетки или самостоятельно или совместно с некоторыми другими белками (Cubas и др., 1999). Недавно, htd-1 (high tillering dwarf 1) аллель был обнаружен у риса, он ответствечает за признак высокой кустистости. htd-1 мутант формирует избыточное число побегов, его первые побеги начинают появляться из влагалища листа в стадии трех листьев. htd-1 мутант увеличивает число побегов, выводя пазушную почку из состояния покоя, а не закладывает больше пазушных почек в листовых влагалищах. Испытание GA показало, что мутант htd-1 и Nanjing 6 (не мутантный сорт риса) имели одинаковую деятельность α-амилазы и имели почти одинаковые значения длин второго влагалища листа с применением и без применения GA как Nanjing 6 (контроль, не мутантный сорт риса). Это показывает, что мутант htd-1 был карликом ни с недостатком GA, ни с нечувствительностью к GA (Zou и др., 2005). Генетический анализ показал, что высокая кустистость и признаки низкорослости мутанта htd-1 управлялась единственным рецессивным ядерным геном htd-1, и он был точно нанесен на карту на 30 kb участке ДНК в 4 хромосоме (Zou и др., 2005).
ГЛАВА III
МАТЕРИАЛЫ И МЕТОДЫ
3.1 ИСТОЧНИК МУТАНТА: Очень высоко кустящийся низкорослый мутант риса был отобран в ранних поколениях популяции от скрещивания L -202 × Saber, полученной в Texas Agrilife Research and Extension Center, Бомонт, Техас как показано на рис. 1.

“Saber” - длиннозерный, полукарликовый сорт риса, имеющий высокую устойчивость к полеганию и высокую способность куститься (McClung и др., 2004). Этот сорт был создан USDA-ARS для использования в Южных регионах США. L-202 - длиннозерный и скороспелый сорт риса. Обнаруженный мутант был доведен до 4 поколения, использованием рядкового посева метелки при затоплении на китайской глинистой почве (прекрасный, smectic, гипертермический Oxyaquic, Dystrudert). Несколько сестринских линий были получены, но две линии (М. 13662 и М. 13684) использовались для детальной фенотипической характеристики.
3.2 ФЕНОТИПИЧЕСКАЯ ХАРАКТЕРИСТИКА: Два сорта с геном полукарликовости, sd-1 (Zhe733 и Cocodrie) были выбраны как контроль, чтобы охарактеризовать очень высоко кустящийся и низкорослый мутант риса. В настоящее время, Cocodrie - самый популярный сорт в южных районах США. Zhe733 - быстро кустящийся сорт, имеет высокую способность к кущению по сравнению с Cocodrie. Шестнадцать линий мутанта и два контроля были высажены на одно рядковые делянки длиной 1.83 м. Азотные удобрения использовались в дозе 223 кг/га в три применения. Первое, второе и третье внесение азота было проведено во время посева, затопления, и стадии заложения метелки в дозе 56 кг/га, 89 кг/га, и 78 кг/га, соответственно. Фосфор был также внесен в дозе 17 кг/га как обработка перед растением. Растения обрабатывались различными видами гербицидов и инсектицидов (Command 4EC, Permit, Stam 80 EDF, Bolero 8 EC, Basagram, и Mustang Max) по мере необходимости. Пять растений были отобраны из каждой из линий мутанта для исследования кустистости наряду с Zhe733 и Cocodrie в качестве контроля. Числа побегов/растение учитывалось каждую неделю, начинаясь с 30 дней после всходов. Даты 50 % выметывания и созревания были получены. Другие агрономические данные, собранные с урожая, были следующие:
Число продуктивных побегов/растение
Число непродуктивных побегов/растение
Общее число побегов/растение
Процент (%) продуктивных побегов
Высота (см) - от основания растения до конца высшего, полностью расправленного листа.
Длина флагового листа (см)
Длина метелки (см)
(h) Полных зерен в метелке
(i) Пустых зерен в метелке
(j) Отношение полных зерен к пустым зернам
(k) Процент выполненых зерен
(l) Общее количество зерен в метелке
(m) масса зерна с растения (г/растение)
(n) длина выхода Метелки (см)
(o) длина Семени (мм)
(p) ширина Семени (мм)
(q) масса 1000 зерен (g)
3.3 ДЕСТРУКТИВНЫЙ ОТБОР ДЛЯ ОПИСАНИЯ СПОСОБНОСТЬ К КУЩЕНИЮ ДВУХ ОЧЕНЬ ВЫСОКО КУСТЯЩИХСЯ И НИЗКОРОСЛЫХ МУТАНТНЫХ ЛИНИЙ РИСА: Сто восемьдесят проростков каждой из двух мутантных линий (М. 13662 & М. 13684) и сортов контроля (Cocodrie и Zhe 733) был посажены в сосуды Jiffy для деструктивной выборки. После установки горшков в большой деревянной бадье все горшки были заполнены китайской глинистой почвой (прекрасный, smectic, гипертермический Oxyaquic Dystrudert), и семена были непосредственно высеяны на каждый горшок. Спустя две недели после всходов, было проведено прореживание до одного растения в горшке. Азотное удобрение было внесено по рекомендации. Деструктивный отбор был начат в стадии колеоптиле всходов риса и был продолжен до фазы максимального кущения. По три растения в одной и той же стадии у каждой мутантной линии и контроля были взяты по каждой дате осуществления выборки. Деструктивный отбор был повторен на 4-й день после осуществления выборки. По каждой дате осуществления выборки всходы были выдернуты и промыты водой, чтобы избавиться от всей почвы, а затем высота растения (см), состояние покоя почки, появление 1-го побега, число первичных, вторичных, и третичных побегов было учтено.
3.4 ВЛИЯНИЕ ГИББЕРЕЛЛОВОЙ КИСЛОТЫ (GA) НА УДЛИНЕНИЕ ВТОРОГО ВЛАГАЛИЩА ЛИСТА: Влияние GA на удлинение второго влагалища листа было определено модифицированным методом “Microdrop” Murakami (1968). Поверхность десять семян очень высоко кустящегося и низкорослого мутанта риса и контроля (Cocodrie) стерилизовали в течение 30 минут в 10%-ом отбеливающем растворе (NaClO), и затем промыты три раза в стерильной дистиллированной воде. Семена были замочены в стерильной дистиллированной воде дополнительно на 48 ч после смытия отбеливающего вещества. Проросшие семена были помещены поверх твердого 1%-ого агара, изначально влитого в стеклянную пробирку (диаметром 2.1 см, и глубиной 8.2 см). Всходы были пересажены и сохранены в каждой пробирке. Все засаженные пробирки с 25 мл 1%-ого агара были помещены в штатив для пробирок и были помещены под люминесцентные лампы с 260C до применения GA. Перед обработкой GA GA3 был растворен в этаноле, затем разбавлен стерильной дистиллированной водой, до достижения концентраций раствора GA3 200 pmol. После двух дней, 1 μl раствор GA3 (200 pmol/растение) был обработан колеоптиле всех всходов в стадии первого листа. После 4 дней применения GA длина второго влагалища листа была измерена в каждого мутанта так же как и у сорта контроля, Cocodrie.
3.5 ГЕНЕТИЧЕСКИЙ АНАЛИЗ
3.5.1 Развитие семян F1: Цветущие растения очень высоко кустящегося и низкорослого мутанта риса и Cocodrie были собраны и помещены в черные пластмассовые пакеты рано утром для кастрации. Пять или шесть метелок были отобраны для кастрации, и остальная часть побегов были удалены с главного стебля. Кастрация была начата в 15:00, когда пестик не был восприимчивым. Приблизительно одна треть цветка метелки была срезана/удалена, с помощью острых ножниц во время кастрации. Выставленные пыльники были удалены, используя вакуум. После удаления пыльников, кастрированные метелки были покрыты, сумочкой из стекловолокна, чтобы избежать занесения чужой пыльцы. Метелки мужской родительской формы, опылителя, были собраны в 10:00 на следующий день с экспериментального поля, расположенного в AgriLife Research and Extension Center, Бомонт, Техас, и были помещены во флягу с водой, чтобы избежать усушки. Как только метелки начинали пылить, сумочки из стекловолокна удалялись с кастрированных метелок, а метелки опылителя встряхивались поверх кастрированных метелок. Внимание была уделено, чтобы предотвратить введение посторонней пыльцы кроме отобранного родителя. После опыления, сумочки из стекловолокна были одеты заново, зажаты и промаркированы. Метка включала имя родителей ♂ и ♀, и дату опыления. Спустя тридцать дней после опыления, семена F1 были собраны, высушены и сохранены в рефрижераторе до нужного момента. Скрещивания включая рецмпрокные были проведены с Cocodrie с целью определения характера наследования признаков очень высокой кустистости и низкорослости. Таким образом, для каждого мутанта, было проведено два скрещивания: Cocodrie × мутант, и мутант × Cocodrie. Двадцать семян F1 были собраны в каждой комбинации скрещивания.
Поколение популяции F2: растения F1 были выращены, чтобы произвести популяцию F2 для генетического анализа. Десять семян F1 из каждой комбинации скрещивания были обработаны Vitavex (фунгицид), чтобы предотвратить грибковую инфекцию. Рассматриваемые семена были помещены в чашки Петри, покрытых фильтровальной бумагой. Как только семена проросли и имели энергичные корни и ростки, они были пересажены в одном выгоночный сосуд и помещены в теплицу. Все растения были оплодотворены согластно рекомендациям и были обработаны инсектицидом по мере необходимости. Растения были поддержаны до зрелости. При уборке метелки с каждого растения F1 были собраны, обмолочены, очищены и высушены при 40oC в сушильном шкафу в течение трех дней, чтобы нарушить покой семян. Число F1 уцелевших в одном скрещивании, таким образом только три популяции были произведены. Семена были сохранены в рефрижераторе до необходимости.
Растения для генетического анализа: Триста шестьдесят семь самоопыленных семян от растений F1 (семена F2) комбинации M-13662×Cocodrie, вместе с родителями и семенами F1 использовались, чтобы определить отношения расщепления по мутантным признакам в М. 13662, в то время как 413 семян от самоопыления растений F1 (семена F2) комбинации M-13684×Cocodrie вместе с родителями и F1 использовались в М. 13684. 460 зерен от самоопыления растений F1 (семена F2) Cocodrie×M-13662 с родителями и F1 были также оценены как реципрокное скрещивание для М. 13662. Семена были высеяны в черные пластмассовые горшки (Диаметр: 14.8 см, Глубина: 17.5 см) помещенные в деревянные бадьи. Спустя тридцать дней после всходов, бадьи затоплялись. Рекомендуемые удобрения были внесены, а инсектициды использовались по мере необходимости. Все растения содержались в теплице. При максимальном кущении (спустя приблизительно 45 дней после посева), было посчитано число нормальных и мутантных фенотипов. Сбор урожая не был сделан для всех растений из-за заражения клещем метелки и карантинных проблем.
3.6 РЕАКЦИЯ АГРОНОМИЧЕСКИХ ПРИЗНАКОВ МУТАНТОВ РИСА НА
РАЗНЫЕ УРОВНИ АЗОТА И ГУСТОТЫ РАСТЕНИЙ В УСЛОВИЯХ ТЕПЛИЦЫ: Отдельное исследование проводилось в теплице, чтобы определить реакцию мутантных линий (М. 13662 и М. 13684) к разным уровням густоты растения и азотных удобрений. Cocodrie и Zhe733 использовались как контроль. Три уровня азота (N1=179 кг/га, и N2=202 кг/га N3=224 кг/га) и пять густот растений (P1=1 растение/горшок, P2=2 растения/горшок, P3=3 растения/горшок, P4=4 растения/горшок, P5=5 растений/горшок) были проанализированы, для определения их влияния на различные агрономические признаки. Посев семенами был произведен в черные пластмассовые горшки (Диаметр: 14.8 см, Глубина: 17.5 см), заполненные китайской глинистой почвой (прекрасный, smectic, гипертермический Oxyaquic Dystrudert). Каждый вариант повторялся три раза и положена в заговоре раскола, полностью рендомизированном расположении. Сто восемьдесят черных пластмассовых горшков (Диаметр: 14.8 см, Глубина: 17.5 см), и девять деревянных бадей (Рис. 2) использовались в этом исследовании. В каждой бадье были горшки с одной дозой N, чтобы избежать влияния других обработок N при затоплении. Азотное удобрение (мочевина) было применено в трех равных расколах, которые были внесены во время посева, фазе максимального кущения и фазе трубкования. Влажность почвы была поддержана в полевой способности для надлежащего прорастания семян. Разрежение было проведено на стадии 3-х листьев, для получения необходимой густоты растений. Все бадьи затоплялись в фазе кущения (спустя 40 дней после посева). Пропалывание проводилось по мере необходимости. Sevin, Kelthane, и Orthene были применены, для борьбы с насекомыми и клещами. Высота растения (от основания стебля до конца высшего полностью раскрывшегося листа) и общее числа побегов учитывались каждую неделю до уборки. Дата цветения и созревания (уборка) были взята и для мутантов и для контролей. Агрономические данные, собранные во время созревания, были следующие:
Число продуктивных побегов/растение
Число непродуктивных побегов/растение
Общее число побегов/растение
Процент (%) продуктивных побегов
Высота (см) - от основания растения до конца верхнего, полностью раскравшегося
листа.
Длина флагового листа (см)
Длина метелки (см)
(h) Озерненность зерен/метелке
(i) Пустозерность зерен/метелке
(j) Отношение выполненых зерен к невыполненным зернам
(k) Процент выполненых зерна
(l) Общее количество зерен/метелке
(m) Вес зерна с растения
(n) Длина выхода метелки (см)

3.7 СТАТИСТИЧЕСКИЙ АНАЛИЗ: Все собранные данные были статистически проанализированы, используя дисперсионный анализ (ANOVA; программное обеспечение SAS JMP). Средства были отделены, используя тест Tukey’s HSD при альфа-уровне 0.05. Chi-square тест использовался, чтобы оценки соотношения расщепления.
ГЛАВЫ IV
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
4.1 ФЕНОТИПИЧЕСКОЕ ОПИСАНИЕ: Все мутанты имели аномальный фенотип с ранних стадий развития. Наиболее характерными особенностями были низкорослость и присутствие нескольких побегов с развитыми стеблями, формировавшими кустистый фенотип. Иллюстрация 3 демонстрирует фенотипические различия (высота и формирование побегов) между очень высоко кустящимся и низкорослым мутантом и нормальным растением риса в одинаковой фазе развития, выращенных в поле. Таблица 1 показывает агрономические признаки различных мутантных линий относительно Cocodrie и сортов Zhe733 с геном sd-1. Мутантные линии формируют побеги быстрее, чем обычные сорта. Первый побег у мутанта появился спустя две недели после посева, но у Cocodrie и Zhe733 побегов не было. Две мутантные линии (М. 13662 и М. 13684) в наших исследованиях сформировали больше побегов, чем другие мутантные линии и обычные сорта. М. 13684 сформировала самое большое число побегов (121.6), что было в 7.8 раз больше чем у Cocodrie и в 4.9 раза, чем у Zhe733. Другой мутант М. 13662 в полевых условиях имел в 5.5 раз больше побегов, чем Cocodrie и в 3.5 раза больше чем Zhe733. М. 13684 имела в 1.36 раза больше побегов, чем М. 13662. Самый низкое количество побегов имел сорт Cocodrie, а среди мутантных линий – М. 13621 (49.80 побегов). Такое количество побегов было в 3.19 раза выше, чем у Cocodrie и в два раза выше, чем у Zhe733. Линии М. 13644, М. 13660, М. 13667 и М. 13681 имели больше чем 90% продуктивных побегов, как и Cocodrie, но в среднем, у мутантов наблюдалось 84% продуктивных побегов. От общего числа побегов у Cocodrie был самый высокий процент продуктивных стеблей (93 %), в то время как самый низкий процент был у М. 13684 – 63 %.

Таблица 1. Агрономические признаки линий мутанта и контроля (Cocodrie & Zhe733) в полевых условиях.
| Генотипы | Число продуктивных побегов/растение | Число непродуктивных побегов/растение | Общее число побегов/ растение | % продуктивных побегов | Высота (см) | Длина флагового листа (см) | Длина метелки (см) | Выполненных зерен в метелке | Пустозерность |
| М. 13603 | 57.00 ± 18.94 | 17.00 ± 3.16 | 74.00 ± 16.49 | 77.02 | 54.10 ± 6.06 | 21.89 ± 2.77 | 13.62 ± 1.48 | 16.28 ± 5.61 | 10.84 ± 6.67 |
| М. 13612 | 45.80 ± 4.86 | 15.80 ± 17.28 | 61.60 ± 20.45 | 74.35 | 55.37 ± 3.18 | 21.25 ± 3.00 | 12.95 ± 1.59 | 18.88 ± 7.52 | 7.16 ± 6.27 |
| М. 13621 | 41.00 ± 18.93 | 8.80 ± 5.97 | 49.80 ± 16.10 | 82.32 | 49.53 ± 2.24 | 17.16 ± 2.69 | 12.03 ± 2.25 | 19.08 ± 8.11 | 5.96 ± 6.43 |
| М. 13632 | 55.00 ± 14.56 | 16.80 ± 8.89 | 71.80 ± 13.46 | 76.60 | 47.49 ± 3.43 | 17.21 ± 2.48 | 12.39 ± 2.98 | 19.96 ± 8.97 | 8.48 ± 6.09 |
| М. 13640 | 55.60 ± 12.91 | 8.60 ± 6.50 | 64.20 ± 13.36 | 86.60 | 50.41 ± 3.90 | 20.29 ± 2.73 | 13.27 ± 1.48 | 23.36 ± 9.08 | 8.20 ± 6.40 |
| М. 13644 | 71.20 ± 8.40 | 7.40 ± 4.15 | 78.60 ± 9.09 | 90.58 | 54.35 ± 5.26 | 22.29 ± 3.37 | 14.09 ± 1.49 | 27.20 ± 8.80 | 13.44 ± 6.93 |
| М. 13652 | 51.80 ± 15.99 | 6.00 ± 3.67 | 57.80 ± 18.83 | 89.61 | 53.97 ± 2.28 | 19.89 ± 3.25 | 14.05 ± 1.76 | 27.00 ± 8.87 | 6.66 ± 4.07 |
| М. 13655 | 53.60 ± 24.86 | 9.60 ± 5.59 | 63.20 ± 25.62 | 84.81 | 50.67 ± 6.93 | 18.12 ± 5.07 | 12.35 ± 2.03 | 19.60 ± 10.30 | 8.68 ± 7.06 |
| М. 13660 | 56.60 ± 22.64 | 5.40 ± 3.13 | 62.00 ± 25.14 | 91.29 | 53.97 ± 3.73 | 19.40 ± 3.2 | 13.09 ± 1.50 | 23.08 ± 9.29 | 9.16 ± 7.72 |
| М. 13662 | 73.80 ± 26.45 | 15.20 ± 2.94 | 89.00 ± 26.30 | 82.92 | 50.67 ± 4.96 | 20.50 ± 2.69 | 11.68 ± 1.57 | 20.24 ± 8.00 | 7.72 ± 4.19 |
| М. 13667 | 68.00 ± 9.48 | 5.40 ± 0.89 | 73.40 ± 10.06 | 92.64 | 53.08 ± 1.65 | 22.68 ± 2.88 | 14.13 ± 1.19 | 22.36 ± 5.97 | 9.72 ± 3.54 |
| М. 13676 | 66.60 ± 11.17 | 9.40 ± 4.39 | 76.00 ± 14.94 | 87.63 | 51.68 ± 1.38 | 22.63 ± 2.65 | 14.26 ± 1.26 | 21.88 ± 6.73 | 11.44 ± 4.13 |
| М. 13681 | 73.40 ± 16.33 | 6.80 ± 3.11 | 80.20 ± 15.44 | 91.52 | 53.34 ± 2.00 | 23.00 ± 3.28 | 13.62 ± 1.13 | 22.92 ± 5.76 | 8.64 ± 3.93 |
| М. 13684 | 77.60 ± 23.58 | 44.00 ± 10.83 | 121.60 ± 24.29 | 63.81 | 52.83 ± 4.45 | 22.58 ± 3.39 | 12.35 ± 1.52 | 17.80 ± 6.40 | 10.32 ± 6.02 |
| М. 13689 | 63.40 ± 22.78 | 8.00 ± 3.31 | 71.40 ± 24.87 | 88.79 | 50.80 ± 5.95 | 22.48 ± 4.30 | 12.73 ± 2.07 | 19.68 ± 9.40 | 7.88 ± 4.80 |
| М. 13691 | 55.60 ± 17.12 | 10.08 ± 2.77 | 66.40 ± 19.75 | 83.73 | 54.10 ± 4.86 | 20.88 ± 4.05 | 12.49 ± 1.76 | 17.92 ± 7.07 | 8.84 ± 5.42 |
| Cocodrie | 14.60 ± 7.53 | 1.00 ± 0.70 | 15.60 ± 8.20 | 93.58 | 97.15 ± 2.10 | 25.38 ± 3.33 | 22.25 ± 1.75 | 123.56 ± 38.75 | 61.44 ± 20.14 |
| Zhe733 | 17.60 ± 5.77 | 7.40 ± 3.13 | 25.00 ± 8.00 | 70.40 | 88.39 ± 4.63 | 27.83 ± 3.66 | 20.63 ± 1.13 | 87.52 ± 18.65 | 23.40 ± 13.18 |
† Измерения были проведены в форме среднего ± SD, (Допустимое отклонение), n=5.
Таблица 1. Продолжение
.
| Генотипы | выполненые/пустые | % выполненных зерен | Общее число зерен метелке | Зерновая продуктивность (растение г 1) | Длина метелки (см) | Выметывание дней DAE* | Созревание дней DAE* | Масса 1000 семян (g) | длина зерновки (мм) | ширина зерновки (мм) | Отношение (Длина/ Ширина зерновки) |
| М. 13603 | 1.50 | 60.02 | 27.12 ± 10.26 | 14.01 ± 4.65 | 3.43 ± 1.57 | 93 | 121 | 15.10 | 7.12 ± 0.11 | 2.11 ± 0.22 | 3.37 |
| М. 13612 | 2.63 | 72.50 | 26.04 ± 9.00 | 13.57 ± 1.44 | 3.77 ± 2.40 | 93 | 121 | 15.70 | 7.46 ± 0.07 | 2.08 ± 0.15 | 3.58 |
| М. 13621 | 3.20 | 76.32 | 25.00 ± 11.52 | 11.89 ± 5.49 | 1.74 ± 1.64 | 92 | 121 | 15.20 | 7.70 ± 0.06 | 2.18 ± 0.11 | 3.53 |
| М. 13632 | 2.35 | 76.41 | 28.24 ± 10.99 | 16.41 ± 4.34 | 1.32 ± 1.43 | 93 | 121 | 14.95 | 7.86 ± 0.03 | 2.05 ± 0.15 | 3.83 |
| М. 13640 | 2.84 | 74.01 | 31.56 ± 10.82 | 20.26 ± 4.70 | 2.48 ± 1.64 | 92 | 121 | 15.60 | 7.99 ± 0.03 | 2.20 ± 0.08 | 3.63 |
| М. 13644 | 2.02 | 67.26 | 40.44 ± 11.62 | 29.82 ± 3.52 | 1.85 ± 1.29 | 93 | 121 | 15.40 | 8.10 ±0.04 | 2.11 ± 0.10 | 3.83 |
| М. 13652 | 3.86 | 76.48 | 33.66 ± 11.73 | 21.46 ± 6.62 | 2.33 ± 1.30 | 92 | 121 | 15.35 | 8.19 ± 0.02 | 2.09 ± 0.10 | 3.91 |
| М. 13655 | 2.27 | 69.30 | 28.28 ± 12.87 | 15.57 ± 7.22 | 2.32 ± 1.30 | 92 | 121 | 14.83 | 8.31 ±0.04 | 2.18 ± 0.13 | 3.81 |
| М. 13660 | 2.51 | 71.58 | 32.24 ± 11.84 | 19.56 ± 7.82 | 2.19 ± 1.58 | 92 | 121 | 14.98 | 8.58 ± 0.17 | 2.05 ± 0.18 | 3.91 |
| М. 13662 | 2.62 | 72.38 | 27.96 ± 9.61 | 24.09 ± 9.43 | 3.37 ± 1.77 | 95 | 121 | 15.50 | 7.87 ± 0.04 | 2.11 ± 0.12 | 3.72 |
| М. 13667 | 2.30 | 69.70 | 32.08 ± 7.25 | 23.82 ± 3.32 | 4.21 ± 2.02 | 92 | 121 | 15.67 | 7.47 ± 0.04 | 2.05 ± 0.09 | 3.64 |
| М. 13676 | 1.91 | 65.82 | 33.24 ± 7.86 | 22.58 ± 3.78 | 2.87 ± 1.67 | 92 | 121 | 15.50 | 7.60 ± 0.04 | 2.14 ± 0.08 | 3.55 |
| М. 13681 | 2.65 | 73.55 | 31.16 ± 6.84 | 27.90 ± 6.21 | 3.27 ± 2.23 | 95 | 121 | 16.59 | 7.76 ± 0.04 | 2.08 ± 0.11 | 3.74 |
| М. 13684 | 1.72 | 63.30 | 28.12 ± 10.47 | 21.40 ± 6.50 | 3.07 ± 1.58 | 93 | 121 | 15.50 | 7.85 ± 0.04 | 2.06 ± 0.16 | 3.81 |
| М. 13689 | 2.49 | 71.40 | 27.56 ± 10.95 | 19.62 ± 7.05 | 3.44 ± 1.77 | 92 | 121 | 15.73 | 7.95 ± 0.03 | 2.07 ± 0.15 | 3.84 |
| М. 13691 | 2.02 | 67.98 | 26.36 ± 9.08 | 15.22 ± 4.22 | 3.53 ± 1.63 | 92 | 121 | 14.85 | 8.07 ± 0.03 | 2.12 ± 0.11 | 3.80 |
| Cocodrie | 2.01 | 66.77 | 185.04 ± 45.33 | 45.35 ± 22.97 | 4.04 ± 1.88 | 75 | 105 | 24.80 | 8.91 ± 0.04 | 2.60 ± 0.05 | 3.15 |
| Zhe733 | 3.74 | 79.18 | 110.52 ± 21.55 | 45.11 ± 14.79 | 4.70 ± 1.59 | 75 | 105 | 29.29 | 9.17 ±0.06 | 3.00 ± 0.11 | 3.05 |
† Измерения были взяты в виде среднее ± SD (стандартное отклонение), n=5.
‡* DAE – дней после появления
Можно отметить, что мутантные линии имели узкие границы для числа продуктивных побегов, и широкие различия по числу непродуктивных побегов. У мутантов была тенденция формирования маленьких и тонких побегов даже в стадии зрелости, таким образом, увеличивая общее количество непродуктивных побегов. 37% непродуктивные побеги М. 13684 были в основном недавно появившимися небольшими побегами с 3-4 листьями к уборке. Основываясь на фенотипе, ген, который способствует росту побегов у этих мутантов, может быть подобен d3 как у пяти d мутантов с более слабой способностью подавить деятельность пазушных почек (Ishikawa и др., 2005) или d10 с увеличенным ветвлением (Arite и др., 2007) указывающий на не подавление состояния покоя почки. Самое высокое число побегов (165) было получено у одного из М. 13684 мутанта на стадии зрелости. Это было больше чем число побегов htd-1 мутанта с 99.5 ± 12.2 побегов (Zou и др. 2005), но меньше чем почти 200 побегов у d10 (Arite и др., 2007). О высоте htd-1 мутанта сообщалось, что она была почти как у Zhe733 с sd-1 геном, таким образом, наши мутанты во многом напоминают d-фенотип.
Е женедельный подсчет побегов у мутантов (М. 13662 & М. 13684) относительно контроля показан на рис. 4. Число побега удваивалось каждую неделю до седьмой недели после появления первого побега у М. 13662, так же как и у М. 13684, но интенсивность было ниже на контроле (Cocodrie & Zhe733). Скорости продуцирования новых побегов у мутантов замедлились между 13-ой и 16-ой неделей. Однако, после этого периода, мутанты сформировали побеги по интенсивности, подобной, что и при первых семи неделях после появления первого побега. Временная остановка формирования новых побегов в мутантов наблюдалась только в течение трех недель совпавших с созреванием зерен (одну неделю до, и спустя две недели после 50 % цветения).
женедельный подсчет побегов у мутантов (М. 13662 & М. 13684) относительно контроля показан на рис. 4. Число побега удваивалось каждую неделю до седьмой недели после появления первого побега у М. 13662, так же как и у М. 13684, но интенсивность было ниже на контроле (Cocodrie & Zhe733). Скорости продуцирования новых побегов у мутантов замедлились между 13-ой и 16-ой неделей. Однако, после этого периода, мутанты сформировали побеги по интенсивности, подобной, что и при первых семи неделях после появления первого побега. Временная остановка формирования новых побегов в мутантов наблюдалась только в течение трех недель совпавших с созреванием зерен (одну неделю до, и спустя две недели после 50 % цветения).
Зерна были готовы к уборке спустя 30 дней после 50 % цветения (дата выметывания). Обычный рис почти прекратил формировать побеги за одну неделю до 50 % цветения известную как фаза максимального кущения. В то время как мутанты начали формировать новые побеги снова спустя две недели после выметывания, некоторые побеги у обычного риса, начали высыхать и погибать. Позднее выметывание обоих мутантов (М. 13662 & М. 13684) продлило период формирования побегов; однако, как и Cocodrie и Zhe733, эти мутанты достигли максимального числа побегов до выметывания. В среднем, мутанты были на 36 и 45 см ниже, чем Zhe733 и Cocodrie, соответственно. М. 13662 был самым низкорослым (47.49 см), а М. 13612 (55.37) был самым высокорослым среди всех мутантных линий в полевых условиях. Основываясь на высоте растения, о которой сообщалось, мутанты были близки к d мутантам с высотой приблизительно 40-65 см (Arite al., 2007). htd-1 мутант был намного более высорослым - 83 см (Zou и др., 2005) почти столь же высоким, как и Zhe733 с геном полукарликовости sd-1. Средняя высота мутантов риса (М. 13662 и М. 13684) составляла только 60-64 % недавно идентифицированного высоко кустящегося низкорослого мутанта риса htd-1. Различные условия роста могли быть главной причиной этих различий, таким образом, объективное сравнение может быть сделано, только если эти мутанты растут рядом в одно время и одном месте. Создание и оценка изолиний мутантов в дальнейшем проверит сходства и различия их фенотипа. Карлики М. 13662 и М. 13684 мутантов мог быть отнесены к неправильной модели удлинения междоузлий, а такие модели наблюдались у других мутантных линий. Мутанты выметывались на 95 день после посадки и им потребовался 121 день, чтобы созреть, тогда, как обычный рис выметывался на 75 день после псева и требовал 105 дней, для созревания. Средняя длина флагового листа мутантов составляла 21.50 см. Самые длинные и самые короткие флаговые листья были у Zhe733 (27.83 см) и М. 13621 (17.16 см), соответственно. Среди мутантов самый длинный флаговый лист (23 см) наблюдалась у М. 13681. Длина флагового листа М. 13662 (20.50 см) была короче, чем М. 13684 (22.58 см). Было также замечено, что у мутантов были более темные листья при созревании, чем у Cocodrie и Zhe733. У мутантов были намного более короткие метелки чем у Cocodrie и Zhe733 как показано рис. 5. У мутантов средняя длина метелки составила 13.94 см. У М. 13662 была более короткая метелка - 11.68 см чем у М. 13684 с 12.35 см, но у обоих было почти, одинаковое число зерен в метелке (28-29 зерен в метелке). Мутанты нуждались только в 26 днях для наполнения зерна, из-за небольшого числа зерен в метелке. Самые длинные и самые короткие метелки были у мутантов М. 13676 (14.26 см) и М. 13632 (11.45 см), соответственно. С другой стороны, длина метелки на контроле (Cocodrie и Zhe733) была больше чем в два раза длиннее, чем длина метелки мутантов риса (М. 13662 и М. 13684). Самое высокое (185.04) и самое низкое (25.00) число зерен в метелке было у Cocodrie и М. 13621, соответственно.
Характер цветения был нормальным для всех наблюдений, а мутанты имели среднюю длину вышедшей метелки - 2.90 см. У Cocodrie и Zhe733 метелка вышла на 4.70 см и на 4.04 см соответственно, и они были хорошо вышедшими по сравнению с другими мутантами в наших исследованиях. Среди значений мутантов, М. 13667 имел наиболее вышедшую метелку (4.21 см), в то время как наименьшую имел М. 13632 (1.32 см). У М. 13662 была большая длина вышедшей метелки (3.37 см) в сравнении с М. 13684 (3.07 см). Процент выполненных зерен варьировал у всех наблюдений. Самая высокая и самая низкая выполненность зерен была получена у Zhe733 и М. 13684, соответственно.
Среди мутантов наиболее высокая выполненость зерен наблюдалось у М. 13652. Вообще, рост растения риса прекратился в фазу созревания, и продукты фотосинтеза накопились в метелках. Кроме накопления продуктов фотосинтеза в метелках (потребитель), в результате фотосинтеза флагового листа, мобильные углеводы, белок, и минеральные питательные вещества, из различных источников также перемещаются в метелку в фазу созревания зерна, и растение постепенно становится стареющим (Murayama, 1995). Число зерен в метелке было ниже у мутантов в сравнении с контролем (Cocodrie и Zhe733). Вероятно, что мобильные углеводы, белок, и минеральные питательные вещества из различных источников не транспортировались к метелкам, и они использовались, чтобы сформировать большее количество побегов даже после уборки. Мутантные линии также формировали меньше семян относительно контроля. Длина и ширина семян у обоих мутантов (М. 13662 и М. 13684) была меньше чем у Cocodrie и Zhe733. Учитывая отношение длины семени к ширине, оба мутанта (М. 13662: 3.72 и М. 13684: 3.81), были практически сопоставимы с контролем (Cocodrie = 3.42 и Zhe733 = 3.05). С таким отношением все промеры могут быть отнесены в группу с длинным зерном. В США рис делят на длинно- ( 3.0:1), средне- (2.0:1) и короткозерный (Zhe733 (29.29 г.), следом Cocodrie (24.80 г.). Самая высокая и самая низкая масса 1000 семян среди всех линий мутанта была получена у М. 13681 (16.59 г.) и М. 13655 (14.83 г.), соответственно. Вес семян указал на мелкозерность мутантов в сравнении с Cocodrie и Zhe733.

Takeda и др. (2003) описал мутант fc1 имевший фенотип карлика и сильное ветвление, а недавно, было сообщено пять генов кустистостистых и низкорослослых мутантов риса (D3, D10, D14, D17 и D27) и высокий кустящийся карлик 1, (htd-1). Эти мутанты показали низкорослость и большое число побегов (Ishikawa и др., 2005; Zou и др., 2005). У очень высоко кустящихся низкорослых мутантов риса (М. 13662 и М. 13684) в данном исследовании есть фенотипы, подобные ранее описанным мутантам риса (увеличенное число побегов и низкорослость), но имеющие уникальный признак непрерывное формирование побегов. d мутанты, htd-1, fc1, М. 13662 и М. 13684 могут быть дифференцированы друг от друга на основе типа карликовости. Arite и др. (2007) сообщил, что удлинение было подавлено во всех междоузлиях у d мутантов, что приводит к их карликовому фенотипу, тогда как сжатие самого верхнего междоузлия наблюдалось у fc1. Сокращение верхних четырех междоузлий и метелки - главная причина карликовости у htd-1 мутанта. М. 13662 и М. 13684 походили на htd-1 по типу удлинения междоузлия верхних четырех междоузлий, но сжатие 2-3 междоузлий в основании также причина карликовости обоих мутантов (М. 13662 и М. 13684) в дополнении к относительному сокращению верхних междоузлий. Большое формирование побегов могло быть связано с низкорослостью обоих мутантов по сравнению с htd-1 мутантом. С ранних стадий развития М. 13662 и М. 13684 проявляли сходный фенотип; огромное увеличение числа побегов, сокращение высоты растения и маленький размер зерна что было характерно для d мутантов (d3, d10, d14, d1, и d27). Признаки низкорослости и высокого кущения являлись связанными признаками у всех высоко кустящихся низкорослых мутантов риса, о которых сообщалось (Zou и др., 2005) подобно кущению и карликовости у арабидопсиса и гороха (Sorefan и др., 2003; Goto и др., 2005). Такая же связь признаков наблюдались у наших мутантов риса (М. 13662 и М. 13684). Низкорослость мутанта могла быть результатом снижения апикального доминирования, однако, это должно быть установлено в дальнейших исследованиях.
Д изруктивный отбор выявил модель развития побега и роста листа у высоко кустящихся и карликовых мутантов риса. Первый полностью раскрывшийся лист главного стебля был сформирован спустя приблизительно 9 дней после посева у мутантов, и каждый новый полностью раскрывшийся лист формировался каждые 4 дня. Почти тот же самый тип формирования листа наблюдался на контроле (Cocodrie). Боковая почка под первым влагалищем листа остается в состоянии покоя в диких сортах подвида японика (Cocodrie), тогда как эта почка была активной у обоих мутантов риса (М. 13662 и М. 13684). Первое заметное свидетельство различия между мутантами и контролем был рост почек побега из пазухи первого листа в стадии 3-х листьев у мутантов, которое не наблюдалось у растений дикого типа (Cocodrie). Первый побег с полностью раскрывшимся листом наблюдался в стадии 4-х листьев в случае обеих линий мутанта (М. 13662 и М. 13684), тогда как, никакой побег не наблюдался у Cocodrie (рис. 6). В среднем, мутанты сформировали по 2-3 побега к стадии 5-го листа, но никакие побеги небыли сформированы у Cocodrie даже в стадии 5-ти листьев. Оба мутанта сформировали в восемь раз большее число побегов (24) чем Cocodrie (3) в течении 48 дней после появления всходов. Средняя высота обоих мутантов становится почти постоянной после 48-52 дней после появления всходов, но увеличения высоты наблюдается у Cocodrie после 48-52 дней. На стадии 6-ти листьев М. 13684 имел четыре, вышедших побега (два первичных и два вторичных), в то время как у Cocodrie был только один первичный побег (рис. 7). Только одна пазушная почка находилась в листовых влагалищах листьев мутантов риса (М. 13662 и М. 13684) как и у растений контроля (Cocodrie и Zhe733).
изруктивный отбор выявил модель развития побега и роста листа у высоко кустящихся и карликовых мутантов риса. Первый полностью раскрывшийся лист главного стебля был сформирован спустя приблизительно 9 дней после посева у мутантов, и каждый новый полностью раскрывшийся лист формировался каждые 4 дня. Почти тот же самый тип формирования листа наблюдался на контроле (Cocodrie). Боковая почка под первым влагалищем листа остается в состоянии покоя в диких сортах подвида японика (Cocodrie), тогда как эта почка была активной у обоих мутантов риса (М. 13662 и М. 13684). Первое заметное свидетельство различия между мутантами и контролем был рост почек побега из пазухи первого листа в стадии 3-х листьев у мутантов, которое не наблюдалось у растений дикого типа (Cocodrie). Первый побег с полностью раскрывшимся листом наблюдался в стадии 4-х листьев в случае обеих линий мутанта (М. 13662 и М. 13684), тогда как, никакой побег не наблюдался у Cocodrie (рис. 6). В среднем, мутанты сформировали по 2-3 побега к стадии 5-го листа, но никакие побеги небыли сформированы у Cocodrie даже в стадии 5-ти листьев. Оба мутанта сформировали в восемь раз большее число побегов (24) чем Cocodrie (3) в течении 48 дней после появления всходов. Средняя высота обоих мутантов становится почти постоянной после 48-52 дней после появления всходов, но увеличения высоты наблюдается у Cocodrie после 48-52 дней. На стадии 6-ти листьев М. 13684 имел четыре, вышедших побега (два первичных и два вторичных), в то время как у Cocodrie был только один первичный побег (рис. 7). Только одна пазушная почка находилась в листовых влагалищах листьев мутантов риса (М. 13662 и М. 13684) как и у растений контроля (Cocodrie и Zhe733).
 В среднем материнский стебель у мутанта сформировал 3-4 первичных побега, в то время как каждый из первичных побегов сформировал по 2-3 вторичных побега. Каждый вторичный побег был способен сформировать по 1-2 третичных побега, а третичные побеги далее дали по 1-2 четвертичных побега, четвертичные побеги сформировали, по меньшей мере, по 1 побегу и так далее. В диком типе (Cocodrie и Zhe733), однако, только главный стебель, первичные побеги и вторичные побеги дали новые побеги. Тип кущения у мутанта показан на рис 8. Было также замечено, что первые 2-3 узла мутантов (М. 13662 и М. 13684) были сжаты, формируя структуру подобную кроне, таким образом, было трудно дифференцировать эти узлы невооруженным глазом при деструктивном отборе. Это могло быть еще одной причиной низкорослости мутантов в дополнение к сжатию четырех верхних междоузлий. Четыре верхних междоузлия М. 13662, М. 13684 и Cocodrie были измерены и сравнены. Основываясь на типе остановки формирования четырех верхних междоузлий, сильно кустящиеся низкорослые мутанты риса могли быть отнесены к карликам dn-типа, определенного Takeda, но у нескольких растений наблюдался различный характер прекращения удлинения, не включенных в эту классификацию. Вторые и четвертые междоузлия были короче, чем третьи междоузлия на некоторых растениях М. 13662 и М. 13684. Аналогично, третье междоузлие было короче, чем второе и четвертое междоузлие у нескольких растений у мутантов (М. 13662 и М. 13684) (рис. 9).
В среднем материнский стебель у мутанта сформировал 3-4 первичных побега, в то время как каждый из первичных побегов сформировал по 2-3 вторичных побега. Каждый вторичный побег был способен сформировать по 1-2 третичных побега, а третичные побеги далее дали по 1-2 четвертичных побега, четвертичные побеги сформировали, по меньшей мере, по 1 побегу и так далее. В диком типе (Cocodrie и Zhe733), однако, только главный стебель, первичные побеги и вторичные побеги дали новые побеги. Тип кущения у мутанта показан на рис 8. Было также замечено, что первые 2-3 узла мутантов (М. 13662 и М. 13684) были сжаты, формируя структуру подобную кроне, таким образом, было трудно дифференцировать эти узлы невооруженным глазом при деструктивном отборе. Это могло быть еще одной причиной низкорослости мутантов в дополнение к сжатию четырех верхних междоузлий. Четыре верхних междоузлия М. 13662, М. 13684 и Cocodrie были измерены и сравнены. Основываясь на типе остановки формирования четырех верхних междоузлий, сильно кустящиеся низкорослые мутанты риса могли быть отнесены к карликам dn-типа, определенного Takeda, но у нескольких растений наблюдался различный характер прекращения удлинения, не включенных в эту классификацию. Вторые и четвертые междоузлия были короче, чем третьи междоузлия на некоторых растениях М. 13662 и М. 13684. Аналогично, третье междоузлие было короче, чем второе и четвертое междоузлие у нескольких растений у мутантов (М. 13662 и М. 13684) (рис. 9).
Обычно, сорта нормального типа (Cocodrie и Zhe733) увеличивают число побегов до начала удлинения соломины и инициирования метелки, после чего число побегов каждого растения постоянно или начинает уменьшаться из-за старения старых побегов.

33
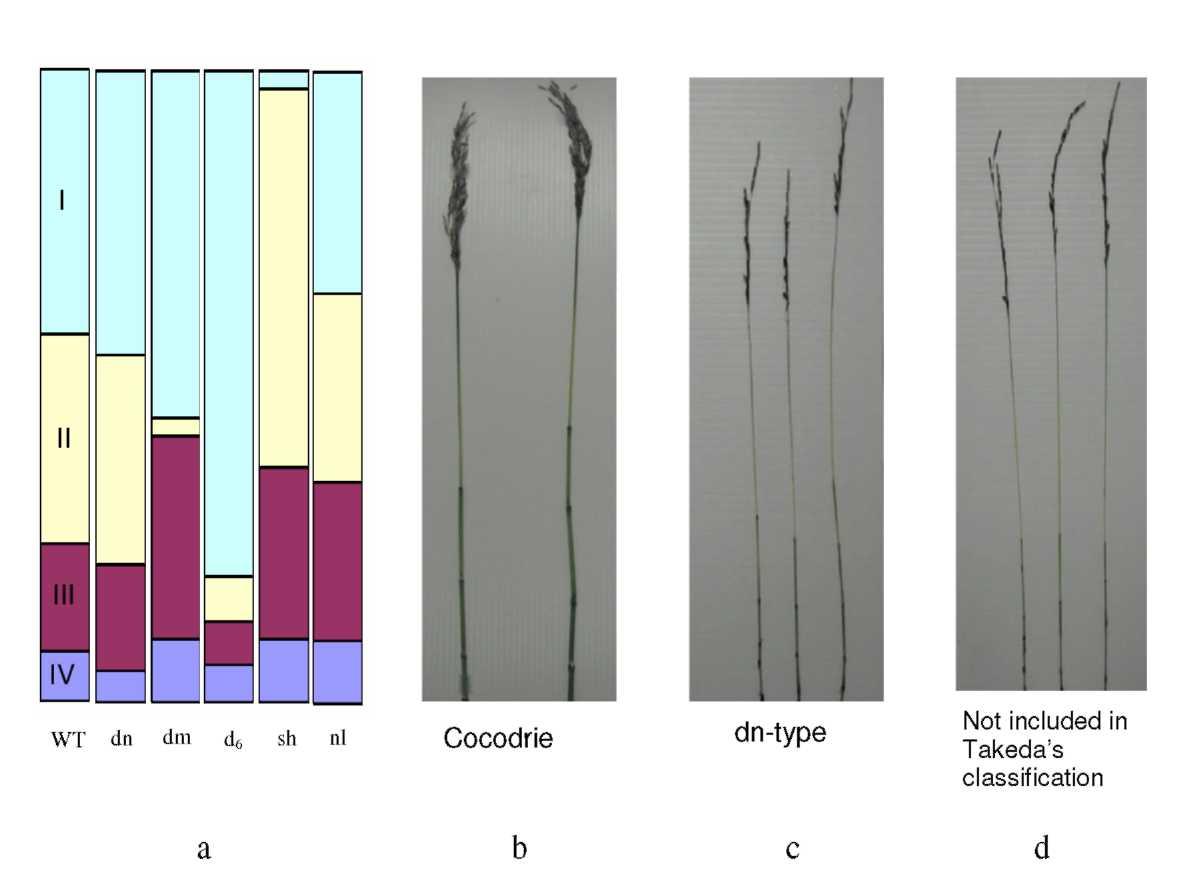
Рис. 9. Характер удлинения четырех верхних междоузлий у дикого типа и высоко кустящихся низкорослых мутантов риса (М. 13662 и М. 13684). (a) Схематическое представление типа удлинения междоузлия дикого типа (WT) и различных низкорослых мутантов (d6-, dn-, dm-, nl - и sh- типа; измененный от Takeda, 1977). (b) тип удлинения междоузлий Cocodrie, характерный для модели dn-типа. (c) сильно кустящиеся низкорослые мутантные линии риса, проявляют модель удлинения междоузлия dn-типа. (d) некоторые растения М. 13662 и М. 13684 имевших уникальный тип удлинения междоузлия, которые не были включены в классификацию Takeda.
Однако, сильно кустящиеся низкорослые мутантные линии (М. 13662 и М. 13684) продолжали формировать новые побеги даже в фазу полной спелости. Такое же число побегов и высота наблюдалось при двух диструктивных отборах и полевом фенотипизировании в течении 48-52 дня после появления всходов, указывающих на последовательное выражение признака в различных условиях роста. Эти наблюдения далее предлагают, что увеличенная способность к кущению кустящихся низкорослых мутантных линий – результат выхода пазушных почек из состояния покоя. Аналогичное было отмечено у htd-1, d3 и d10 мутантов риса (Ishikawa и др., 2005; Zou и др., 2005; Arite и др., 2007). Оба мутанта (М. 13662 и М. 13684) описанные здесь не прекращают формировать новые побеги даже на репродуктивной стадии. Все побеги мутанта (главные стебель, первичный побег, вторичный побег, третичный побег, четвертичный побег и далее) могли служить источником стеблей для дальнейшего формирования побегов, тогда как только главный стебель, первичные и вторичные побеги дикого типа имели способность, как и материнский, формировать новые побеги. Признак высокой кустистости важен в формировании биомассы, поскольку побеги составляют 75 % биомассы риса (Wu и др., 1998), и эффективность зерновых культур также зависит от интенсивности формирования побегов после уборки. Таким образом, эти мутанты могли бы быть хорошим материалом для создания более высокой биомассы и дающих отпрыски исследований.
4.2 РЕАКЦИЯ КУСТСТИСТЫХ НИЗКОРОСЛЫХ МУТАНТОВ РИСА (М. 13662 и М. 13684) НА GIBBERELLIC КИСЛОТУ: оценка удлинения второго влагалища листа у мутанта и на контроле проводилась при обработке GA (200 pmol), чтобы определить возможные взаимоотношении между карликовостью (М. 13662 и М. 13684) и их способностью отреагировать на обработку GA. Даже перед обработкой GA, у Cocodrie было более длинное 2-ое влагалище листа, чем у мутантов, и оно было самым длинным влагалище листа среди промеров. У М. 13684 было самое короткое влагалище листа среди всех генотипов (Таблица 2). М. 13662 и М. 13684 только на 0.79 см и 0.94 см соответственно увеличили длину влагалища листа после обработки GA3; у Cocodrie и М. 13662 было увеличение на 0.99 см, анализ средних, используя t-тест подтвердил различия. Рассматривая отношения, все три линии дали приблизительно одинаковые отношения длин второго влагалища листа с обработкой и без обработки GA. Это указывает, что оба мутанта (М. 13662 и М. 13684) были GA-отзывчивы, подобно Cocodrie. Cocodrie - полукарликовый сорт риса с sd-1 геном, а sd-1 растения как было показано сохраняют отзывчивость на GA по всходам, и в фазы кущения и вымётывания (He и Li, 1996; Mitsunaga и др., 1994) подтвердив вышеупомянутые наблюдения. Spielmeyer и др. (2002) предложил, чтоб ген Os20ox2 соответствующий sd-1 локусу, а фенотип полукарлика вызван дефектом гена Os20ox2, приводящего к дефициту активной GA. Было показано, что GA3, субстрат GA20-оксидазы накапливался в удлиненных стеблях полукарликовых растений, но содержания основного продукта (GA20), и биологически активной GA1 было ниже относительно высокорослых фенотипов. sd-1 ген клонирован в Японии (Mona и др. 2002), связан с кодированием GA20-оксидазы и более низкого количества GA20, и биологически активных GA1 в полукарликовых сортах приводя к низкорослому фенотипу. Оба мутанта риса (М. 13662 и М. 13684) сохранили способность реагировать на обработку биологически активным гибберелинами аналогично Cocodrie, различие между мутантами (М. 13662 и М. 13684) и Cocodrie (sd-1) могло быть в эндогенном количестве биологически активной GA1. Возможно, что у мутантов было намного меньше биологически активного GA1, чем у Cocodrie, в связи с чем уменьшается высота растения. У двух независимых аллелей sd-1 гена было различное количество GA1, приблизительно на 20-35 % меньше чем у высокорослых растений. Это снижение GA, однако, не доказывает такое уменьшение высоты у полукарликовых растений.
Снижение высоты растения - другой уникальный агрономический признак/особенность мутантов помимо большого числа сформированных побегов. Gibberellic кислота играет очень важную роль в управлении высотой растения риса и имеет такую же важность при росте влагалищ листа риса (Matsukara и др., 1998; Yamamuro и др., 2000; Sasaki и др., 2002; Wang и Li, 2005). Обработка GA3 Tan-ginbozu, карликового мутанта риса с GA-дефицитом, восстановило нормальный фенотип (Murakami, 1968). Мутанты (М. 13662 и М. 13684) могут быть мутантами с дефицитом GA, что основывается на фенотипе. Sakamoto и др. (2004) наблюдал за мутантами с дефицитом GA, используюя следующие критерии: карликовость без другой аберрантной морфологии, темно-зеленые листья и восстановление карликовости до дикому типу обработкой GA3. Хотя листья мутантов (М. 13662 и М. 13684) не были темно-зелеными, и фенотип не вернулся к нормальному при обработке GA3, они имели неправильную морфологию кроме того, в отличие от карликовых и реагирующих на GA3 как sd-1 растений известное быть GA несовершенный (Spielmeyer и др., 2002). Количественный анализ эндогенных уровней GA необходим, чтобы объяснить его возможную роль в карликовости М. 13662 и М 13684.
Таблица 2. Влияние gibberellic кислоты (GA) на удлинении второго влагалища листа. Среднее ± σ, n=10.
| Сорт | Длина второго листового влагалища (см). Среднее ± σ, n=10 | Отношение +GA3/-GA3 | |
| -GA3 | +GA3 | ||
| Cocodrie | 5.18 ± 0.62 | 6.17 ± 0.58 | 1.19 |
| М. 13662 | 4.69 ± 0.66 | 5.63 ± 0.91 | 1.20 |
| М. 13684 | 3.41 ± 0.65 | 4.20 ± 0.65 | 1.23 |
† GA3, Gibberellic кислота; - = без GA3; + = с GA3
‡ SD, Допустимое отклонение
4.3 ГЕНЕТИЧЕСКИЙ АНАЛИЗ: 10 растений F1 от трех скрещиваний М. 13662 и М. 13684 и Cocodrie показали обычный фенотип, как у Cocodrie, который типичен для рецессивного признака. Только два отличных фенотипа наблюдались у этих 1 246 особей в трех популяциях F2, выращенных в теплице, таким образом, растения были классифицированы на две группы согласно этим фенотипам. Высокие растения с небольшим числом побегов как Cocodrie, доминировали в популяции, а карликовых растений с высоким числом побегов как у мутанта было меньшее количество. После подсчета растений в каждой группе было установлено, что потомство F2, расщепляется в соотношении приблизительно 3: 1 (3 обычных : 1 карликовый кустистый мутантный тип). χ-квадрат анализ (X2 X20.05) выявил соответствие между наблюдаемым и ожидаемым отношением (Таблица 3). Основываясь на анализе расщепления, пришли к заключению, что признаками высокой кустистости и низкорослости мутантов риса управлял один рецессивный ген.
Ни одно растение в этих популяциях не было более высокорослым, чем Cocodrie, также как не было растения более низкорослого, чем мутант. У Cocodrie, как известно, есть рецессивный ген полукарликовости, sd-1. Если эти два гена являются аллельными или сцепленными, расщепления не должно быть, а если бы они были двумя независимыми генами, то по крайней мере четыре класса должны были выщепиться. Соотношение 3:1 предполагает, что у Cocodrie есть дикий доминантный аллель, который отсутствует в мутантных линиях. Анализ SSR маркеров, связанных с sd-1, указал, что у обоих мутантов был sd-1 ген который был получен от родителей (L-202 & Saber), имевших ген sd-1. Ген, управляющий признаками в линиях мутанта, мог быть другой аллелью в sd-1 локусе, действуя рецессивно на sd-1 у Cocodrie, или это был другой локус. Spielmeyer и др. (2002) сообщил о двух независимых аллелях в sd-1 локусе (Os20ox), GA20-оксидаза. Оба имели изменение в Os20ox (делецию 280 bp и замену аминокислоты) приводящее к дефициту активной GA. Об этом же sd-1 локусе сообщалось Mona и др., (2001), но также говорилось о существовании, по крайней мере, еще одного локуса GA20-оксидазы. Анализируя гены-кандидаты и оценивая, мутанты с GA-дефицитом, Sakamoto и др. (2004) сообщил о четырех GA20ox подобных генах, расположенные в хромосомах 1, 7, 5, и 7. Ген, расположенный в хромосоме 1, был sd-1 геном, о котором ранее сообщалось.
Таблица 3. χ2 анализ расщепления популяции F2 полученных от скрещивания Cocodrie и мутантов.
| Скрещивание | Дикий тип (Cocodrie) | Мутант | Общее количество | χ2 (3:1) |
| M-13662*/Cocodrie | 281 | 86 | 367 | 0.48 |
| M/13684*/Cocodrie | 313 | 100 | 413 | 0.13 |
| Cocodrie/M-13662* | 336 | 130 | 466 | 2.08 |
* мутант
4.4 РЕАКЦИЯ КУСТИСТЫХ НИЗКОРОСЛЫХ МУТАНТОВ РИСА (М. 13662 И М. 13684), COCODRIE И ZHE733 НА РАЗЛИЧНЫЕ ДОЗЫ АЗОТА И ГУСТОТУ СТОЯНИЯ: дисперсионный анализ (ANOVA) для признаков, промеренных в тепличном опыте, приведен в Таблице 4. Вариация генотипов была очень существенной для всех оцениваемых агрономических признаков и не наблюдалось существенных различий на трех различных дозах азота для всех изученных агрономических признаков, кроме длины метелки. Самая длинная метелка наблюдалась при самой высокой дозе азота, а самая короткая - при самой низкой дозе азота. Густота и генотип×густота взаимодействия были существенными для всех изученных агрономических признаков, кроме длины выхода метелки. Взаимодействие генотип x доза азота было существенно для числа непродуктивных побегов, общего количества побегов и числа зерен в метелке. ANOVA также показал, что генотип x густота x азот взаимодействия были несущественны для всех изученных агрономических признаков.
Сравнения средних значений признаков различных генотипов на различных дозах N и густотах указали на существенные различия среди образцов (Таблица 5). М. 13662 и М. 13684 имели постоянное число продуктивных и непродуктивных побегов, общее число побегов, высоту растения, длину флагового листа, длину метелки, выполненость метелки, пустозерности, общего количества зерен, зерновую продуктивность с растения и длину выхода метелки. Кустящиеся низкорослые мутанты риса (М. 13662 и М. 13684) достоверно отличались от обычных сортов (Cocodrie и Zhe733) по числу продуктивных побегов, числу непродуктивных побегов, общему числу побегов, высоте растения, длине флагового листа, длине метелки, выполненностью метелки зернами, пустозерности, общему числу зерен и длине выхода метелки. Обе мутантных линии сформировали больше побегов, чем обычные сорта. М. 13684 и Cocodrie дали самое большое (51.52) и низкое (2.85) число побегов, соответственно, при трех градациях азота и пяти густотах стояния. Аналогичная тенденция наблюдалась в полевых условиях, но их значения были намного ниже в теплице. Конечное число побегов обоих мутантов было меньше всего затронуто относительно контроля в условии теплицы. Сильное сокращение конечного числа побегов у Cocodrie наблюдалось в теплице по сравнению с полем. М. 13662 и М. 13684 произвели 53.79 % и 42.36 % общего числа побегов при полевых условиях, соответственно в условиях теплицы, но Cocodrie, и Zhe733 произвел только 18.26 % и 19.28 % общего числа побегов при полевых условиях, соответственно. Хотя М. 13662 имел гораздо большее число побегов, чем Cocodrie и Zhe733, наблюдалась тенденция уменьшения числа побегов в теплице по сравнению с полем, как и у стандартных сортов. Cocodrie имел самый высокий процент продуктивных побегов (91.57 %) от их общего количества, в то время как самый низкий был у Zhe733 - 80.91 %. Процент продуктивных побегов обоих мутантов был выше, чем у Zhe733, но ниже чем у Cocodrie. Процент продуктивных побегов Cocodrie и М. 13662 был одинаков для условий поля и теплицы, но доля продуктивных побегов была выше при изменении доз азота и густоты растений у М. 13684 и Zhe733. Высота мутантов и Zhe733 отличалась на 36-38 см и 45-47 см относительно Cocodrie в теплице, но в полевых условиях она варьировала от 40 до 49 см. Растения были 25 %, 28 % и на 6 % более высокорослыми в теплице по сравнению с полем у мутантов, Zhe733 и Cocodrie, соответственно, при различных дозах азотных удобрений и густоте растений. Увеличение высоты растений в теплице могло произойти из-за меньшей конкуренции и более благоприятных окружающих условий. Длина флагового листа мутантов (М. 13662 и М. 13684) была приблизительно на 12-23 % меньше чем, на контроле (Cocodrie и Zhe733). Точно так же длина метелки мутантных линий была на 55-60 % короче, чем контроль, но увеличение длины флагового листа наблюдалось в теплице по сравнению с полевыми условиями для обоих мутантов так же как и для контроля. М. 13662 мутант достоверно отличался от контроля (Cocodrie и Zhe733) по продуктивности с растения (10.32 g), тогда как, самую низкую продуктивность с растения имел сорт Cocodrie (5.87 g). М. 13684 мутант имел статистически такую же зерновую продуктивность как сорта Cocodrie и Zhe733. Хотя у мутанта было мало зерен в метелке, большое число побегов обеспечило компенсацию и, таким образом увеличилась продуктивность с растения в условиях теплицы. Напротив, контроль (Cocodrie и Zhe733) сформировал самую высокую зерновую продуктивность с растения в полевых условиях по сравнению с обоими мутантами (М. 13662 и М. 13684). Это может быть вызвано большим числом продуктивных побегов и озерненностью метелки на контроле в полевых условиях. Две мутантные линии, однако, были одинаковы по продуктивности при всех условиях выращивания (теплица и поле). Способность к кущению растения риса, как известно, воздействует на формирование метелок, которые сильно коррелируют с зерновой продуктивностью (Counce и Wells, 1990; Miller и др., 1991). Существенные различия по высоте растения, длине флагового листа, длине метелки, выполненности и пустозерности метелок наблюдались между Cocodrie и Zhe733, но не по числу продуктивных побегов, числу непродуктивных побегов, общему числу побегов, общему числу зерен в метелке, зерновой продуктивности с растения и длине выхода метелки.
На разных генотипа и дозах азота, самое большое число продуктивных, непродуктивных и всего побегов было получено при одном растении в горошке, и оно уменьшалось при увеличении густоты посева. Об увеличении числа продуктивных побегов при низкой густоте стояния растений также сообщалось в предыдущих исследованиях (Ottis и Talbert, 2005). Уменьшение высоты растения, длины флагового листа, длины метелки, выполнености, пустозерности и общего числа зерен в метелке, а также зерновой продуктивности с растения наблюдалось при более высокой густоте растений по сравнению с низкой густотой стояния растений (Таблица 6). Не было существенных различий при одном и двух растениях в горшке по высоте растения, длине флагового листа, длине метелки, выполнености метелки и общему числу зерен в метелке у разных генотипов при различных дозах азота. Более высокая пустозерность наблюдалась при одном растении горшке, чем при двух растениях. Никаких других существенных различий не наблюдалось при трех, четырех и пяти растениях в горшке по высоте растения, длине флагового листа, длине метелки, выполнености метелки, пустозерности, общему числу зерен и продуктивности метелки. Это может быть вызвано более высокой конкуренцией между растениями при высокой густоте растения.
Таблица 4. Квадраты средств ANOVA показ влияний N-градаций, генотипа, плотности популяции и их взаимодействия на числе производительных побегов, числе непроизводительных побегов, числе полных побегов, высоты растения, длины флагового листа, длины метелки, заполнили метелку зерен 1, незаполненная метелка зерен 1, полная метелка зерен 1, растение зерновой продуктивности 1 и метелка exsertion длина.
|
|
| Число до | производительный ers | Число producti | из побегов non-ve | Оцепенелое общее количество | er illers | Мн hei | nt ght | Fl лист l | ength |
| Источник | df | MSE | Prob F | MSE | Prob F | MSE | Prob F | MSE | Prob F | MSE | Prob F |
| Член палаты представителей (N-градация) | 6 | 93.203 | NS | 74.0787 | ** | 253.701 | NS | 20.8167 | NS | 24.1154 | * |
| N-градация | 2 | 200.917 | NS | 139.973 | NS | 628.047 | NS | 12.2056 | NS | 13.4273 | NS |
| генотип | 3 | 21599 | ** | 966.863 | ** | 31682.3 | ** | 30586.2 | ** | 613.551 | ** |
| густота | 4 | 7479.88 | ** | 448.658 | ** | 11574.6 | ** | 439.689 | ** | 102.096 | ** |
| genotype*density | 12 | 2001.39 | ** | 105.344 | ** | 3008.87 | ** | 111.219 | ** | 33.7122 | ** |
| genotype*N-level | 6 | 150.438 | NS | 94.7489 | ** | 386.064 | ** | 37.6426 | NS | 23.2194 | NS |
| density*N-level | 8 | 79.353 | NS | 23.3215 | NS | 141.249 | NS | 20.4972 | NS | 12.0848 | NS |
| genotype*density*N-level | 24 | 72.5186 | NS | 17.8717 | NS | 92.2979 | NS | 12.5824 | NS | 7.60969 | NS |
t *, ** Существенный в 5 и 1%-ых градациях вероятности, соответственно. NS = Не существенный на 5%-ой градации вероятности. t N-градация: градация Азота. г: Грамм
Таблица 4. (длительный).
|
|
| Метелка | длина | Заполниться зерна | редактор метелка 1 | Незаполненный panicl | зерна e-1 | Папа зерен Tota | l nicle-1 | Зерно y (план г | ield t-1) | Метелка e Lenj | xsertion th |
| Источник | df | MSE | Prob F | MSE | Prob F | MSE | Prob F | MSE | Prob F | MSE | Prob F | MSE | Prob |
| Член палаты представителей (N-градация) | 6 | 1.55188 | NS | 444.374 | ** | 367.365 | NS | 1172.13 | * | 23.1672 | NS | 3.19368 | NS |
| N-градация | 2 | 9.58952 | * | 683.17 | NS | 338.203 | NS | 2367.16 | NS | 48.0291 | NS | 5.65291 | NS |
| генотип | 3 | 1153.23 | ** | 57173.8 | ** | 30224.3 | ** | 120868 | ** | 182.679 | ** | 142.326 | ** |
| густота | 4 | 23.9009 | ** | 1181.4 | ** | 3861.43 | ** | 4024.09 | ** | 1104.78 | ** | 3.49835 | NS |
| genotype*density | 12 | 7.20718 | ** | 363.115 | ** | 2030.09 | ** | 1218.07 | ** | 49.4341 | ** | 5.10321 | NS |
| genotype*N-level | 6 | 2.95 | NS | 188.058 | NS | 296.621 | NS | 1027.19 | * | 23.8629 | NS | 9.10115 | NS |
| density*N-level | 8 | 2.19042 | NS | 169.665 | NS | 163.685 | NS | 510.402 | NS | 15.9108 | NS | 2.68604 | NS |
| genotype*density*N-leve | l 24 | 1.82405 | NS | 180.958 | NS | 281.603 | NS | 224.932 | NS | 13.3422 | NS | 4.83856 | NS |
t *, ** Существенный в 5 и 1%-ых градациях вероятности, соответственно. NS = Не существенный на 5%-ой градации вероятности. t N-градация: градация Азота. г: Грамм
Таблица 5. Средства агрономических признаков очень высокой кустистости и мутантов риса карлика (М. 13662 & М. 13684), Cocodrie и Zhe733 через три градации азота и пять различной густоты растения.
| Генотипы | Число производительных побегов | Число непроизводительных побегов | Число полных побегов | % из производительных побегов | Растение высота (см) | Длина флагового листа (см) | Длина метелки (см) | Заполненный метелка зерен 1 | Незаполненный метелка зерен 1 | Общее количество метелка зерен 1 | Зерновая продуктивность (растение г 1) | Метелка exsertion длина (см) |
| М. 13662 | 39.95a | 7.93a | 47.88a | 83.43 | 63.51c | 25.81c | 12.48c | 17.19c | 13.29c | 30.48b | 10.32a | 1.73b |
| М. 13684 | 42.36a | 9.15a | 51.52a | 82.22 | 63.08c | 25.42c | 12.60c | 11.53c | 17.94c | 29.48b | 8.18ab | 1.94b |
| Cocodrie | 2.61b | 0.23b | 2.85b | 91.57 | 103.15b | 29.11b | 20.18b | 88.57a | 51.96b | 124.66a | 5.87b | 4.55a |
| Zhe733 | 3.90b | 0.91b | 4.82b | 80.91 | 112.73a | 33.38a | 22.20a | 52.00b | 66.43a | 114.22a | 6.38b | 5.21a |
t В пределах позвоночников, средства, сопровождаемые общими строчными буквами, не являются достоверно различными на этих 0.05 градациях. t г: Грамм.
Сравнение средних при разных дозах N, отражающее взаимодействие генотип×густота, показано в Таблице 7. Самые высокие значения продуктивных, непродуктивных и общего числа побегов было у обоих мутантов при самой низкой густоте, и уменьшалось при увеличении густоты посева. Хотя на контроле было статистически то же самое число продуктивных побегов, непродуктивных побегов и общее число побегов, тенденция уменьшения значений каждого признака также наблюдалась (Таблица 7). Эти результаты говорят о том, что способность к кущению обоих мутантов подвергается влиянию со стороны различной густоты растения. О такой же реакции на густоту посева у кустящихся мутантов сообщил Ishikawa и др., (2005). Даже самый кустящийся мутант (Id3) реагировал на густоту посева. Различные густоты посева не оказывали никакого влияния на высоту растения, длину флагового листа, длину метелки, выполненость, пустозерность и озерненость обоих мутантов, но не в случае с контролем (Таблица 7). Различная густота растений оказывала существенное влияние на продуктивность растения у обоих мутантов (М. 13662 и М. 13684) и сорта Zhe733, тогда как сорт Cocodrie не изменял продуктивность при различной густоте растений. Самая высокая продуктивность была достигнута при самой низкой густоте растений у М. 13662 среди четырех генотипов. Самая высокая зерновая продуктивность с растения М. 13662 являлась результатом более высокого процента продуктивных побегов так же как более высокого числа побегов. Сокращение высоты растения, длины флагового листа, длины метелки, числа выполненых зерен в метелке, числа пустых зерен в метелке и общего числа зерен в метелке наблюдалось при более высокой густоте посева у Cocodrie. В предыдущих исследованиях также сообщалось, что, поскольку норма высева риса и плотность метелки увеличивается, происходит снижение выполнености метелки без изменения в урожае (Jones и Synder, 1987; Gravois и Helms, 1992).
При различной густоте растений на общее число побегов у мутантов влияние оказывали различные дозы азота. Отмечено 32%-ое и 40%-ое увеличение числа побегов при более низких дозах азота по сравнению с самой высокой дозой азота у М. 13662 и М. 13684, соответственно. ANOVA указал на несущественные различия по числу продуктивных побегов при трех дозах азота, однако, М. 13662 и М. 13684 сформировали в цифровой отношении самое высокое число продуктивных побегов на средних и низких дозах азота, соответственно. Число продуктивных побегов, непродуктивных побегов и общее число побегов было незатронуто различными градациями азота на контроле (Таблица 8). Формирование непродуктивных побегов у сортов на фоне азота происходит по-разному (Amin и др., 2006). Аналогичные результаты были получены в нашем исследовании относительно азотного удобрения и формирования непродуктивных побегов.
Взаимодействия генотип × дозы азота были не существенны для высоты растения, длины флагового листа, длины метелки, выполнености метелки, пустозерности, продуктивности 1 растения и длины выхода метелки, но были существенными для общего количества зерен в метелке. Самое высокое число зерен в метелке было получено при самой высокой дозе азота на Zhe733, но Cocodrie не подвергся влиянию трех доз азота. Так же и у пшеницы (Triticum aestivum L.), азот увеличивает число зерен в колосе (Khanи др., 2000; Iqtidar и др., 2006).
Таблица 6. Влияния густоты растения, чтобы означать агрономические признаки через четыре генотипа и три градации N.
| Градация густоты | Число производительных побегов | Число непроизводительных побегов | Число полных побегов | % из производительные побеги | Растение высота (см) | Длина флагового листа (см) | Длина метелки (см) | Заполненный метелка зерен 1 | Незаполненный метелка зерен 1 | Общее количество метелка зерен 1 | Зерновая продуктивность (растение г 1) |
| D1 | 46.72a | 10.61a | 57.33a | 81.49 | 89.61a | 30.98a | 17.88a | 50.95a | 52.79a | 86.34a | 16.85a |
| D2 | 22.40b | 4.18b | 26.58b | 84.27 | 89.02a | 29.10ab | 17.59a | 45.47ab | 43.23b | 86.11a | 8.70b |
| D3 | 17.63bc | 3.91b | 21.55bc | 81.80 | 84.52b | 27.81bc | 16.52b | 38.14b | 31.91c | 66.78b | 5.64c |
| D4 | 13.94cd | 2.27b | 16.22cd | 85.94 | 82.86b | 26.56c | 16.11b | 39.03b | 31.08c | 68.72b | 4.14c |
| D5 | 10.33-ий | 1.82b | 12.16d | 84.95 | 82.08b | 27.71bc | 16.22b | 38.01b | 28.01c | 65.59b | 3.10c |
t В пределах позвоночников, средства, сопровождаемые общими строчными буквами, не являются достоверно различными на этих 0.05 градациях. t D1 = 1 горшок растения 1, D2 = 2 горшка растений 1, D3 = 3 горшка растений 1, D4 = 4 горшка растений 1 и D5 = 5 горшков растений 1. г: Грамм
Таблица 7. Работа очень высокой кустистости и мутантов риса карлика, Cocodrie и Zhe733 как под влиянием пяти густоты посева.
| Генотип x густота Растения | Число из производительные побеги | Число непроизводительных побегов | Число из полные побеги | % из производительные побеги | Растение высота (см) | Длина флагового листа (см) | Длина метелки (см) | Заполненный метелка зерен 1 | Незаполненная метелка зерен 1 | Общее количество метелка зерен 1 | Зерновая продуктивность (растение г 1) |
| M-13662*D1 | 89.11a | 18.77a | 107.88a | 82.60 | 62.77f | 27.21def | 12.27e | 18.40f | 13.33e | 31.73e | 22.37a |
| M-13662*D2 | 40.50b | 7.61bc | 48.11b | 84.18 | 64.55f | 27.23def | 13.38e | 20.68f | 12.48e | 33.17e | 12.32cd |
| M-13662*D3 | 30.21bcd | 6.44bc | 36.66bcd | 82.40 | 63.55f | 25.87def | 12.93e | 17.13f | 14.73e | 31.86e | 8.09cdef |
| M-13662*D4 | 22.66cd | 3.69bc | 26.36cde | 85.96 | 62.77f | 24.90ef | 12.34e | 16.62f | 12.38e | 29.01e | 5.60def |
| M-13662*D5 | 17.26def | 3.13bc | 20.40def | 84.60 | 63.88f | 23.86f | 11.50e | 13.13f | 13.51e | 26.64e | 3.19ef |
| M-13684*D1 | 86.00a | 20.33a | 106.33a | 80.88 | 64.77f | 27.74cdef | 13.58e | 16.28f | 18.62e | 34.91e | 20.44ab |
| M-13684*D2 | 42.16b | 8.44b | 50.61b | 83.30 | 64.77f | 26.46def | 12.86e | 14.93f | 17.12e | 32.05e | 9.32cdef |
| M-13684*D3 | 34.84bc | 8.40b | 43.25bc | 80.55 | 62.33f | 25.32ef | 12.57e | 9.84f | 18.00e | 27.84e | 5.15def |
| M-13684*D4 | 28.72bcd | 4.75bc | 33.47bcd | 85.80 | 61.88f | 23.46f | 12.04e | 8.53f | 18.50e | 27.03e | 3.52ef |
| M-13684*D5 | 20.06de | 3.86bc | 23.93de | 83.82 | 61.66f | 24.12ef | 11.92e | 8.08f | 17.46e | 25.55e | 2.48f |
| Cocodrie*D1 | 4.00fg | 0.33c | 4.33fg | 92.37 | 111.11bcd | 35.66a | 23.06a | 108.68a | 101.14a | 146.95ab | 10.42cde |
| Cocodrie*D2 | 2.88fg | 0.16c | 3.05fg | 94.42 | 108.88cd | 29.72bcde | 21.03abc | 92.95ab | 64.30bc | 152.08a | 6.73def |
| Cocodrie*D3 | 2.51 г | 0.25c | 2.77fg | 90.61 | 98.44e | 25.88def | 18.40d | 70.91cd | 32.09de | 94.73-ий | 4.45ef |
| Cocodrie*D4 | 2.00 г | 0.27c | 2.27fg | 88.10 | 98.66e | 26.48def | 18.90cd | 84.22bc | 31.58de | 112.77bcd | 4.15ef |
| Cocodrie*D5 | 1.68 г | 0.15c | 1.82 г | 92.30 | 98.66e | 27.82cdef | 19.49bcd | 86.06bc | 30.68de | 116.75abcd | 3.60ef |
| Zhe733*D1 | 7.77efg | 3.00bc | 10.77efg | 72.14 | 119.77a | 33.31abc | 22.60a | 60.45de | 78.08ab | 131.77abc | 14.17bc |
| Zhe733*D2 | 4.05fg | 0.50c | 4.55fg | 89.01 | 117.88ab | 32.99abc | 23.08a | 53.32de | 79.02ab | 127.13abcd | 6.40def |
| Zhe733*D3 | 2.94fg | 0.55c | 3.51fg | 83.76 | 113.77abc | 34.16ab | 22.18a | 54.70de | 62.82bc | 112.68bcd | 4.87ef |
| Zhe733*D4 | 2.38 г | 0.38c | 2.77fg | 85.92 | 108.11cd | 31.42abcd | 21.18abc | 46.76e | 61.84bc | 106.08cd | 3.30ef |
| Zhe733*D5 | 2.33 г | 0.15c | 2.48fg | 93.95 | 104.11de | 35.05ab | 21.97ab | 44.77e | 50.40cd | 93.42-ой | 3.14ef |
t В пределах позвоночников, средства, сопровождаемые общими строчными буквами, не являются достоверно различными на этих 0.05 градациях. D1 = 1 холм Растения 1, D2 = 2 холма растений 1, D3 = 3 холма растений 1, D4 = 4 растения
холм 1 и D5 = 5 холмов растений 1.
t г: Грамм
Формирование побегов у риса подвержено влиянию со стороны некоторых приемов агротехники, таких как густота посева, но эти приемы не влияют на формирование пазушных почек (Hoshikawa, 1989; Takeda и др., 2003). Отдельные пазушные почки остаются в состоянии покоя при высокой густоте посева. Число побегов на растении у мутантов действительно значительно изменялось при различных условиях роста (азот и густота). Напротив, другие агрономические признаки, такие как высота мутантных растений, не были затронуты различными градациями густоты растений или доз азота. Приняв, что рецессивный ген управляет и высотой растения и способностью к кущению, следует, что экспрессия гена для признаков кущения может быть изменена в зависимости от условий роста или может быть есть другие модификаторы, которые способствуют кущению, но их роль в управлении высотой постоянна. Предыдущие исследователи указали, что некоторые QTLs для кустистости мог влиять на высоту растения (Wu. P, 1996; Yan и др. 1998). Takeda и др. (2003) заключил, что у риса могут быть дополнительные факторы (гены) кроме OsTB 1, которые отрицательно регулируют боковое ветвление или может есть некоторый положительный регулятор, который стимулирует пазушные почки. Один из двух или оба (факторы и регуляторы) могут участвовать в регуляции механизма кущения, в зависимости от густоты посева. Эти новые мутанты, поэтому, могли быть важным генетическим ресурсом, для изучения молекулярной природы кустистости у риса и других злаков.
Таблица 8. Работа очень высоких кустящихся мутантов риса карлика, Cocodrie и Zhe733 как под влиянием трех градаций азота.
| Генотип x градация Азота | Число производительных побегов | Число непроизводительных побегов | Число полных побегов | % из производительные побеги | Растение высота (см) | Длина флагового листа (см) | Длина метелки (см) | Заполненный метелка зерен 1 | Незаполненный метелка зерен 1 | Общее количество метелка зерен 1 | Зерновая продуктивность (растение г 1) |
| M-13662*N1 | 38.64a | 8.01bc | 46.66abc | 82.81 | 64.53c | 26.27cd | 12.56d | 15.94c | 13.01d | 28.96c | 9.04ab |
| M-13662*N2 | 46.14a | 9.04abc | 55.18ab | 83.61 | 62.33c | 24.66d | 12.30d | 18.06c | 13.05d | 31.12c | 12.84a |
| M-13662*N3 | 35.06a | 6.73bcd | 41.80c | 83.87 | 63.66c | 26.51cd | 12.59d | 17.57c | 13.80d | 31.38c | 9.07a |
| M-13684*N1 | 45.61a | 13.93a | 59.54a | 76.6 | 62.13c | 23.36d | 12.60d | 11.44c | 17.44d | 28.88c | 8.09ab |
| M-13684*N2 | 42.57a | 9.88ab | 52.45abc | 81.16 | 62.86c | 26.38cd | 12.10d | 11.29c | 17.63-ий | 28.92c | 9.08ab |
| M-13684*N3 | 38.90a | 3.65cde | 42.55bc | 91.42 | 64.26c | 26.52cd | 13.08d | 11.88c | 18.74d | 30.62c | 7.36b |
| Cocodrie*N1 | 2.59c | 0.10e | 2.70d | 95.92 | 102.53b | 29.09bc | 19.95c | 83.23a | 45.93c | 112.21ab | 5.56b |
| Cocodrie*N2 | 2.66c | 0.34e | 3.00d | 88.66 | 104.93b | 29.39bc | 20.21bc | 87.40a | 55.68bc | 134.38a | 5.74b |
| Cocodrie*N3 | 2.59c | 0.26e | 2.85d | 90.87 | 102.00b | 28.85bc | 20.38bc | 95.08a | 54.27bc | 127.38a | 6.30b |
| Zhe733*N1 | 3.38c | 0.77e | 4.16d | 81.25 | 112.86a | 34.04a | 21.38bc | 44.38b | 66.56ab | 101.17b | 4.69b |
| Zhe733*N2 | 3.96c | 1.32de | 5.29d | 74.85 | 110.80a | 32.08ab | 21.98ab | 54.34b | 59.06abc | 110.53ab | 6.83b |
| Zhe733*N3 | 4.35c | 0.65e | 5.01d | 86.82 | 114.53a | 34.03a | 23.25a | 57.28b | 73.68a | 130.96a | 7.61ab |
t В пределах позвоночников, средства, сопровождаемые общими строчными буквами, не являются достоверно различными на этих 0.05 градациях. N1 = 179-килограммовый га 1, N2 = 202-килограммовый га 1 и N3 = 224-килограммовый га 1. t г: Грамм.
ГЛАВА V
РЕЗЮМЕ И ЗАКЛЮЧЕНИЯ
Кустистость и высота в рисе - важные агрономические признаки, которые определяют потенциал урожая конкретного сорта. Способность к кущению подвержена влиянию со стороны окружающих условий, таких как свет, температура, густота растений, обеспеченность питательными веществами и генотип. Шестнадцать сильно кустящихся и низкорослых мутантных линий риса наряду с Cocodrie, и Zhe733 (контроль) были посеяны на полях Texas AgriLife Research and Extension Center, Бомонт, Техас. Фенотипическая характеристика была сделана для всех мутантных линий. Две мутантных линии (М. 13662 и М. 13684) были отобраны, для определения влияния трех различных доз азота, и пяти различных густот посева на различные агрономические признаки и влияния обработки GA на удлинение второго влагалища листа. Скрещивания, включая реципрокные, были сделаны с Cocodrie, с целью определения характера наследования гена, управляющего высокой кустистостью и низкорослостью у мутантов. Новые мутанты риса характеризовались низкорослостью (50-55 см) и кустистым фенотипом вследствие хорошего формирования побегов (89-121 побегов/растении). Уменьшение удлинения четырех верхних междоузлий и сжатие 2-3 междоузлий в основании приводит к низкорослости. Мутанты риса были подобны d мутантам с точки зрения высоты растения (40-65 см). Мутантные линии произвели побеги быстрее, чем обычные полукарликовые сорта. Первый побег у мутанта появился на стадии 4-го листа, тогда как, ни один побег не наблюдался у Cocodrie в эту стадию. Первая активная боковая почка на первом влагалище листа в стадии 3-х листьев мутанта наблюдалась в этом исследовании. Активные почки находились в каждом листовом влагалище листа до стадии 7-ми листьев у обоих мутантов и Cocodrie, но только 2-3 боковых почки в главной соломине мутантов были в состоянии сформировать первичные побеги. Интенсивность формирования побегов удваивалась каждую неделю, в течении семи недель после появления первого побега, но интенсивность формирования побегов была ниже между 13 и 16 неделями после появления первого побега. Однако, после этого периода, мутанты начали формировать побеги по интенсивности, подобной, что и в течение первых семи недель после появления, что привело к тому, что конечное число побегов, было почти 6-8 раз и 4-5 раз больше чем число побегов у Cocodrie и Zhe733, соответственно. У Cocodrie и Zhe733, формирование новых побегов стало постоянным после стадии инициирования метелки, но мутанты продолжали формировать новые побеги даже на последней репродуктивной стадии. Мутанты опаздывали с выметыванием и созреванием по сравнению с контролем (Cocodrie и Zhe733) и не вызрели 26 дней спустя. Метелки были очень коротки (12-13 см) с небольшим числом зерен (25-30) по сравнению с контролем. Так как у мутанта было небольшое количество зерен, более короткая высота растения и продолжительный период налива зерна, и листья остались зелеными к уборке, большая часть мобильных углеводов, белка и минеральных питательных веществ из различных источников вероятно не транспортировалась и оставалась в стебле и листьях. Эти ресурсы вероятно использовались, чтобы сформировать большое количество побегов даже на последней репродуктивной стадии. Вообще, признаки низкорослости и высокой кустистости связаны у всех кустистых низкорослых мутантов риса, аналогичная связь признаков наблюдалась у наших мутантов риса. Полевой опыт и дизруктивный отбор свидетельствуют, что формирование большого числа побегов было результатом выхода пазушных почек из состояния покоя, а не инициирования дополнительных пазушных почек. У каждого побега мутанта была способность служить материнским побегом для дальнейшего формирования побегов, тогда как только главная стебель, первичные и вторичные побеги растений обычного типа дали новые побеги. Уменьшение апикального доминирования могло бы быть одним из факторов, приводящих к низкорослости кустистых и низкорослых мутантов риса. Другие агрономические признаки, такие как длина флагового листа, длина метелки, выполненость, озерненность, размер семени и масса 1000 семян, как установленно, была ниже по сравнению с контролем. Мутанты были отнесены в категорию с длинной зерновкой, на основе отношения ширины и длины семени ( 3.00:1). У мутанта были общие черты с d мутантами (d3, d10, d14, d1 и d27) с ранних стадий развития с позиции большого числа тонких побегов, низкорослости и маленького размера зерна. Однако, среднее сокращение четырех верхних междоузлий, наблюдаемое у сильно кустящихся и низкорослых мутантов риса, указало на сходство с htd-1 мутантом. Характер удлинения междоузлий мутантов аналогичен карлику dn-типа, основываясь на классификации Тэкеды, но у нескольких растений были отличные типы карликовости, которые не были включены в классификацию.
При различной густоте и дозах N, оба мутанта риса (М. 13662 и М. 13684) были схожи, но достоверно отличались от обычных сортов риса с геном полукарликовости sd-1 (Cocodrie и Zhe733) по всем изученным агрономическим признакам. Пять вариантов густоты посева так же как три различных дозы азота влияли на способность к кущению мутантов. Больше побегов (продуктивных, не продуктивных и их общее число) наблюдалось при 179-кг/га. Не было существенных различий, между 179 и 202-кг/га для общего числа побегов. Различная густота посева так же как доза азота не влияла на высоту мутантов (М. 13662 и М. 13684). Изменение в длине флагового листа, длине метелки, выполнености, пустозерности и озерненности не были существенными для различной густоты посева и дозы азота у обоих мутантов, но продуктивность растения была очень существенной для обоих мутантов и сорта Zhe733.
Оба мутанта считались GA отзывчивыми, основываясь на биоанализе GA. Отношение расщепления популяций F2 показало, что признаками высокой кустистости и низкорослости вероятно управлял один рецессивный ген.
У различного рода мутантов риса есть важная роль в формировании основ исследований генетического анализа и функциональной геномики, а сотни сильно кустящихся и низкорослых мутантов риса включены в коллекцию мутантов. Однако, большинство из них не охарактеризовано (Ishikawa и др., 2005). Исследования показали, что кустистость риса - сложный процесс и управляется он генами и QTL (Miyamoto и др., 2004; Ishikawa и др., 2005; Zou и др., 2005). Идентификация, характеристика и генетический анализ новых мутантов - начальные шаги, чтобы объяснить молекулярный механизм и генетические отношения, связанные с выражением признаков у мутантов. Характеристика высококустящегося низкорослого мутанта будет важна в понимании механизмов, которые управляют формированием побегов у риса или ветвлением побега у других хлебных злаков. Такая характеристика может также помочь выявить механизмы, участвующие в определение высоты растения у риса и их взаимоотношения с ростом и развитием побегов.
ССЫЛКИ
Amin, M.R., A. Hamid, R.U. Choudhury, S.M. Raquibullah, and M. Asaduzzaman. 2006. Nitrogen fertilizer effect on tillering, dry matter production and yield of traditional varieties of rice. Int. J. Sustain. Crop Prod. 1:17–20.
Arite, T., H. Iwata, K. Ohshima, M. Maekawa, M. Nakajima, M. Kojima, H. Sakakibara, and J. Kyozuka. 2007. DWARF10, an RMS1/MAX4/DAD1 ortholog, controls lateral bud outgrowth in rice. Plant J. 51:1019–1029.
Ashikari, M., J. Wu, M. Yano, T. Sasaki, and A. Yoshimura. 1999. Rice gibberellinin sensitive dwarf mutant gene Dwarf 1 encodes the alpha-subunit of GTP-binding protein. Proc. Natl. Acad. Sci. USA. 96:10284–10289.
Bacon, P.E., and L.G. Lewin. 1990. Rice growth under different stubble and nitrogenfertilization management techniques. Field Crops Res. 24:51–65.
Baligar, V.C., and N.K. Fageria. 1997. Nutrient use efficiency in acid soils: Nutrient management and plant use efficiency. p. 75–95. In A.C. Moniz et al. (ed.) Plant-Soil Interactions at low pH: Sustainable agriculture and forestry production. Brazilian Soil Science Society Compinan, Brazil.
Baloch, M.S., I.U. Awan, and G. Hassan. 2006. Growth and yield of rice as affected by transplanting dates and seedlings per hill under high temperature of Dera Ismail Khan, Pakistan. J. Zhejiang Univ. Sci. 7:572–579.
Becker, M., J.K. Ladha, and J.C.G. Ottow. 1994. Nitrogen losses and lowland rice yield as affected by residue nitrogen release. Soil Sci. Soc. Am. J. 58:1660–1665.
Black, A.L., and F.H. Siddoway. 1977. Hard red and durum spring wheat responses to seeding date and NP-fertilization on fallow. Agron. J. 69:885–887.
Bohlool, B.B., J.K. Ladha, D.P. Garrity, and T. George. 1992. Biological nitrogen fixation for sustainable agriculture: A perspective. Plant Soil. 141:1–11.
Bond, J.A., J.P. Leonards, R.P. Regan, and D.M. Walker. 2006. Rice agronomy. p. 104–226, In 97th Annual Res. Rep. Rice Res. Stn., La. Agric. Exp. Stn., Baton Rouge, LA.
Bond, J.A., T.W. Walker, B.V. Ottis, and D.L. Harrell. 2008. Rice seedling and nitrogen rate effects on yield and yield components of two rice cultivars. Agron. J. 100:393–397.
Bowman, J.L., and Y. Eshed. 2000. Formation and maintenance of the shoot apical meristems. Trends Plant Sci. 5:110–115.
Castillo, E.G., R.J. Buresh, and K.T. Ingram. 1992. Lowland rice yield as affected by timing of water deficit and nitrogen fertilization. Agron. J. 84:152–159.
Catterou, M., F. Dubois, R. Smets, S. Vaniet, T. Kichey, H.V. Onckelen, B.S. Sangwan-Norreel, and R.S. Sangwan. 2002. hoc: an Arabidopsis mutant overproducing cytokinins and expressing high in-vitro organogenic capacity. Plant J. 30:273–287.
Chaudhury, A.M., S. Letham, S. Craig, and E.S. Dennis. 1993. amp1 – a mutant with high cytokinin levels and altered embryonic pattern, faster vegetative growth, constitutive photomorphogenesis and precocious flowering. Plant J. 4:907–916.
Childs, N. 2007. Rice situation and outlook yearbook [Online]. Available at http://usda.mannlib.cornell.edu/MannUsda/viewDocumentInfo.do?documentID=1285
(verified 10 May. 2008).
Counce, P.A., T.C. Keisling, and A. J. Mitchell. 2000. A uniform, objective, and adaptive system for expressing rice development. Crop Sci. 40:436–443.
Counce, P.A., and B.R. Wells. 1990. Rice plant population density effect on earlyseason nitrogen requirement. J. Prod. Agric. 3:390–393.
Counce, P.A., B.R. Wells, and K.A. Gravois. 1992. Yield and harvest index responses to preflood nitrogen fertilization at low rice plant populations. J. Prod. Agric. 5:492–497.
Cubas, P., N. Lauter, J. Doebley, and E. Coen. 1999. The TCP domain: A motif found in proteins regulating plant growth and development. Plant J. 18:215–222.
Dalling, M.J. 1985. The physiological basis of nitrogen redistribution during filling in cereals. p. 55–71. In J.E. Harper et al. (ed.) Exploitation of physiological and genetic variability to enhance crop productivity. Am. Soc. of Plant Physiologists, Rockville, MD.
Doebley, J., A. Stec, and C. Gustus. 1995. Teosinte branched1 and the origin of maize: Evidence for epistasis and the evolution of dominance. Genetics. 141:333–346.
Doebley, J., A. Stec, and L. Hubbard. 1997. The evolution of apical dominance in maize. Nature. 386:485–488.
Dofing, S.M., and C.W. Knight. 1994. Yield component compensation in uniculm barley lines. Agron. J. 86:273–276.
Done, A.A., and W.J. Whittington. 1980. Effect of plant density and nitrogen on wheat F1 hybrids and their parents. Ann. Appl. Biol. 95:391–398.
Fageria, N.K. 2007. Yield physiology of rice. J. Plant Nutr. 30:843–879.
Fageria, N.K., and V.C. Baligar. 1996. Response of lowland rice and common bean grown in rotation to soil fertility levels on a Varzea soil. Fert. Res. 45:13–20.
Fageria, N.K., and V.C. Baligar. 1999. Yield and yield components of lowland rice as influenced by timing of nitrogen fertilization. J. Plant Nutr. 22:23–32.
Fageria, N. K., and V.C. Baligar. 2001. Lowland rice response to nitrogen fertilization. Commun. Soil Sci. Plan. 32:1405–1429.
Fageria, N.K., N.A. Slaton, and V.C. Baligar. 2003. Nutrient management for improving lowland rice productivity and sustainability. Adv. Agron. 80:63–152.
Ghosh, M., B.K. Mandal, B.B. Mandal, S.B. Lodh, and A.K. Dash. 2004. The effect of planting date and nitrogen management on yield and quality of aromatic rice (Oryza sativa). J. Agr. Sci. 142:183–191.
Goos, R.J., and B.E. Johnson. 2001. Response of spring wheat to phosphorus and sulfur starter fertilizers of differing acidification potential. J. Agric. Sci. 136:283–289.
Goto, Y., M. Tanabe, T. Ishibashi, N. Tsutsumi, A. Yoshimura, and K. Nemoto. 2005. Tillering behavior of the rice fine culm 1 mutant. Plant Prod. Sci. 8:68–70.
Gravois, K.A., and R.S. Helms. 1992. Path analysis of rice yield and yield components as affected by seeding rate. Agron. J. 88:1–4.
Hanada, K. 1995. Differentiation and development of tiller buds. p. 61-65. In T. Matsuo et al. (ed.) Science of the rice plant: Physiology. Vol. 2. Food and Agriculture Policy Research Center. Tokyo.
Hayashi, H. 1995. Translocation, storage and partitioning of photosynthetic products. p. 546-565. In T. Matsuo et al. (ed.) Science of the rice plant: Physiology. Vol. 2. Food and Agriculture Policy Research Center. Tokyo.
He, Z. & Li, D.B. 1996. Sensitivity of plant height genes to gibberellic acid and their regulation by endogenous plant hormones in rice. IRRN. 21:22–23.
Hirochika, H., E. Guiderdoni, A. Gynheung, Y.I. Hsing, M.Y. Eun, C.D. Han, N. Upadhyaya, S. Ramachandran, Q. Zhang, A. Pereira, V. Sundaresan, and H. Leung. 2004. Rice mutant resources for gene discovery. Plant Mol. Biol. 54:325–334.
Hong, Z., M. Ueguchi-Tanaka, K. Umemura, S. Uozu, S. Fujioka, S. Takatsuto, S. Yoshida, M. Ashikari, H. Kitano, and M. Matsuoka. 2003. A rice brassinosteroid deficient mutant, ebisu dwarf (d2), is caused by a loss of function of a new member of cytochrome P450. Plant Cell. 15:2900–2910.
Hoshikawa, K. 1989. The growing rice plant: An anatomical monograph. Nobunkyo, Tokyo, Japan.
Huang, N., B. Courtois, and G.L. Wang. 1996. Association of quantitative trait loci for plant height with major dwarfing genes in rice. Heredity. 77:130–137.
Hubbard, L., P. McSteen, J. Doebley, and S. Hake. 2002. Expression patterns and mutant phenotype of teosinte branched1 correlate with growth suppression in maize and teosinte. Genetics. 162:1927–1935.
Hucl, P., and R.J. Baker. 1989. Tiller phenology and yield of spring wheat in a semi-arid environment. Crop Sci. 29:631–635.
International Rice Research Institute (IRRI). 1967. Early research and training results. p. 103-117. In History of International Rice Research Institute. [Online]. Available at http://www.irri.org/publications/chandler/pdfs/chap4a.pdf (verified 10 May. 2008).
Iqtidar, H., K. M. Ayyaz, and K.E. Ahmad. 2006. Bread wheat varieties as influenced by different nitrogen levels. J. Zhejiang Univ. Sci. B. 7:70–78.
Ishikawa, S., M. Maekawa, T. Arite, K. Ohnishi, I. Takamure, and J. Kyozuka. 2005. Suppression of tiller bud activity in tillering dwarf mutants of rice. Plant Cell Physiol. 46:79–86.
Itoh, J.I., K.I. Nonomura, and K. Ikeda. 2005. Rice plant development from zygote to spikelet. Plant Cell Physiol. 46:23–47.
Jennings, P.R. 1964. Plant type as a rice breeding objective. Crop Sci. 4:13–15.
Jones, D.B., and G.H. Snyder. 1987. Seeding rate and row spacing effects on yield and yield components of drill-seeded rice. Agron. J. 79:623–626.
Khan, M.A., I. Hussain, and M.S. Baloch. 2000. Wheat yield potential current status and future strategies. Pak. J. Bio. Sci. 3:82–86.
Khush, G.S. 1999. Green revolution: Preparing for the 21st centuary. Genome. 42:646–655.
Khush, G.S. 2005. What it will take to feed 5.0 billion rice consumers in 2030. Plant Mol. Biol. 59:1–6.
Kinoshita, T., and M. Takahashi. 1991. The one hundredth report of genetic studies on rice plant. J. Fac. Agr. Hokkaido Univ. 65:1–61.
Komatsu, K., M. Maekawa, S. Ujiie, Y. Satake, I. Furutani, H. Okamoto, K. Shimamoto, and J. Kyozuka. 2003. LAX and SPA: Major regulators of shoot branching in rice. Proc. Natl. Acad. Sci. USA. 100:11765–11770.
Li, Y.-H. 1979. Morphology and Anatomy of Grass Family Crops. Shanghai Science and Technology Press, Shanghai.
Li, X., Q. Qian, Z. Fu, Y. Wang, G. Xiong, D. Zeng, X. Wang, X. Liu, S. Teng, F. Yuan, M. Hiroshi, D. Luo, B. Han, and J. Li. 2003. Control of tillering in rice. Nature. 422:618–621.
Liu, D. 1991. Efficient use of nitrogen in crop production. Ext. Bull. 340. Food & Fertilizer Technology Center, Taiwan.
Mae, T. 1997. Physiological nitrogen efficiency in rice: Nitrogen utilization, photosynthesis, and yield potential. Plant Soil. 196:201–210.
Manzoor, Z., T.H. Awan, M.E. Safdar, R.I. Ali, M.M. Ashraf, and M. Ahmad. 2006. Effect of nitrogen levels on yield and yield components of Basmati 2000. J. Agric. Res. 44:115–122.
Matsukura, C., S.I. Itoh, K. Nemoto, E. Tanimoto, and J. Yamaguchi. 1998. Promotion of leaf sheath growth by gibberellic acid in a dwarf mutant of rice. Planta. 205:145–152.
McClung, A.M., R.G. Fjellstrom, C.J. Bergman, C.A. Bormans, W.D. Park, and M.A. Marchetti. 2004. Registration of ‘Saber’ Rice. Crop Sci. 44:693–694.
Miller, B.C., J.E. Hill, and S.R. Roberts. 1991. Plant population effects on growth and yield in water-seeded rice. Agron. J. 83:291–297.
Mitsunaga, S., T. Tashiro, and J. Yamaguchi. 1994. Identification and characterization of gibberellin-insensitive mutants selected from among dwarf mutants of rice. Theor. Appl. Genet. 87:705–712.
Miyamoto, N., Y. Goto, M. Matsui, Y. Ukai, M. Morita, and K. Nemoto. 2004. Quantitative trait loci for phyllochron and tillering in rice. Theor. Appl. Genet. 109:700–706.
Mona, L., N. Kitazawa, R. Yoshino, J. Suzuki, H. Masuda, Y. Maehara, M. Tanji, M. Sato, S. Nasu, and Y. Minobe. 2002. Positional cloning of rice semi-dwarfing gene, sd-1: Rice green revolution gene encodes a mutant enzyme involved in gibberellin synthesis. DNA Res. 9:11–17.
Mossedaq, F., and D.H. Smith. 1994. Timing nitrogen application to enhance spring wheat yields in a Mediterranean climate. Agron. J. 86:221–226.
Murakami, H. 1968. A new rice seedling test for gibberellins, microdrop method and its use for testing extracts of rice and morning glory. Bot. Mag. Tokyo. 81:33–43.
Murayama, N. 1995. Development and senescence of an individual plant. p. 119–178. In Matsuo et al. (ed.) Science of the rice plant: Physiology, Vol 2. Food and Agriculture Policy Research Center, Tokyo.
Norman, R.J., C.E. Wilson, Jr. N.A. Slaton, D.L. Frizzell, M.W. Duren, D.L. Boothe, K.A.K. Moldenhauer, and J.W. Gibbons. 2005. Grain yield response of eight rice cultivars to nitrogen fertilizer. p. 294–304. In R.J. Norman et al. (ed.) B.R. Wells rice research studies, 2004. Res. Ser. 529. Univ. of Arkansas Agric. Exp. Stn., Fayetteville, AR.
Nuruzzaman, M., Y. Yamamoto, T. Yoshida, Y. Nitta, and A. Miyazaki. 2000. Behavior of primary, secondary and tertiary tillers in two high tillering rice varieties, IR36 and Suweon 258, under different planting densities. Jpn. J. Trop. Agr. 44:94–106.
Ottis, B.V., and R.E. Talbert. 2005. Rice yield components as affected by cultivar and seedling rate. Agron. J. 97:1622–1625.
Peng, J., D.E. Richards, N.M. Hartley, G.P. Murphy, K.M. Devos, J.E. Flintham, J. Beales, L.J. Fish, A.J. Worland, F. Pelica, D. Sudhakar, P. Christou, J.W. Snape, M.D. Gale, and N.P. Harberd. 1999. ‘Green revolution’ genes encode mutant gibberellin response modulators. Nature. 400:256–261.
Phinney, B.O. 1956. Growth response of single-gene dwarf mutants in maize to gibberellic acid. Genetics. 42:185–189.
Saito, M. 1991. Soil management for the conservation of soil nitrogen. Ext. Bull. 341. Food & Fertilizer Technology Center, Taiwan.
Sakamoto, T., K. Miura, H. Itoh, T. Tatsumi, M. Ueguchi-Tanaka, K. Ishiyama, M. Kobayashi, G.K. Agrawal, S. Takeda, K. Abe, A. Miyao, H. Hirochika, H. Kitano, M. Ashikari, and M. Matsuoka. 2004. An overview of gibberellin metabolism enzyme genes and their related mutants in rice. Plant physiol. 134:1642–1653.
Santos, A.B., N.K. Fageria, and A.S. Prabhu. 2003. Rice ratooning management practices for higher yields. Commun. Soil Sci. Plan. 34:881–918.
Sall, J., L. Creighton, and A. Lehman. 2005 . JMP start statistics. Third edition. SAS Institute.
Sasaki, A., M. Ashikari, M. Ueguchi-Tanaka, H. Itoh, A. Nishimura, D. Swapan, K. Ishiyama, T. Saito, M. Kobayashi, G.S. Khush, H. Kitano, and M. Matsuoka. 2002. Green revolution: A mutant gibberellin-synthesis gene in rice. Nature. 416:701–702.
Sauter, M., S.L. Mekhedov, and H. Kende. 1995. Gibberellin promotes histone H1 kinase activity and the expression of cdc2 and cyclin genes during the induction of rapid growth in deepwater rice internodes. Plant J. 7:623–632.
Schnier, H.F., M.F. Dingkuhn, S.K. De Datta, K. Mengel, and J.E. Faronilo. 1990. Nitrogen fertilization of direct-seeded flooded vs. transplanted rice: I. Nitrogen uptake, photosynthesis, growth, and yield. Crop Sci. 30:1276–1284.
Schumacher, K., T. Schmitt, M. Rossberg, G. Schmitz, and K. Theres. 1999. The lateral suppressor (Ls) gene of tomato encodes a new member of the VHIID protein family. Proc. Natl. Acad. Sci. USA. 96:290–295.
Shimizu-Sato, S., and H. Mori. 2001. Control of outgrowth and dormancy in axillary buds. Plant Physiol. 127:1405–1413.
Sorefan K., J. Booker, K. Haurogne, M. Goussot, K. Bainbridge, E. Foo, S. Chatfield, S. Ward, C. Beveridge, C. Rameau, and O. Leyser. 2003. MAX4 and RMS1 are orthologous dioxygenase-like genes that regulate shoot branching in Arabidopsis and pea. Genes Dev. 17:1469–1474.
Spielmeyer, W., M.H. Ellis, and P.M. Chandler. 2002. Semidwarf (sd-1) “ green revolution” rice, contains a defective gibberellin 20-oxidase gene. Proc. Natl. Acad. Sci. USA. 99:9043–9048.
Stevens, G., S. Hefner, and T. Gladbach. 2001. Effect of nitrogen timing and rates on tillering and yield of no-till water-seeded rice. Commun. Soil Sci. Plan. 32:421–432.
Stirnberg, P., S.P. Chatfield, and H.M. Leyser.1999. AXR1 acts after lateral bud formation to inhibit lateral bud growth in Arabidopsis. Plant Physiol. 121:839–847.
Strong, W.M. 1986. Effects of nitrogen application before sowing compared with effects of split applications before and after sowing for irrigated wheat on the Darling Down. Aust. J. Exp. Agric. 26:201–207.
Takahashi, N. 1984. Differentiation of ecotypes in Oryza sativa L. p. 31–67. In S. Tsunoda and N. Takahashi (ed.) Biology of rice. Japan Scientific Societies Press, Elsevier, Amsterdam.
Takahashi, M.E., and K. Takeda. 1969. Type and grouping of internode pattern in rice culm. (Genetical Studies on rice plant, XXXVII). Memoirs Fac. Agr. Hokkaido Univ. 7:32–43.
Takeda, K. 1975. Some characters expressed as inter-relationships between the development of organs. Recent Advancement of the Breeding Science. Report of Symposium of Japan Soc. Breed. 16:55–59.
Takeda, K. 1977. Internode elongation and dwarfism in some gramineous plants. Gamma Field Sym. 16:1–18.
Takeda, T., Y. Suwa, M. Suzuki, H. Kitano, M. Ueguchi- Tanaka, M. Ashikari, M. Matsuoka, and C. Ueguchi. 2003. The OsTB1 gene negatively regulates lateral branching in rice. Plant J. 33:513–520.
Tanaka, A., S.A. Navasero, C.V. Garcia, F.T. Parao, and E. Ramirez. 1964. Growth habit of the rice plant in the tropics and its effect on nitrogen response. Tech Bull. 3. Intl. Rice Research Inst., Manila, Los Banos, Philippines.
Thimann, K., and F. Skoog. 1933. Studies on the growth hormone of plants. III. The inhibiting action of the growth substance on bud development. Proc. Natl Acad. Sci. USA. 19:714–716.
Virmani, S.S., and H.L. Sharma. 1993. Manual for hybrid rice seed production [Online]. Available at http://www.knowledgebank.irri.org/hybridriceseed/print.doc (verified 10 May. 2008).
Wada, G., S. Shoji, and T. Mae. 1986. Relation between nitrogen absorption, growth, and yield of rice plants. J.A.R.Q. 20:135–145.
Wang, Y., and J. Li. 2005. The plant architecture of rice (Oryza sativa). Plant Mol. Biol. 59:75-84.
Ward, S.P., and O. Leyser. 2004. Shoot branching. Curr. Opin. Plant Biol. 7:173–78.
Weerakoon, M.W., D.M. Olszyk, and D.N. Moss. 1999. Effects of nitrogen nutrition on responses of rice seedlings to carbon dioxide. Agr. Ecosyst. Environ. 72:1–8.
Wells, B.R., and W.F. Faw. 1978. Short-statured rice response to seeding and N-rates. Agron. J. 70:477–480.
Wu, P. 1996. Analysis of the genetic relativity between plant height and tillering of rice using the RFLP markers. Sci. China Ser. C. 26:264–270.
Wu, G., L.T. Wilson, and A.M. McClung. 1998. Contribution of rice tillers to dry matter accumulation and yield. Agron. J. 90:317–323.
Yamamuro, C., Y. Ihara, X. Wu, T. Noguchi, S. Fujioka, S. Takatsuto, M. Ashikari, H. Kitano, and M. Matsuoka. 2000. Loss of function of a rice brassinosteroid insensitive1 homolog prevents internode elongation and bending of the lamina joint. Plant Cell. 12:1591–1606.
Yan, J.Q., J. Zhu , C.X. He, M. Benmoussa, and P. Wu. 1998. Quantitative trait loci analysis for the developmental behavior of tiller number in rice (Oryza sativa L.). Theor. Appl. Genet. 97:267–274.
Yoshida, S. 1981. Fundamentals of rice crop science. Int. Rice Research Inst, Manila, Philippines.
Zou, J., Z. Chen, S. Zhang, W. Zhang, G. Jiang, X. Zhao, W. Zhai, X. Pan, and L. Zhu. 2005. Characterizations and fine mapping of a mutant gene for high tillering and dwarf in rice (Oryza sativa L.). Planta. 222:604–612.
Zou, J., S. Zhang, W. Zhang, G. Li, Z. Chen, W. Zhai, X. Zhao, X. Pan, Q. Xie, and L.
Zhu. 2006. The rice HIGH TILLERING DWARF1 encoding an ortholog of Arabidopsis MAX3 is required for negative regulation of the out-growth of axillary buds. The Plant Journal. 48:687–696.














