Просмотр содержимого документа
«Щелочные металлы»

муниципальное казенное общеобразовательное учреждение «Щученская средняя общеобразовательная школа» Лискинского района Воронежской области
Презентация
Урок химии в 9 классе
« Щелочные металлы»
Подготовила Пащенко Галина Владимировна

Электронное строение
4s 1
8
1
2
8
3p 6
3s 2
2p 6
2s 2
1s 2
Краткая электронная запись -
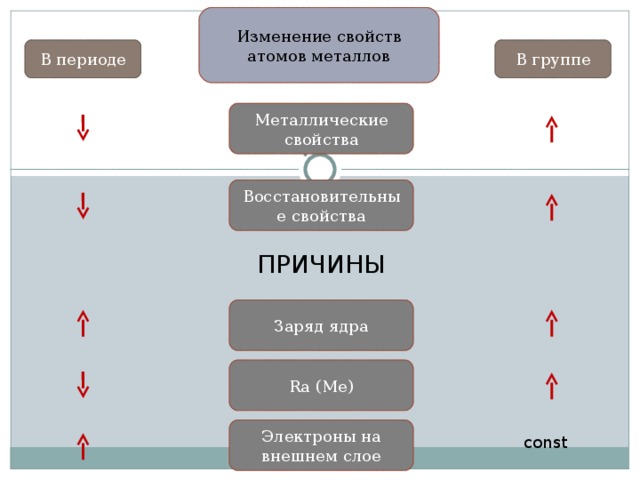
Изменение свойств атомов металлов
В группе
В периоде
Металлические свойства
Восстановительные свойства
ПРИЧИНЫ
Заряд ядра
R а ( Me)
Электроны на внешнем слое
const

И. АРФВЕДСОН
1817г
Li
от греч. литос - камень

Й. Берцелиус
Na
от араб. натрун – сода
От араб. алкали - щелочь
K
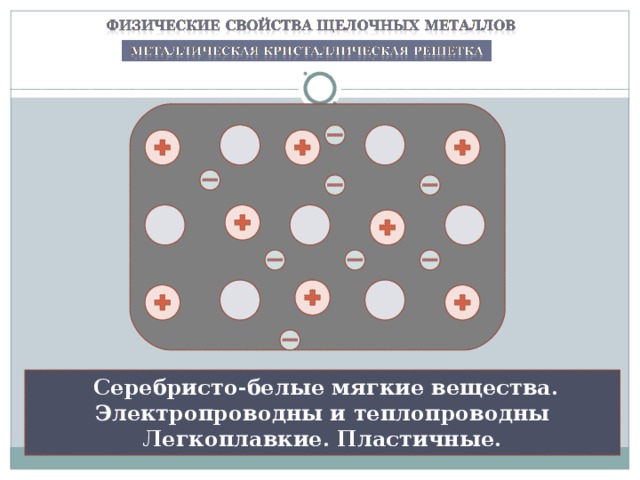
Серебристо-белые мягкие вещества.
Электропроводны и теплопроводны
Легкоплавкие. Пластичные.

РЯД АКТИВНОСТИ МЕТАЛЛОВ / ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Bi Cu Hg Ag Pt Au
NaCl – поваренная (каменная) соль
Na 2 SO 4 * 10H 2 O – глауберова соль
NaCl*KCl – сильвинит
KCl * MgCl 2 *6H 2 O – карналлит
Na +
Cl -
Na +
Cl -
Cl -
Na +
Na +
Cl -
NaCl → Na + + Cl -
2NaCl → 2Na + Cl 2
каменная
карналлит
сильвинит
глауберова
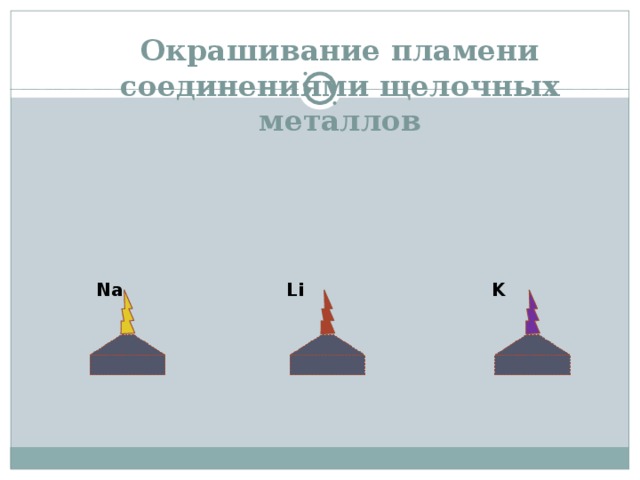
Окрашивание пламени соединениями щелочных металлов
Na
Li
K
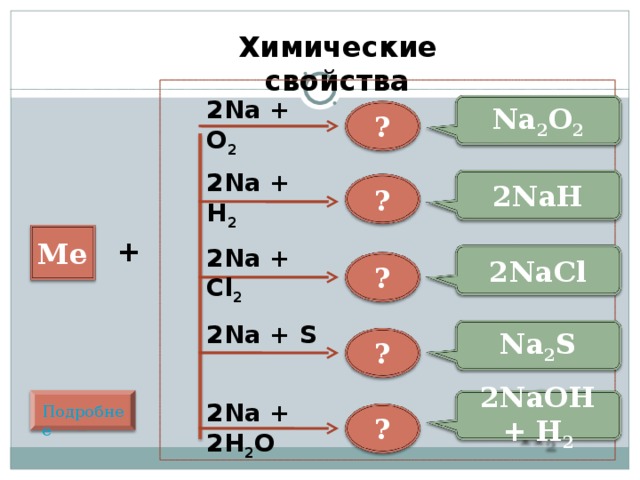
Химические свойства
2Na + O 2
Na 2 O 2
?
2Na + H 2
2NaH
?
Me
+
2Na + Cl 2
2NaCl
?
2Na + S
Na 2 S
?
2NaOH + H 2
2Na + 2H 2 O
Подробнее
?

ТЕСТ
Восстановительные свойства
Число валентных электронов
От лития к францию у атомов щелочных металлов увеличивается:
Окислительные свойства
Элетроотрица-тельность
Rb
Li
Более сильным восстановителем, чем К будет:
Na
Mg
Na
Li
Активнее всех с водой будет взаимодействовать:
K
Cs
Mg, Cl 2 , H 2 O.
O 2 , N 2 , SO 3 .
К может реагировать со всеми веществами группы:
S, H 2 , H 2 O.
LiOH, S, O 2 .

4Li + O 2 → 2Li 2 O (оксид лития)
2Na + O 2 → Na 2 O 2 (пероксид натрия)
K + O 2 → KO 2 (надпероксид калия)
2Na + Na 2 O 2 → 2Na 2 O
2Na 2 O 2 + 2H 2 O → 4NaOH + O 2






























