
Эпиграф урока
Жизнь учит только тех, кто её изучает .

Мотивация

Творческое название урока:
«Секретное оружие муравьёв»

Тема урока:

Цели урока
- Сформулировать определение.
- Вывести общую формулу.
- Изучить классификацию.
- Изучить физические и химические свойства.
- Рассмотреть строение.
- Оценить разнообразие и наряду со всем названным познать области применения веществ, с которыми мы познакомимся на уроке.

Благодаря работам
выдающегося шведского
химика Карла
Вильгельма Шееле к
концу XVIII века
стало известно около
десяти различных
органических кислот он
выделил и описал
лимонную, молочную,
щавелевую и другие кислоты.
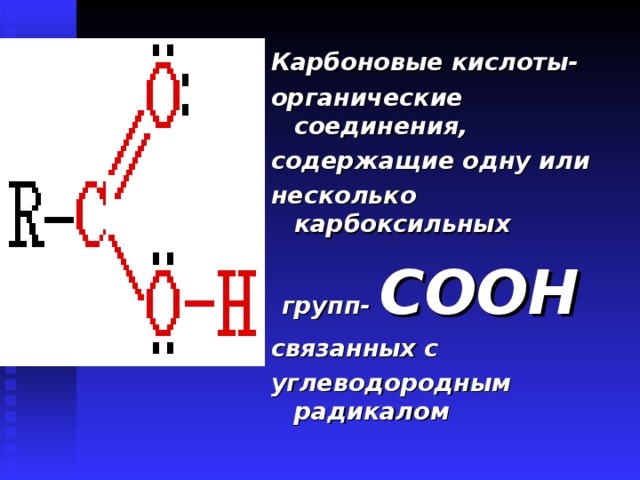
Карбоновые кислоты-
органические соединения,
содержащие одну или
несколько карбоксильных
групп- СООН
связанных с
углеводородным радикалом

Классификация карбоновых кислот
По числу карбоксильных
групп
По типу углеводородного
радикала
предельные
одноосновные
непредельные
двухосновные
многоосновные
ароматические

Общая формула одноосновных кислот предельного ряда
С n H 2 n+1 COO Н
где n может быть равно нулю.

Простейшие карбоновые кислоты
Название
Формула
Муравьиная
кислота
(метановая)
Модель
Уксусная
Кислота
(этановая)
Пропионовая
Кислота
(пропановая)

Формулы и названия некоторых карбоновых кислот
Формула
Тривиальное название
НСООН
Муравьиная
СН 3 СООН
Международное название
Название радикала
Метановая
Уксусная
СН 3 СН 2 СООН
СН 3 (СН 2)2 СООН
Формиат
?
Пропионовая
СН 3( СН 2 ) 3 СООН
?
Масляная
Ацетат
?
Валериановая
Пропионат
СН 3 (СН 2 ) 4 СООН
Бутират
?
Капроновая
Валерат
?
Капрат

Некоторые представители карбоновых кислот
HOOC – CH 2 – CH 2 - COOH
1, 4 – бутандиовая кислота
НООС – CH – CH 2 – COOH
׀
OH
2 – окси – 1,3 – пропандиовая кислота
OH
׀
HOOC – CH 2 – C – CH 2 - COOH
׀
COOH

Изомерия и номенклатура карбоновых кислот
Изомерия карбоновых кислот
СН3-СН2-СН2-СООН
СН3-СН-СООН
l
СН3
Какой вид изомерии присущ карбоновым кислотам?
Тест по теме: «Карбоновые кислоты»
Из четырёх возможных вариантов ответов выберите один правильный ответ
1. Общая формула карбоновых кислот:
а) R (ОН) m ; б) R -СООН; в) С n (Н2О) m ; г) R -СОН
2. Сколько карбоксильных групп содержится в молекулах монокарбоновых кислот?
а) одна; б) две; в) три; г) четыре
3. Как называется карбоновая кислота следующего строения:
СН3-СН2-СН-СН2-СН-СООН
СН3 СН3
а) 2,4,-диметилгексановая;
б) 2,3-диметилпентановая;
в) 3,5-диметилгексановая; г) 2,3-диметилгептановая
4. Какое из следующих веществ являются непредельной одноосновной карбоновой кислотой?
а) НООС-(СН2)3-СООН;
б) СН3-СН2-СН2-СООН;
в) Н2С=СН-СООН; г) НООС-(СН2)2-СООН
5. Бутановая кислота имеет: а) два, б) четыре, в) шесть, г) три изомера?
Из четырёх возможных вариантов ответов выберите один правильный ответ
- Общая формула предельных одноосновных карбоновых кислот:
а) С n Н2 n +1СООН; б) С n Н2 n О2; в) С n Н2 n +1СОН; г) С n Н2 n
2. Сколько карбоксильных групп содержится в молекулах дикарбоновых кислот?
а) одна; б) две; в) три; г) четыре
3. Как называется карбоновая кислота следующего строения:
СН3-СН2-СН2-СН-СООН
СН3
а) 4-метилпентановая; б) 2-метилбутановая;
в) 2-метилпентановая; г) 4-метилбутановая
4. Какое из следующих веществ является предельной одноосновной кислотой?
а) Н2С=СН-СООН; б) СН3-СН2-СООН;
в) Н2С=СН-СН2-СООН; г) СООН-СН2-СООН
5. Пентановая кислота имеет: а) пять; б) четыре; в) шесть; г) два изомера?

Эталоны ответов
1 вариант
1-а
2-б
3-в
4-б
5-б
2 вариант
1-б
2-а
3-а
4-в
5-а

Назовите карбоновые кислоты
l l
СН3 СН3
СН3 СН3
l l
2. СН3-СН - С-СООН
l
СН3
Опыт.

«Чудесный мир карбоновых кислот»
Цель:
- Изучить физические и химические свойства.
- Оценить разнообразие и наряду со всем названным познать области применения веществ, с которыми мы познакомимся на уроке.

Физические свойства предельных карбоновых кислот
Физические свойства карбоновых кислот

НСООН СН 3 СООН… С 9 Н 19 СООН С 10 Н 21 СООН…
жидкости твёрдые
вещества
смешиваются с водой
во всех соотношениях растворимость в воде уменьшается
t кип. увеличивается

Межмолекулярная водородная связь

Электронное строение

Химические свойства
- 1.Диссоциация с образованием катионов водорода и анионов кислотного остатка: СН 3 - СООН ↔ СН 3 – СОО - + Н +
- 2.Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода: 2СН 3 - СООН + Mg → (CH 3 - COO) 2 Mg + H 2

3.Взаимодействие с основаниями
2СН 3 –СООН + N аО H →СН 3 –СОО N а + Н 2 О
4. Взаимодействие с основными оксидами
2СН 3 - СООН + CaO → (CH 3 - COO) 2 Ca + H 2 O

5 . Взаимодействие с солями более слабых кислот
K 2 CO 3 + 2CH 3 COOH → 2CH 3 COOK + H 2 O + CO 2

6. Реакции замещения с галогенами
СН 3 – СООН + Cl 2 →CH 2 Cl – COOH + HCl
хлоруксусная
кислота
CH 2 Cl – COOH + Cl 2 →CHCl 2 COOH + HCl
дихлоруксусная
кислота
CHCl 2 – COOH + Cl 2 →CCl 3 – COOH + HCl

7. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров
(реакция этерификации):
СН 3 СООН + СН 3 ОН →СН 3 СООСН 3 +Н 2 О уксусная к-та метанол метилацетат

Сложные эфиры в природе

Применение важнейших насыщенных монокарбоновых кислот
Применение муравьиной кислоты
Обработка кожи
Растворители
Лекарствен-ные средства
НСООН
Пестициды
Консервирование
фруктовых соков, зелёных кормов
Душистые вещества
Дезинфекция ёмкостей в пищевой промышленности
Крашение тканей и бумаги
Ацетатное волокно, негорючая кинопленка, органическое стекло

Применение уксусной кислоты
Для пищевых целей (эссенция, уксус)
Раствори-тель
Ацетаты
(соли и эфиры)
Инсектициды
Уксусный ангидрид
СН 3 СООН
Красители (индиго)
Ацетилхло-
рид
Лекарствен-ные средства
(аспирин)
Монохлорук-сусная кислота

Проверь себя 1. Выписать формулы веществ, с которыми может вступать в реакцию уксусная кислота. (Са, B аО, СО2, Р2О5, N а 2 СО3, Н2СО3) 2. В пищевой промышленности уксусная кислота используется в качестве консерванта и регулятора кислотности под кодом Е-260. Напишите структурную формулу предыдущего гомолога этой кислоты, имеющего код Е- 236 . Назовите вещество.

Рефлексия:
- «Что узнал на уроке?»
- Чему научился?
- «Что не понял?»

Домашнее задание
1. Параграф 28
2. 1 уровень - ? 17 с. 117
2 уровень – з. 5 с. 118 (письменно)


















































