Просмотр содержимого документа
«Презентация к уроку химии по теме "Бензол"»

Арены.
Бензол

Арены – углеводороды с общей формулой C n H 2n -6 , молекулы которых, содержат бензольное кольцо .
Молекулярная
формула бензола





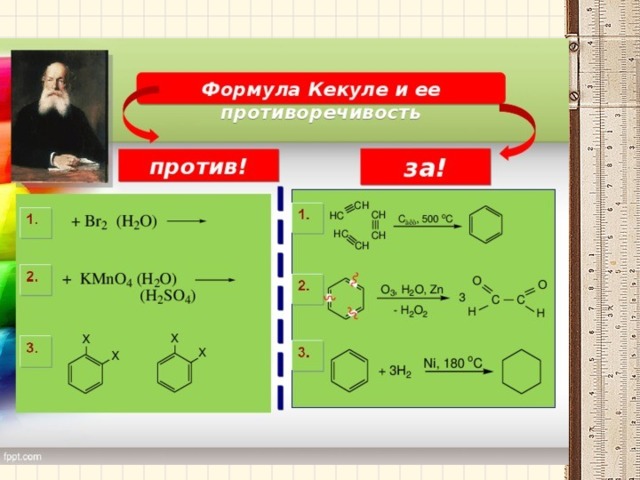


Приведенная формула отражает равноценность шести атомов С, но не объясняет ряд особых свойств бензола.
Например, несмотря на ненасыщенность, он не проявляет склонности к реакциям присоединения: не обесцвечивает бромную воду и раствор перманганата калия, т.е. ему не свойственны типичные для непредельных соединений качественные реакции.
В структурной формуле Кекуле – три одинарные и три двойные чередующиеся углерод-углеродные связи. Но такое изображение не передает истинного строения молекулы.
В действительности углерод-углеродные связи в бензоле равноценны. Это объясняется электронным строением его молекулы.
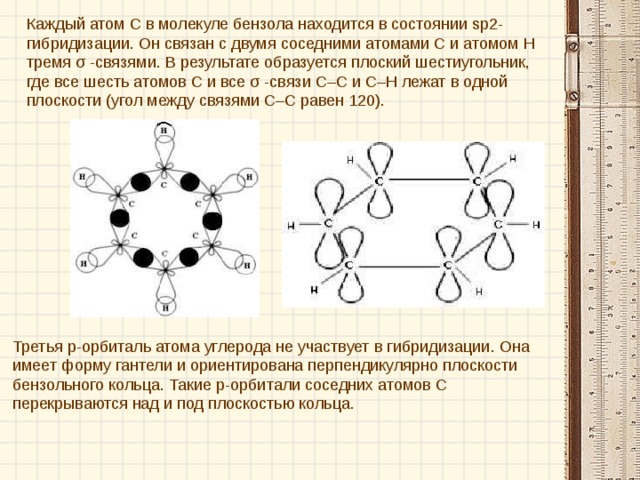
Каждый атом С в молекуле бензола находится в состоянии sp2-гибридизации. Он связан с двумя соседними атомами С и атомом Н тремя σ -связями. В результате образуется плоский шестиугольник, где все шесть атомов С и все σ -связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120).
Третья p-орбиталь атома углерода не участвует в гибридизации. Она имеет форму гантели и ориентирована перпендикулярно плоскости бензольного кольца. Такие p-орбитали соседних атомов С перекрываются над и под плоскостью кольца.
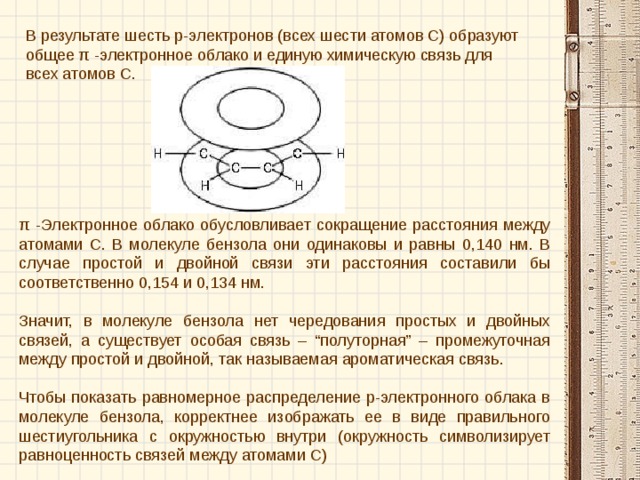
В результате шесть p-электронов (всех шести атомов С) образуют общее π -электронное облако и единую химическую связь для всех атомов С.
π -Электронное облако обусловливает сокращение расстояния между атомами С. В молекуле бензола они одинаковы и равны 0,1 40 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм.
Значит, в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – “полуторная” – промежуточная между простой и двойной, так называемая ароматическая связь.
Чтобы показать равномерное распределение p-электронного облака в молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с окружностью внутри (окружность символизирует равноценность связей между атомами С)

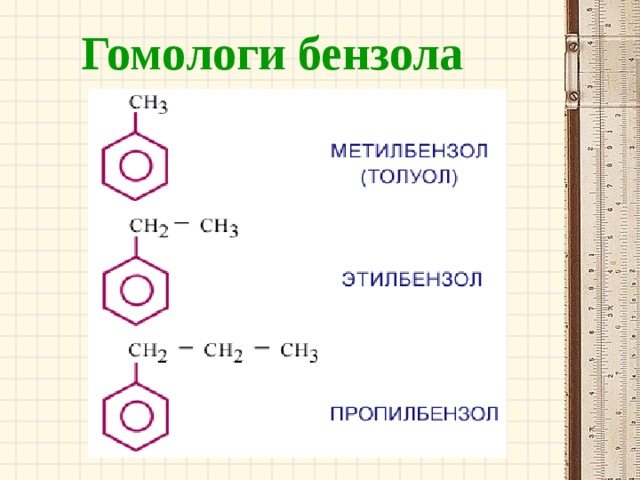
Гомологи бензола

Получение
- Бензол получают из каменноугольной смолы, образующейся при коксовании угля.
- В настоящее время бензол получают из нефти.
- Бензол получают синтетическими методами.
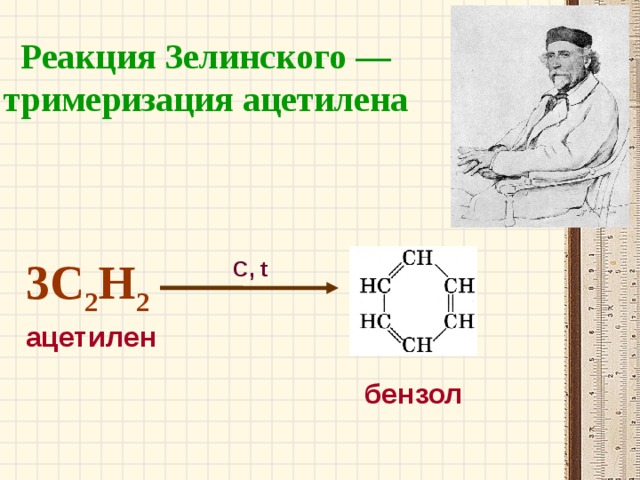
Реакция Зелинского — тримеризация ацетилена
3С 2 Н 2
С, t
ацетилен
бензол

Физические свойства
- Бензол представляет собой бесцветную жидкость с температурой кипения +80ºС и температурой плавления + 5ºС.
- Он обладает характерным запахом, токсичен .
- Легче воды и не растворяется в ней.


Химические свойства бензола.
- Бензол горит . Пламя бензола коптящее из-за высокого содержания углерода в молекуле.
C 6 H 6 + O 2 →
CO 2 + H 2 O
15
2
6
12

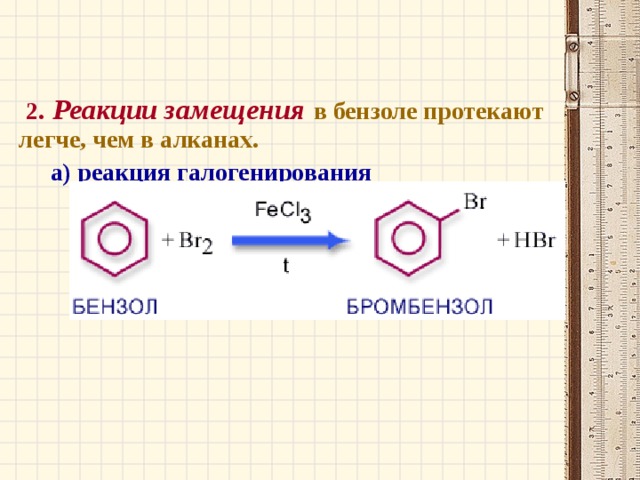
2. Реакции замещения в бензоле протекают легче, чем в алканах.
а) реакция галогенирования

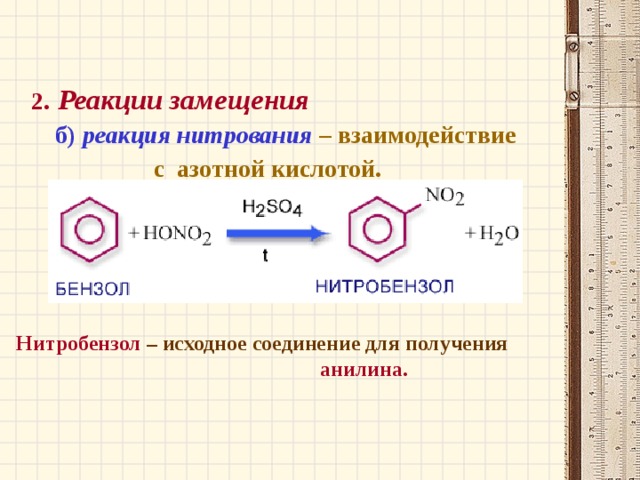
2. Реакции замещения
б) реакция нитрования – взаимодействие
с азотной кислотой.
Нитробензол – исходное соединение для получения
анилина.



3. Реакции присоединения в бензоле
протекают труднее, чем в алкенах.
а) реакция гидрирования
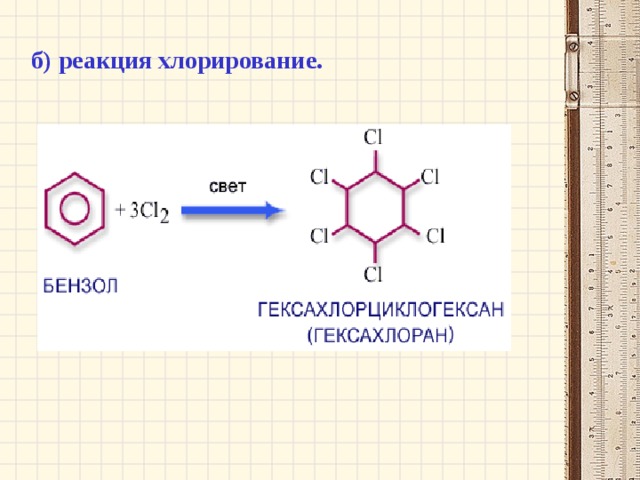
б) реакция хлорирование.


Применение бензола
1-добавка к бензину ;
производство
2-растворителей;
3-ацетона;
4-анилина;
5-фенола;
6-пестицидов;
7-лекарств;
8-фенолформальдегидных пластмасс.

1. Из 7,8 г бензола получено 8,6 г нитробензола. Определите выход (в%) продукта реакции .
2. Запишите уравнения реакции, с помощью которых можно осуществить превращения:
CaC 2 → C 2 H 2 → C 6 H 6 → C 6 H 5 Br
↓
C 6 H 6 Cl 6















































