
«МЕТАЛЛЫ»

Металлов много есть, но дело не в количестве:
В команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов
Пред египтянином, китайцем, древним греком
И каждым современным человеком.

Повторение
- История металлов.
- Распространение в природе.
- Положение металлов в ПСХЭ.
- Строение атомов металлов и веществ металлов.
- Взаимосвязь строения металлов и физических свойств.

История металлов.
С глубокой древности человеку были
известны 7 металлов:
Au, Ag, Cu, Sn, Pb, Fe, Hg.

Часы истории человечества стали
отсчитывать время быстрее, когда в его
жизнь вошли металлы и сплавы…

- Бронза – сплав меди и олова;
- Латунь – сплав меди и цинка;
- Мельхиор – сплав меди и никеля;
- Дюралюминий – сплав алюминия, меди и магния;
- Железные сплавы – чугун и сталь.

Железный век продолжается …
90% всего
количества
металлов и
металлических
сплавов
приходится на
железные
сплавы.
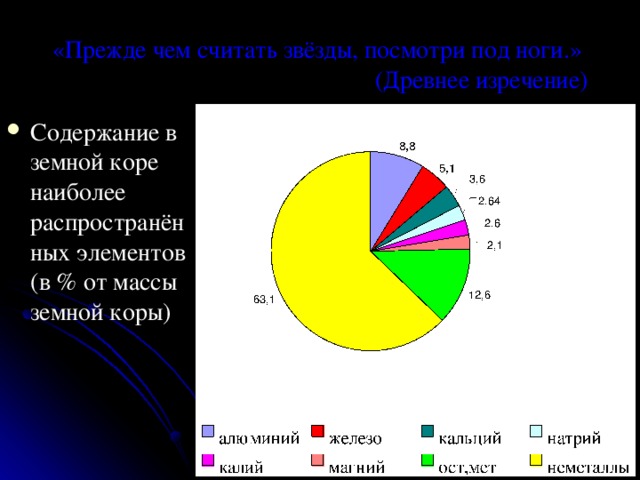
«Прежде чем считать звёзды, посмотри под ноги.» (Древнее изречение)
- Содержание в земной коре наиболее распространённых элементов (в % от массы земной коры)

Из 110 изученных химических
элементов к металлам относятся 88.
Все наиболее распространённые
элементы располагаются в верхней
части менделеевской таблицы.
Где же находятся металлы?


Строение атомов металлов и веществ металлов.
Из положения в ПСХЭ:
- Атомы металлов на последнем
энергетическом уровне имеют 1 – 3 ē
Исключения:
Ge, Sn, Pb - 4ē
Sb, Bi - 5ē
Po - 6ē
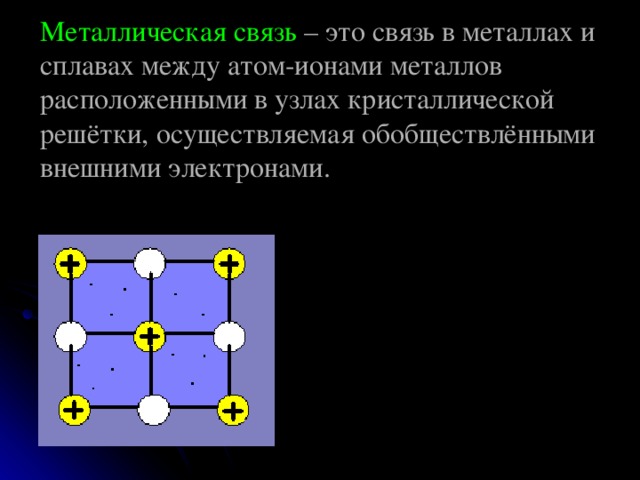
Металлическая связь – это связь в металлах и сплавах между атом-ионами металлов расположенными в узлах кристаллической решётки, осуществляемая обобществлёнными внешними электронами.
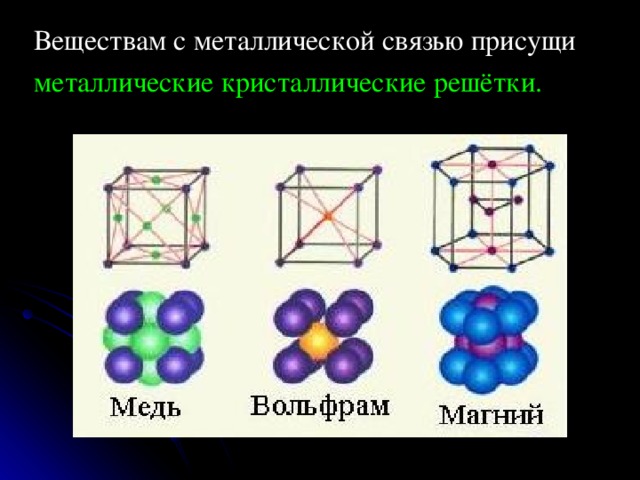
Веществам с металлической связью присущи
металлические кристаллические решётки.

Физические свойства металлов

Твёрдость

Видеоопыт

Плотность

Плавкость

Плавление алюминия

Электро- и теплопроводность
Наибольшую электро- и теплопроводность
имеют Ag, Cu, Au, Al, Fe ;
Наименьшую – Mn, Pb, Hg .
Металлический блеск
Самые блестящие металлы – Hg, Ag, Pd .
В порошке все металлы, кроме Al и Mg ,
теряют блеск и имеют чёрный или тёмно-
серый цвет.
Пластичность -
это свойство вещества менять форму под
внешним воздействием и сохранять
принятую форму после прекращения этого
воздействия.

Тема:
Общие химические свойства металлов

Цель:
- Систематизировать и углубить сведения о
химических свойствах металлов

Дом. зад. :
.

У атомов металлов большие размеры атомных радиусов. Поэтому металлы легко отдают внешние электроны .
На пример:
Na 0 - 1ē → Na +1
Al 0 - 3ē → Al +3

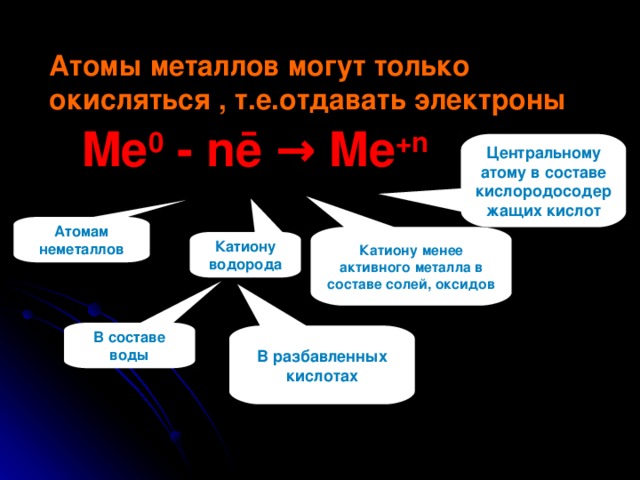
Атомы металлов могут только окисляться , т.е.отдавать электроны
Me 0 - nē → Me +n
Центральному атому в составе кислородосодержащих кислот
Атомам неметаллов
Катиону менее активного металла в составе солей, оксидов
Катиону водорода
В составе воды
В разбавленных кислотах
 t 0 " width="640"
t 0 " width="640"
1.Взаимодействие металлов с водой
Li K Ca Na Mg Al || Zn Cr Fe Ni Pb || (H 2 ) Cu Hg Ag
Взаимодействуют с водой при обычных условиях
Me + H 2 O → H 2 + основание
При нагревании
Me + H 2 O → H 2 + оксид
Me + H 2 O ≠
t 0

Видеоопыт

З а п о м н и!!!
С водой взаимодействует
только
амальгамированный
алюминий
(лишенный оксидной
пленки)

Алюминий с водой

Допишите продукты реакций:
Na + H 2 O →
Zn + H 2 O →

ЭЛЕКТРОХИМИЧЕСКИИЙ РЯД
АКТИВНОСТИ МЕТАЛЛОВ
Li K Ca Na Mg Al || Zn Cr Fe Ni Pb || ( H 2 ) Cu Hg Ag
Вытесняют H 2 ↑ из растворов кислот (кроме HNO 3 )
Не вытесняют H 2 ↑ из растворов кислот

2. Металлы с кислотами
- 5 Ме с соляной ряд активности.avi
- Zn + 2HCl → ZnCl 2 + H 2 ↑

3.Металлы с солями менее активных металлов

Металлы могут восстанавливать катионы менее активных металлов из растворов их солей
Zn 0 + Cu +2 Cl 2 → Cu 0 + Zn +2 Cl 2

Все металлы на основании их восстановительной
способности по отношению к ионам металлов
в водных растворах расположены в
электрохимический ряд напряжений металлов:
Li K Ca Na Mg Al Zn Cr Fe Ni Pb H 2 Cu Hg Ag
Увеличение восстановительных свойств
ПРИМЕЧАНИЕ : окислительная способность ионов (катионов) металлов повышается слева направо (при электролизе)

4. Окисление металлов неметаллами
(Кислород, сера, галогены …)
горение магния. mpg
А l + Br 2 . wmv
ртуть с серой. avi
С u Fe c Cl2.avi

С кислородом воздуха легко
взаимодействуют щелочные и
щелочно-земельные металлы.
4 Li 0 + O 2 0 → 2 LI +1 2 0 -2

Железо, цинк, медь окисляются только при нагревании
3 Fe + 2O 2 → Fe 3 O 4
t o
 P t + O 2 ≠ " width="640"
P t + O 2 ≠ " width="640"
Внимание !
A u + O 2 ≠ P t + O 2 ≠

Металлы с неметаллами образуют бинарные соединения
Бромиды – AlBr 3
Сульфиды – PbS
Фосфиды – Na 3 Р

5 . Окисление металлов оксидами неметаллов

6.Окрашивание пламени ионами металлов :
пламя натрий. mpg
пламя калий. mpg
пламя литий. mpg
пламя медь. mpg

Получение металлов
- доменная печь чугун. avi
- коксотермия свинца. avi
- алюмотермия хрома. avi

Допишите практически осуществимые реакции:
5. Au + O 2 →
6. Zn + O 2 →
7. Fe + S →
8. Li + N 2 →
- Ca + HOH →
- Al + HCl →
- Hg + HCl →
- Fe + CuSO 4 →

Проверь себя!!!
2 ē
Ca + 2 HOH →Ca(OH) 2 + H 2
6ē
2Al + 6HCl →2AlCl 3 + H 2
2 ē
Fe + CuSO 4 → FeSO 4 +Cu
Ag + CuCl 2 → не происходит
Au + O 2 → не происходит
4ē
2Zn + O 2 → 2ZnO
2 ē
Fe + S → FeS
6ē
6 Li + N 2 → 2Li 3 N































 t 0 " width="640"
t 0 " width="640"












 P t + O 2 ≠ " width="640"
P t + O 2 ≠ " width="640"

























