
Аммиак.
NH3
Подготовила учитель химии МКОУ «Кислоканская СШ»
Катцына Любовь Федоровна
Январь 2018г

План
1
История. Строение молекулы. аммиака .
Физические свойства.
2
Получение.
3
3
Химические свойства.
4
4
Применение.
5

История.
Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей.
В очень жарком климате мочевина (NH 2 ) 2 CO, разлагается особенно быстро.
Одним из основных продуктов разложения и является аммиак.
Оазис «Аммон»
в Северной Африке

История.
По некоторым сведениям, аммиак мог получить современное название от древнеегипетского слова «амониан».
Так называли всех верующих людей, поклоняющихся богу Амону.
Люди во время своих ритуальных обрядов нюхали NH 4 Cl, который при нагревании издаёт запах аммиака.
Бог Аммон в образе барана

История.
Сокращенное название «аммиак» ввел в обиход в 1801 году русский ученый - химик, академик Яков Дмитриевич Захаров.
1781-1852 г .
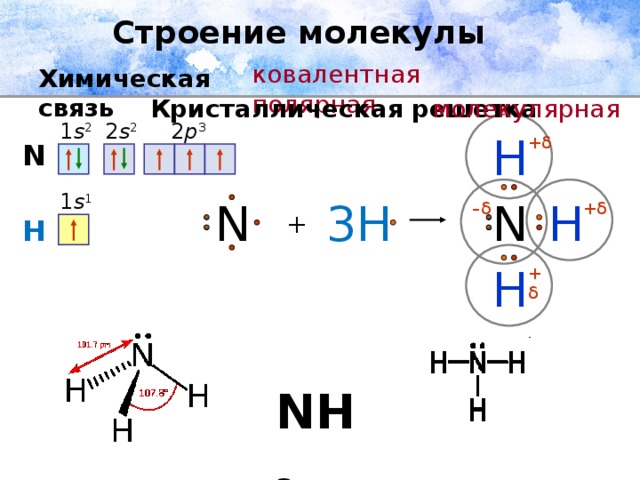
Строение молекулы
ковалентная полярная
Химическая связь
Кристаллическая решетка
молекулярная
2 s 2
1 s 2
2 p 3
H
+ δ
N
1 s 1
N
H
3H
N
– δ
+ δ
+
H
H
+ δ
NH 3

Физические свойства
- бесцветный газ , с резким характерным запахом (запах нашатырного спирта)
- легче воздуха (М=17 г/моль)
- хорошо растворяется в воде (1200 объёмов при 0°C)
и 700 объёмов (при 20 °C) в 1 объёме воды
- Легко сжижается: Т пл. =-77.73 °C, Ткип.=-33.34 °C
- При соприкосновении с кожей возникает обморожение различной степени.
- 25% раствор – водный аммиак (аммиачная вода)
- 10% раствор – нашатырный спирт.

Физические свойства
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных вызвать токсический отёк лёгких и тяжёлое поражение нервной системы.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы.

Получение аммиака. 1.Промышленный способ.
Основан на прямом взаимодействии
водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9кДж
Условия протекания реакции:
1.Катализатор – пористое железо
2.Температура – 450 – 500 ˚С
3.Давление – 25 – 30 МПа

Получение аммиака. 1.Лабораторный способ.

Получение аммиака. 1.Лабораторный способ.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
2NH 4 Cl + Ca(OH) 2 = 2NH 3 ↑ + СaCl 2 + 2H 2 O
(NH 4 ) 2 SO 4 + 2NaOH = 2NH 3 ↑ + N a 2 SO 4 + 2H 2 O
Гидроксид аммония неустойчивое основание, разлагается:
NH 4 OH ↔ NH 3 ↑ + H 2 O
При получении аммиака
держите пробирку – приёмник
дном кверху, так как аммиак
легче воздуха.

Химические свойства. 1.Взаимодействие с водой.
NH 3 + H 2 O ↔ NH 4 OH
гидроксид аммония
При добавлении фенолфталеина ‑ раствор становится малиновым, так как при растворении аммиака частично образуется гидроксид аммония NH 4 OH.

Химические свойства. 2.Взаимодействие с кислотами .

Химические свойства. 2.Взаимодействие с кислотами.
Идет по донорно-акцепторному механизму
NH 3 + HCl = NH 4 Cl
хлорид аммония
: NH 3 +□ H + = NH 4 +
АКЦЕПТОР
ИОН АММОНИЯ
ДОНОР

Химические свойства. 3. Взаимодействие с кислородом.
- Горение аммиака (при нагревании)
4NH3 + 3O2 → 2N2 + 6H20
- Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O

Химические свойства.
4. Взаимодействие с галогенами.
2NH3 + 3Cl2 = N2↑+ 6HCl
(при нагревании)
5. Взаимодействие с оксидами металлов.
2NH3 +3CuO =3Cu + N2 ↑+3H2O

Применение аммиака.
Производство азотной
кислоты.
В холодильных
установках.
NH 3
В медицине,
в быту.
Для паяния
Производство
азотных
удобрений
Производство
взрывчатых
веществ

По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.

Это интересно .
- Пары нашатырного спирта способны изменять окраску цветов.
Например, голубые и синие лепестки становятся зелеными , ярко красные — черными.
- Облака Юпитера состоят из аммиака.

Домашнее задание
§25 упр.3-5,7,8












































