Просмотр содержимого документа
«Презентация "Непредельные углеводороды. Алкены"»

Непредельные углеводороды АЛКЕНЫ
Абрамова Татьяна Анатольевна

Содержание
1.Определение
2.Номенклатура алкенов
3.Изомерия алкенов
4.Строение алкенов
5.Получение алкенов
6.Физические свойства
7.Химические свойства
8.Применение алкенов

Определение
Алкены – непредельные углеводороды, в молекулах которых между атомами углерода имеется одна двойная связь.
Общая формула : С n H 2n , где n ≥2

Строение алкенов
СН 2 = СН 2 этилен (этен)
Двойная связь: σ-связь + π-связь
Тип гибридизации: sp ²
Валентный угол: 120°
Длинна связи : 134 нм
Форма молекулы:
плоскостная (треугольная)
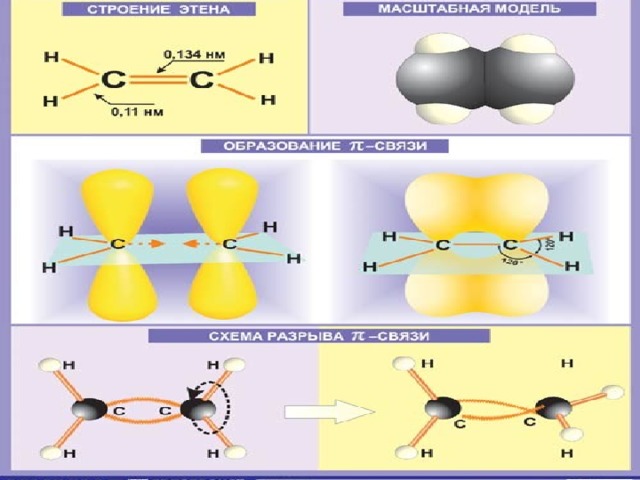
Строение алкенов

Номенклатура алкенов
СН 2 = СН 2 эт ен (эт илен )
СН 3 – СН = СН 2 проп ен (проп илен )
4 3 2 1 1 2 3 4
СН 3 – СН 2 – СН = СН 2 СН 3 – СН = СН – СН 3
бут ен -1 (бут илен-1 ) бут ен -2 (бут илен-2 )
5 4 3 2 1
СН 3 – СН – CH 2 – CH=CH 2
|
CH 3 4 – метилпент ен -1
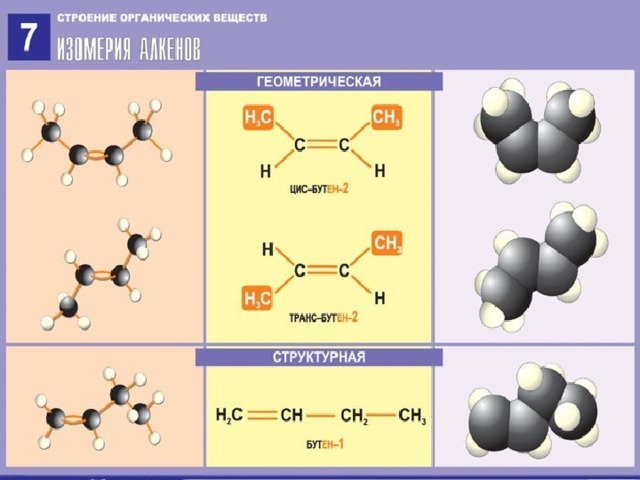
Изомерия алкенов
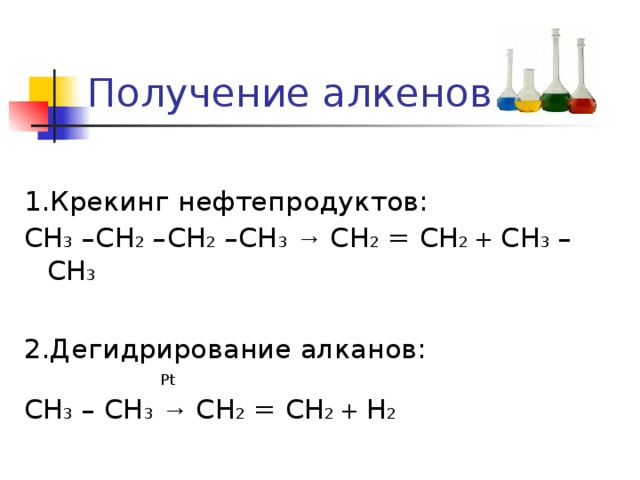
Получение алкенов
1.Крекинг нефтепродуктов:
СН 3 –СН 2 –СН 2 –СН 3 → СН 2 = СН 2 + СН 3 – СН 3
2.Дегидрирование алканов:
Pt
СН 3 – СН 3 → СН 2 = СН 2 + Н 2
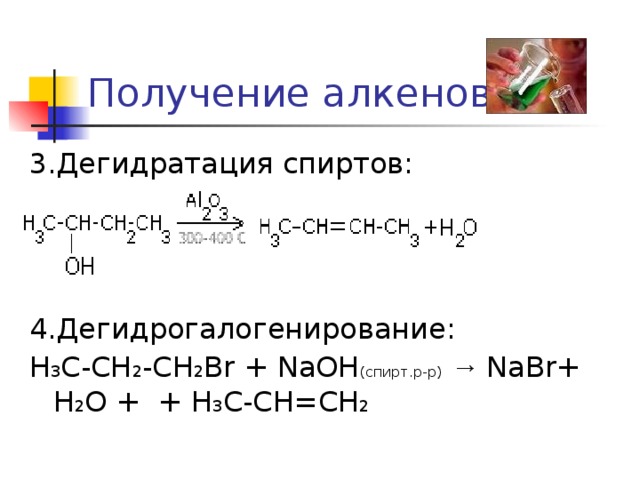
Получение алкенов
3.Дегидратация спиртов:
4.Дегидрогалогенирование:
H 3 C-CH 2 -CH 2 Br + NaOH (спирт.р-р) → NaBr+ H 2 O + + H 3 C-CH=CH 2

Получение алкенов
5.Дегалогенирование:

Физические свойства
Этен,пропен, бутен – газы
С 5 Н 10 – С 16 Н 32 - жидкости
Высшие алкены – тв.вещества

Химические свойства
I.Реакции присоединения:
1.Гидрирование :
CH 2 =CH-CH 3 +Н 2 → CH 3 -CH 2 -CH 3
2.Галогенирование:
CH 2 =CH-CH 3 +Cl 2 → CH 2 Cl-CHCl-CH 3
3.Гидрогалогенирование:
CH 2 =CH-CH 3 +НCl → CH 3 -CHCl-CH 3

Химические свойства
I.Реакции присоединения:
4.Гидратация:
5.Полимеризация:

Химические свойства
II.Реакции окисления:
1.Полное окисление (горение):
С 2 Н 4 + 3О 2 → 2СО 2 + 2Н 2 О
2.Неполное окисление :
3 С 2 Н 4 + 2KMnO 4 +4Н 2 О → 3HOCH 2 -CH 2 OH +
+2MnO 2 + 2KOH

Применение алкенов

Cпасибо за внимание!
Успехов в освоении органической химии!









































