Просмотр содержимого документа
«Презентация по химии на теме "Кислоты"»

Презентация к уроку «Кислоты »
8 класс
Актуализация знаний
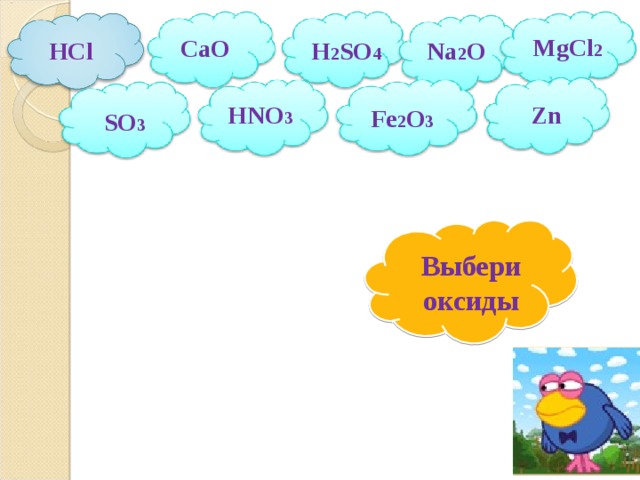
HCl
MgCl 2
CaO
Na 2 O
H 2 SO 4
HNO 3
Zn
Fe 2 O 3
SO 3
Выбери оксиды
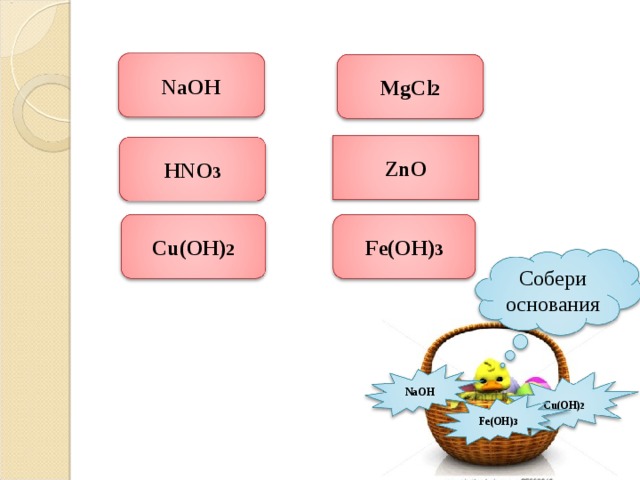
NaOH
MgCl 2
ZnO
HNO 3
Cu(OH) 2
Fe(OH) 3
Собери основания
NaOH
Cu(OH) 2
Fe(OH) 3

Распределить предложенные вещества по классам, дать определения известных классов.
H 2 SO 4 , Са O, К OH,
N 2 O 5 , Fe(OH) 2 , Li 2 O,
HCl, CO 2 , Ba(OH) 2 ,
H 3 PO 4

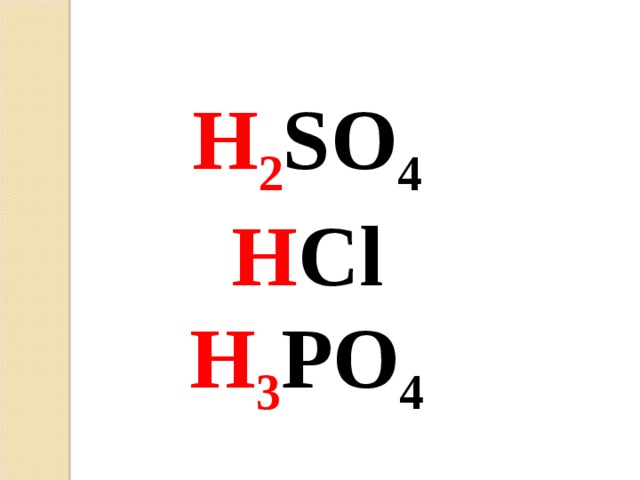
К какой группе веществ мы отнесем
H 2 SO 4 , HCl , H 3 PO 4 ?

ТЕМА УРОКА
КИСЛОТЫ
H 2 SO 4 H Cl H 3 PO 4

Кислоты - это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.

H 2 SO 4 серн ая кислота
H 2 SO 3 серн истая кислота
H 3 P O 4 фосфорная кислота
H N O 3 азотн ая кислота
H NO 2 азот истая кислота
H 2 CO 3 угольная кислота
H 2 SiO 3 кремниевая кислота
H Cl хлороводородная
(соляная) кислота

Физические свойства кислот
По агрегатному состоянию:
- Газообразные (HCl, H 2 S)
- Жидкие (HNO 3 , H 2 SO 4 )
- Твердые (H 3 PO4, H 2 SiO 3 ).
Кислоты имеют кислый вкус:
Кислый вкус лимону придает лимонная кислота ,
яблоку — яблочная кислота , скисшему молоку —
молочная кислота . Щавель имеет кислый вкус
благодаря наличию в его листьях щавелевой кислоты .
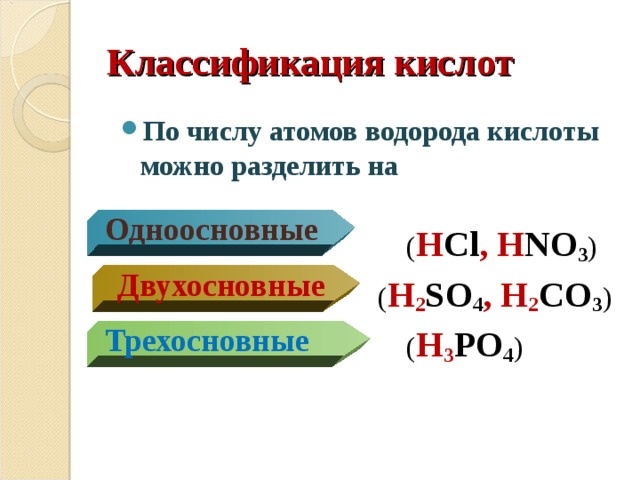
Классификация кислот
- По числу атомов водорода кислоты можно разделить на
( H Cl , H NO 3 )
( H 2 SO 4 , H 2 CO 3 )
( H 3 PO 4 )
Одноосновные
Двухосновные
Трехосновные
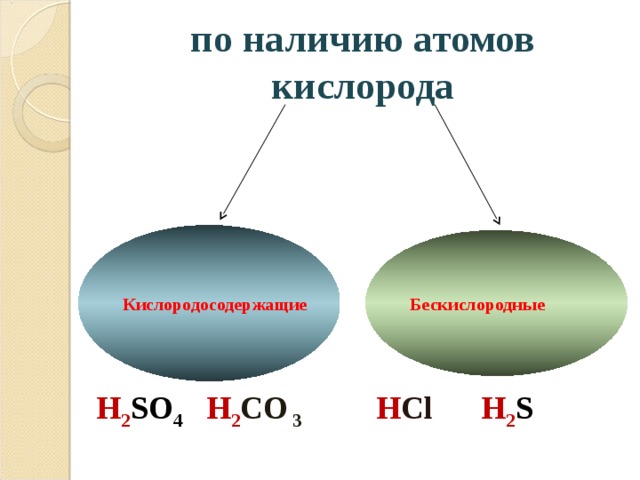
по наличию атомов кислорода
Кислородосодержащие
Бескислородные
H 2 SO 4 H 2 CO 3
H Cl H 2 S
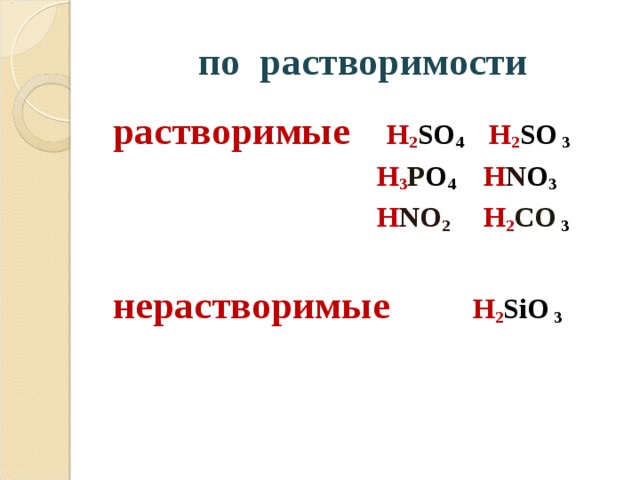
по растворимости
растворимые H 2 SO 4 H 2 SO 3
H 3 P O 4 H N O 3
H NO 2 H 2 CO 3
нерастворимые H 2 SiO 3

Есть кислоты, которые в свободном виде не существуют
H 2 CO 3 =CO 2 ↑ + H 2 O
H 2 SO 3 = S O 2 ↑ +H 2 O

Нахождение степени окисления
+1 -1 +1 -2
HCl H 2 S
- Рассчитаем степени окисления элементов в серной кислоте.
+1 x -2
H 2 SO 4
Составим уравнение:
(+1)∙2+х+(-2)∙4=0 , где х- степень окисления серы; х=6
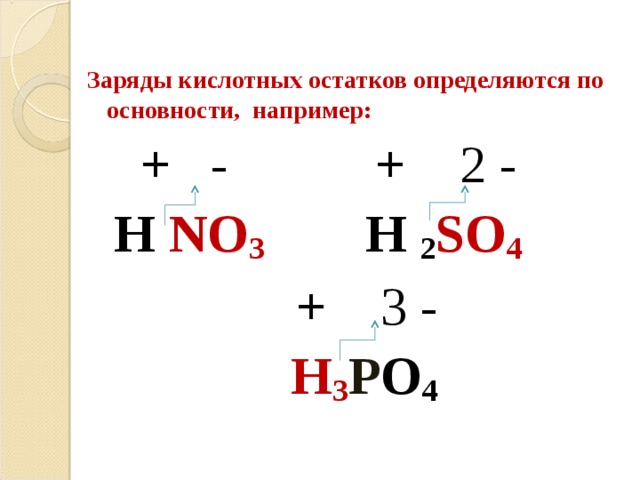
Заряды кислотных остатков определяются по основности, например:
+ - + 2 -
H NO 3 H 2 SO 4
+ 3 -
H 3 P O 4
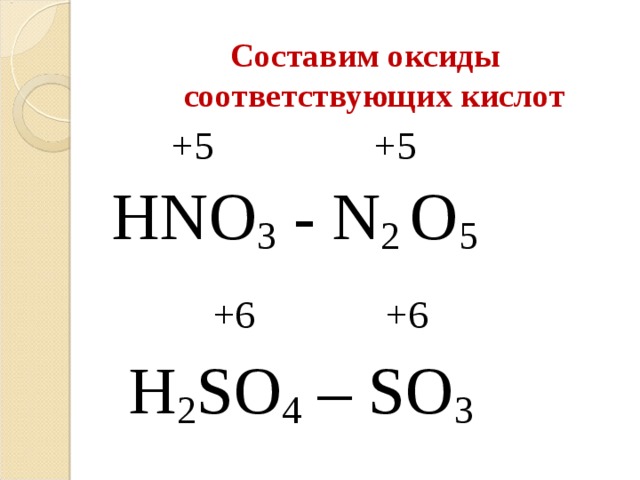
Составим оксиды соответствующих кислот
+5 +5
HNO 3 - N 2 O 5
+6 +6
H 2 SO 4 – SO 3

Самостоятельная работа
- Дайте характеристику следующим кислотам H 3 PO 4 , HNO 2 , H 2 SO 3 по плану:
1.Наличие кислорода
2.Основность
3.Растворимость
4.Степени окисления элементов, образующих кислоту
5.Заряд иона, образуемого кислотным остатком
6.Соответствующий оксид
Учащиеся выбирают для характеристики любую кислоту .
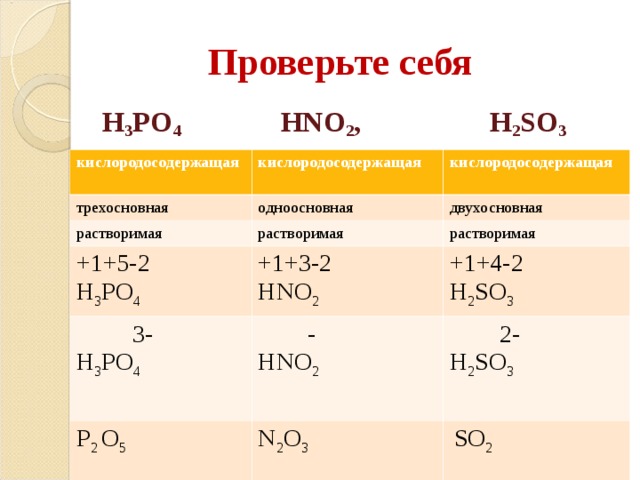
Проверьте себя
H 3 PO 4 HNO 2 , H 2 SO 3
кислородосодержащая
кислородосодержащая
трехосновная
кислородосодержащая
одноосновная
растворимая
растворимая
двухосновная
+1+5-2
H 3 PO 4
3-
H 3 PO 4
растворимая
+1+3-2
HNO 2
-
HNO 2
+1+4-2
H 2 SO 3
Р 2 O 5
2-
H 2 SO 3
N 2 O 3
SO 2

Рефлексия
- 1. На уроке я работал(а): активно/пассивно
- 2. Своей работой на уроке я: доволен/ не доволен
- 3. Урок для меня показался: коротким/ длинным
- 4. За урок я: не устал(а)/ устал(а)
- 5. Мое настроение: стало лучше/ стало хуже
- 6. Материал урока мне был: понятен/ не понятен
полезен/бесполезен
интересен/ скучен
- 7. Домашнее задание мне кажется: легким/ трудным

Домашнее задание
П. 21, вопросы 1 – 2, составить кроссворд по теме « Кислоты ».

МОЛОДЦЫ!














































