
Урок 8 23.10.17. 11-А классс
Пространственное строение
молекул

Цель:
- Обобщить и систематизировать знания о типах гибридизации атомных орбиталей в органических соединениях;
- научить применять данные знания для объяснения гибридизации в неорганических соединениях;
- Закрепить знания зависимости пространственного строения молекул частицы от типа гибридизации.

Повторение
1.Определите вид химической связи, составьте электронные
формулы образования веществ: NH 3 , Li 3 N, Cl 2 , Na 2 S, H 2 S, Mg.
2.Химическая связь ионная и ковалентная полярная в соединениях соответственно 1) сероводород и фторид серы (VI) 2) сульфид фосфора (V) и оксид натрия 3) хлорид рубидия и вода 4) оксид серы (IV) и кислород
3. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая 4) ковалентная неполярная и ионная
4. Атомную кристаллическую решётку имеет 1) метан 3) кислород 2) водород 4) кремний

5. Какие из приведённых утверждений верны? А. Вещества с молекулярной решёткой имеют низкие температуры плавления и низкую электропроводность. Б. Вещества с атомной решёткой пластичны и обладают высокой электрической проводимостью.
6. Ионы являются структурными частицами 1) Кислорода 3) углекислого газа 2) воды 4) хлорида натрия
7. Вещества, обладающие твёрдостью, тугоплавкостью, хорошей растворимостью в воде, как правило имеют кристаллическую решётку 1) молекулярную 3) атомную 2) ионную 4) металлическую
8. Вещества с атомной кристаллической решёткой 1) Очень твёрдые и тугоплавкие 2) хрупкие и легкоплавкие 3) проводят электрический ток в растворах
4) проводят электрический ток в расплавах.
9. Веществом молекулярного строения является 1) Озон 3) графит 2) оксид бария 4) сульфид калия
10. Определите степень окисления в соединениях:
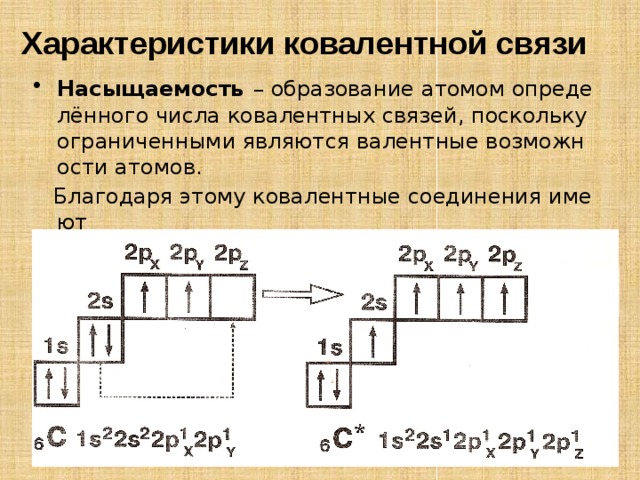
Характеристики ковалентной связи
- Насыщаемость – образование атомом определённого числа ковалентных связей, поскольку ограниченными являются валентные возможности атомов.
Благодаря этому ковалентные соединения имеют
строго определённый состав: CH 4 , N 2 , H 2 .
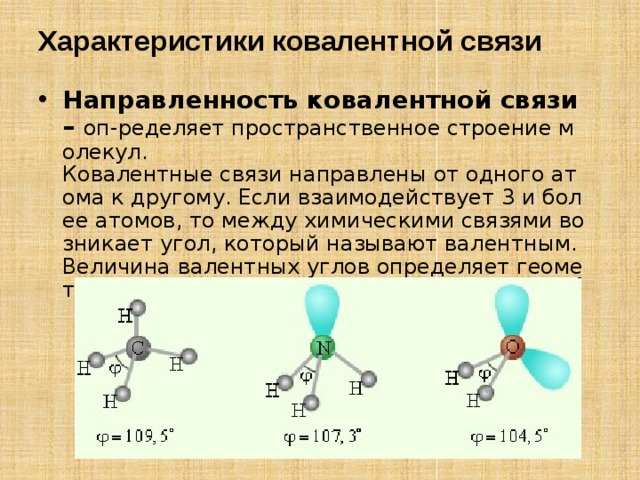
Характеристики ковалентной связи
- Направленность ковалентной связи – оп-ределяет пространственное строение молекул. Ковалентные связи направлены от одного атома к другому. Если взаимодействует 3 и более атомов, то между химическими связями возникает угол, который называют валентным. Величина валентных углов определяет геометрию молекулы.
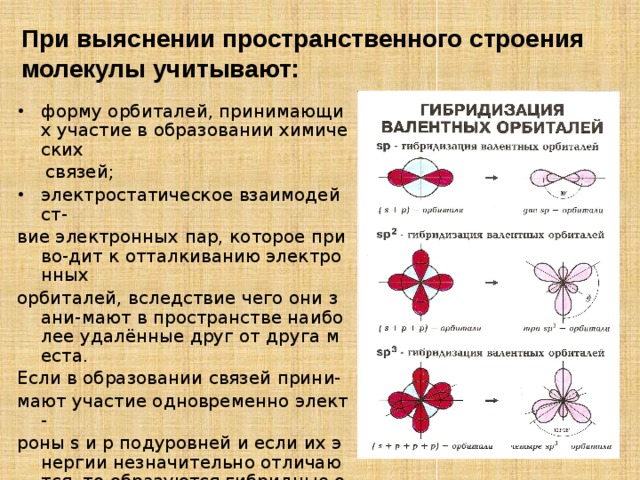
При выяснении пространственного строения молекулы учитывают:
- форму орбиталей, принимающих участие в образовании химических
связей;
- электростатическое взаимодейст-
вие электронных пар, которое приво-дит к отталкиванию электронных
орбиталей, вследствие чего они зани-мают в пространстве наиболее удалённые друг от друга места.
Если в образовании связей прини-
мают участие одновременно элект-
роны s и p подуровней и если их энергии незначительно отличаются, то образуются гибридные облака.

Гибридизация - процесс выравнивания
электронных облаков по форме и энергии
Основные положения теории гибридизации.
- Гибридизуются только орбитали центрального атома
- Степень гибридизации тем больше, чем ближе АО по энергии , и чем больше их геометрическое перекрывание (наибольшее перекрывание – с участием s-АО)
- Число гибридных орбиталей равно суммарному числу исходных
орбиталей
4.Гибридные орбитали более вытянуты в пространстве и обеспечивают более полное перекрывание с АО соседних атомов
5.Гибридные орбитали участвуют в образовании только σ -связей
6.Теория гибридизации объясняет направленность ковалентной связи и геометрическое строение молекул и кристаллов
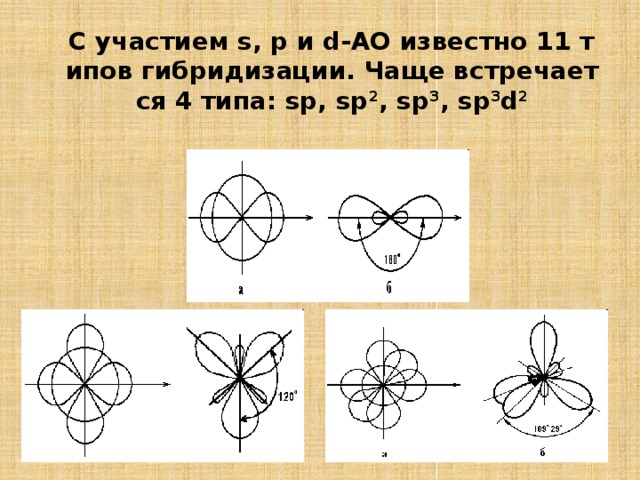
С участием s, p и d-АО известно 11 типов гибридизации. Чаще встречается 4 типа: sp, sp 2 , sp 3 , sp 3 d 2

Определение типа гибридизации на примере молекулы метана.
1.Написать полную структурную фор-мулу вещества.
2.Подсчитать число электронов, предос-тавляемые центральным атомом.
3.Подсчитать число электронов, предоставляе-мые соседними атомами.
4.Подсчитать число электронов, приходящихся на пи -связь.
0
5.Полученный результат разделить на два.
-
4
+
4
0
--------------
2
расположение тетраэдр
6.Если 4 –
расположение плоское тригональное
Если 3 -
расположение линейное
Если 2-
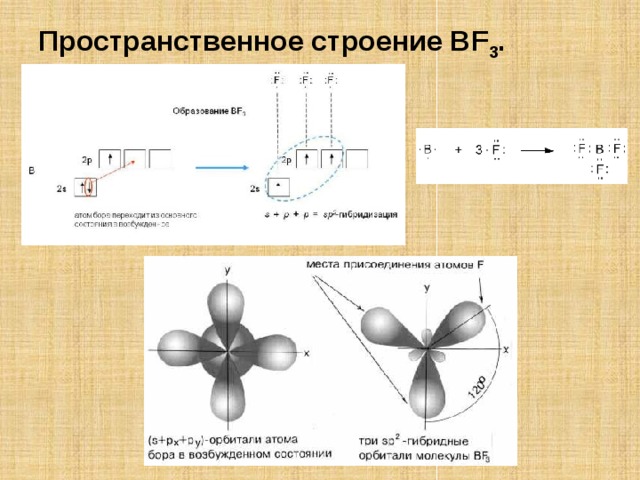
Пространственное строение BF 3 .
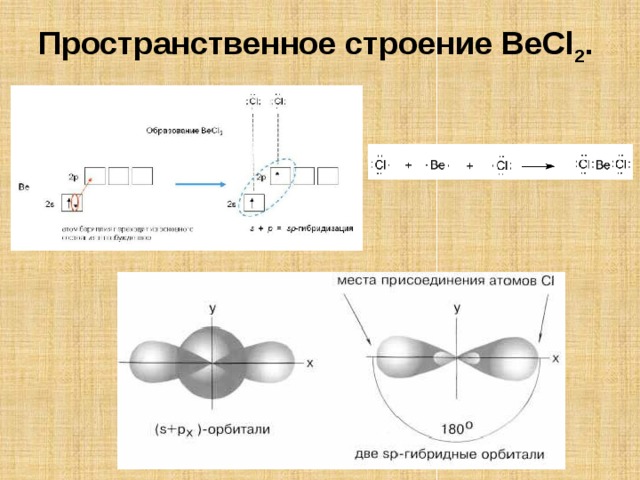
Пространственное строение BeCl 2 .
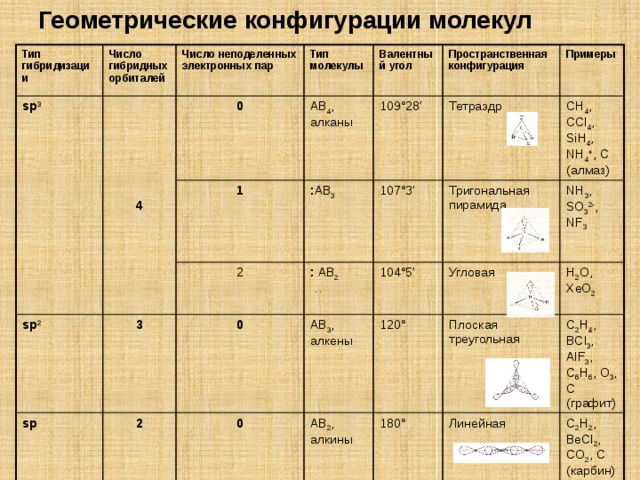
Геометрические конфигурации молекул
Тип гибридизации
Число гибридных орбиталей
sp 3
Число неподеленных электронных пар
4
Тип молекулы
0
1
Валентный угол
AB 4 , алканы
sp 2
2
sp
: AB 3
3
109 °28’
Пространственная конфигурация
107 °3’
2
: AB 2
0
Примеры
Тетраэдр
0
AB 3 , алкены
104 °5’
. .
CH 4 , CCl 4 , SiH 4 , NH 4 + , С (алмаз)
Тригональная пирамида
120 °
AB 2 , алкины
Угловая
NH 3 , SO 3 2- , NF 3
180 °
H 2 O, XeO 2
Плоская треугольная
C 2 H 4 , BCl 3 , AlF 3 , C 6 H 6 , O 3 , C (графит)
Линейная
C 2 H 2 , BeCl 2 , CO 2 , C (карбин)

Вопросы для закрепления
Даны формулы веществ:
а) C 2 H 4 ; г) Н 2 О; ж) С (алмаз); к) C 2 H 2 ;
б) CH 4 ; д) BCl 3 ; з) C (карбин); л) C 6 H 6 ;
в)BeH 2 ; е) NH 3 ; и) С (графит); м) SiCl 4 .
- Выберите формулы веществ, имеющих направленность связей,
обусловленную
sp 3 -гибридизацией
sp 2 -гибридизацией

3. Анионы PO 4 3- , SO 4 2- , ClO 4 - имеют
тетраэдрическое строение.
Анионы BO 3 3- , CO 3 2- , NO 3 - имеют форму плоского треугольника.
Какой тип гибридизации характерен для центральных атомов данных анионов?









































