Просмотр содержимого документа
«Презентация "Спирты"»

Презентация по химии тема «Спирты»
Определение
- Спирты ́ (устаревшее алкого́ли) — органические соединения, содержащие одну или несколько гидроксильных групп ( гидроксил, OH ),непосредственно связанных
с атомом углерода в углеводородном
радикале.
- Общая формула спиртов С х H y (OH) n .
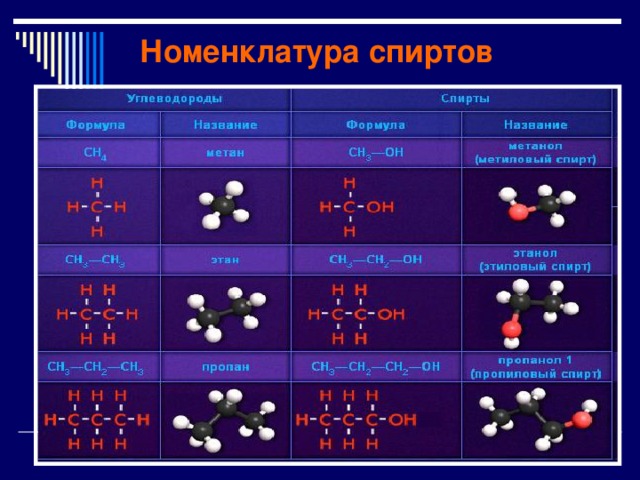
Номенклатура спиртов

Названия спиртов
- Названия одноатомных спиртов образуются от названия углеводорода с самой длинной углеродной цепью, содержащей гидроксильную группу, путём добавления суффикса - ол. Положение гидроксильной группы в главной цепи молекулы указывают цифрой после суффикса - ол.
- Для многоатомных спиртов перед суффиксом -ол по-гречески
(-ди-, -три-, ...) указывается количество
гидроксильных групп.

Простейшие спирты – предельные одноатомные спирты ( алканолы)
- Предельными одноатомными спиртами ( алканолами) называют органические соединения, в молекулах которых алкильный радикал (R) связан с гидроксильной группой.
- Состав их соответствует общей формуле R-OH, или C n H 2n+1 OH
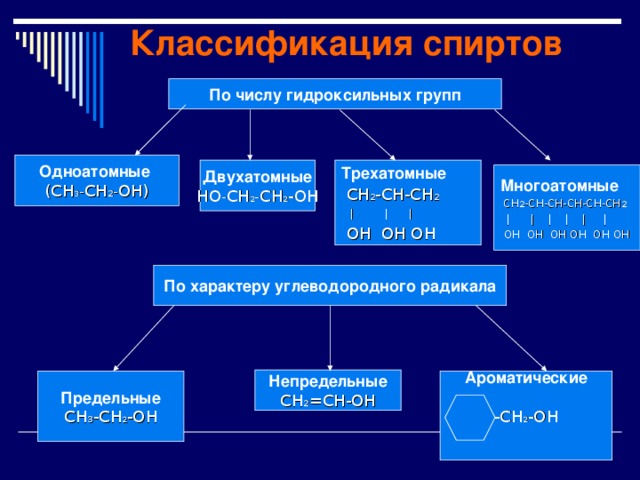
Классификация спиртов
По числу гидроксильных групп
Одноатомные
(СН 3 - CH 2 - ОН)
Двухатомные
Трехатомные
СН 2 -СН-СН 2
| | |
ОН ОН ОН
НО - СН 2 - СН 2 -ОН
Многоатомные
СН 2 -СН-СН- CH-CH- СН 2
| | | | | |
ОН ОН ОН ОН OH OH
По характеру углеводородного радикала
Непредельные
СН 2 =СН-ОН
Ароматические
Предельные
-СН 2 -ОН
СН 3 -СН 2 -ОН
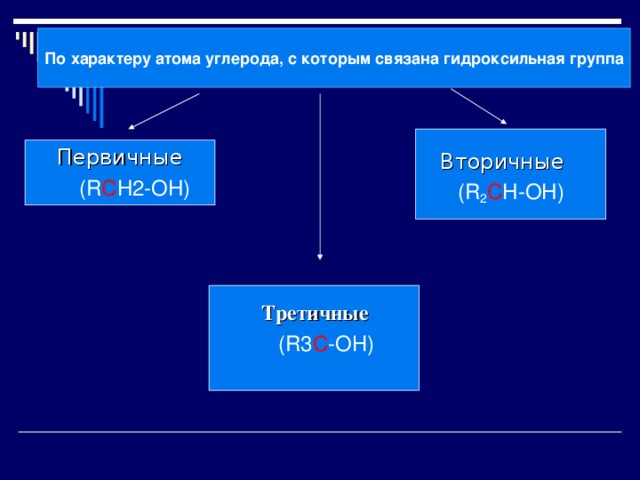
По характеру атома углерода, с которым связана гидроксильная группа
Первичные
(R C H2-OH)
Вторичные
(R 2 C H-OH)
Третичные
(R3 С -ОН)
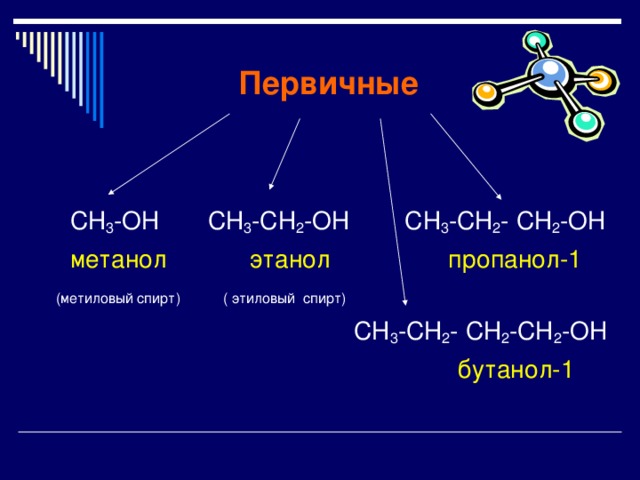
Первичные
СН 3 -ОН СН 3 -СН 2 -ОН СН 3 -СН 2 - СН 2 -ОН
метанол этанол пропанол-1
(метиловый спирт) ( этиловый спирт)
СН 3 -СН 2 - СН 2 -CН 2 -OH
бутанол-1
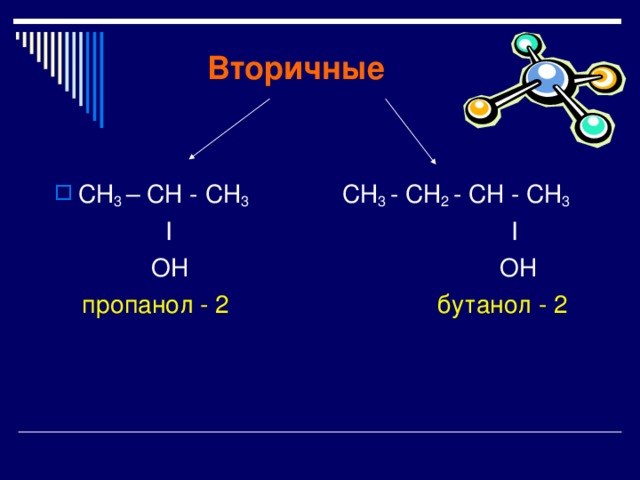
Вторичные
- СН 3 – СН - СН 3 СН 3 - СН 2 - CH - СН 3
I I
OH OH
пропанол - 2 бутанол - 2
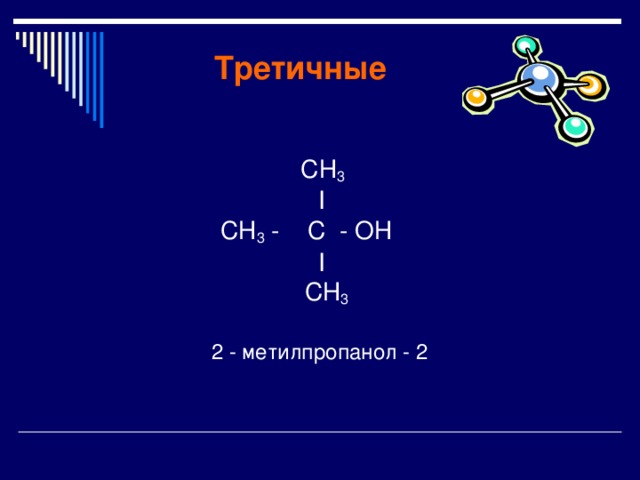
Третичные
СН 3
I
СН 3 - C - OН
I
СН 3
2 - метилпропанол - 2

Изомерия спиртов
1. Изомерия углеродного скелета (соединения отличаются порядком расположения углерод-углеродных связей)
CH3-CH2-CH2-CH2-OH CH3-CH-CH2-OH
|
CH3
(бутанол-1) (2-метилпропанол-1)
2. Изомерия положения функциональной OH- группы ( т.е. группы атомов, определяющих принадлежность соединения к тому или иному классу органических соединений)
CH3-CH2-CH2-OH CH3-CH-CH3
I
OH
(пропанол-1) ( пропанол-2)

3. Необходимо отметить, что для спиртов характерен еще один вид изомерии – межклассовая ( предельные одноатомные спирты изомерны простым эфирам).
Например : этиловый спирт (С 2 H 5 OН) и диметиловый эфир(СH 3 -О-СН 3 )– изомеры: эти вещества имеют одинаковый состав, но разное строение, т.е. различный порядок соединения атомов в молекулах, а потому и разные свойства.
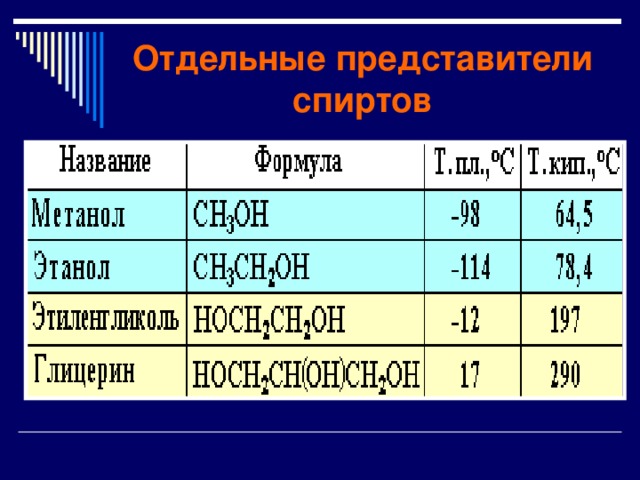
Отдельные представители спиртов

Метанол ( метиловый спирт)
с температурой кипения
64,7 0 С, с характерным запахом.
Легче воды. Горит чуть
голубоватым пламенем.
древесный спирт.
СО+2Н 2 →СН 3 ОН
растворитель, его используют для производства формальдегида,
некоторых лекарственных веществ.
Метанол наряду с этанолом можно добавлять в моторное топливо для увеличения октанового числа.

Метанол – очень ядовит!
Метанол – нервно-сосудистый яд!
- Ядовитое действие метанола основано на поражении нервной и сосудистой системы. Приём внутрь 5—10 мл метанола приводит к тяжёлому отравлению, наступает паралич зрения и впоследствие поражения сетчатки глаз. Доза в 30 мл и более вызывает СМЕРТЬ!

Этанол ( этиловый спирт)
- Бесцветная жидкость с температурой кипения 68,73 0 С, с характерным запахом и жгучим вкусом.
- Легче воды. Смешивается с ней в любых соотношениях.
- Легко воспламеняется, горит слабо светящимся голубоватым пламенем.

Вредное воздействие этанола
- При попадании в организм этилового спирта происходит снижение болевой чувствительности и блокировка процессов торможения в коре головного мозга – наступает состояние опьянения.
- В начале опьянения страдают структуры коры больших полушарий; активность центров мозга, управляющих поведением, подавляется: утрачивается разумный контроль над поступками, снижается критическое отношение к себе. И. П. Павлов называл такое состояние «буйством подкорки».
- При очень большом содержании алкоголя в крови угнетается активность двигательных центров мозга, главным образом страдает функция мозжечка - человек полностью теряет ориентацию.

Вредное воздействие этанола
- Алкоголь крайне неблагоприятно влияет на сосуды головного мозга. В начале опьянения они расширяются, кровоток в них замедляется, что приводит к застойным явлениям в головном мозге. Затем, когда в крови помимо алкоголя начинают накапливаться вредные продукты его неполного распада, наступает резкий спазм, сужение сосудов, развиваются такие опасные осложнения, как мозговые инсульты, приводящие к тяжелой инвалидности и даже смерти.

Вредное воздействие этанола
- Изменения структуры мозга, вызванные многолетней алкогольной интоксикацией, почти необратимы, и даже после длительного воздержания от употребления спиртных напитков они сохраняются. Если же человек не может остановиться, то органические и, следовательно, психические отклонения от нормы идут по нарастающей.
- Систематическое употребление этилового спирта и содержащих его напитков приводит не только к стойкому снижению продуктивности работы головного мозга, но и к гибели клеток печени и замене их соединительной тканью – циррозу печени.

Применение этанола
- Этиловый спирт употребляется при приготовлении различных спиртных напитков
- В медицине для приготовления экстрактов из лекарственных растений, а также для дезинфекции.
- В косметике и парфюмерии этанол — растворитель для духов и лосьонов

Применение этанола
- 1. производство уксусной кислоты;
- 2. косметика и парфюмерия;
- 3. медицинские препараты;
- 4. лекарственные средства;
- 5. производство сложных эфиров;
- 6. производство лаков;
- 7,8 производство синтетических каучуков

Многоатомный спирт -этиленгликоль
- Этиленгликоль — представитель предельных двухатомных спиртов — гликолей.
- Название гликоли получили вследствие сладкого вкуса многих представителей ряда (греч. «гликос» — сладкий).
- Этиленгликоль - сиропообразная жидкость сладкого вкуса, без запаха, ядовит. Хорошо смешивается с водой и спиртом, гигроскопичен.

Применение этиленгликоля
- Важным свойством этиленгликоля является способность понижать температуру замерзания воды, от чего вещество нашло широкое применения как компонент автомобильных антифризов и незамерзающих жидкостей.
- Он применяется для получения лавсана (ценного синтетического волокна).

Этиленгликоль – яд !
- Дозы вызывающие смертельное отравление этиленгликолем варьируются в широких пределах - от 100 до 600 мл . Смертельной дозой для человека является 50-150 мл . Смертность при поражении этиленгликолем очень высока и составляет более 60% всех случаев отравления.
- Механизм токсического действия этиленгликоля до настоящего времени изучен недостаточно. Этиленгликоль быстро всасывается (в том числе через поры кожи) и в течение нескольких часов циркулирует в крови в неизмененном виде, достигая максимальной концентрации через 2-5 часов. Затем его содержание в крови постепенно снижается, и он фиксируется в тканях.

Многоатомный спирт - глицерин
CH2 – CH – CH2
OH OH OH
- Глицерин – трехатомный предельный спирт.
- Бесцветная, вязкая, гигроскопичная, сладкая на вкус жидкость.
- Смешивается с водой в любых отношениях , неограниченно растворим в воде.
- Реагирует с азотной кислотой с образованием нитроглицерина.
- С карбоновыми кислотами образует жиры и масла .
- Глицерин в отличие от этиленгликоля- не ядовит.

Качественной реакцией на многоатомные спирты является их взаимодействие со свежеполученным осадком гидроксида меди( II), который растворяется с образованием ярко- синего раствора

Применение глицерина
- В производстве взрывчатых веществ, в частности тринитрата глицерина.
- При обработке кожи, для предотвращения от высыхания.
- В текстильной промышленности для придания тканям мягкости и шелковистости.
- Как компонент некоторых клеeв.
- При производстве пластмасс в качестве пластификатора – компонента, придающего материалу гибкость и эластичность.
- В производстве кондитерских изделий и напитков (как пищевая добавка E422).
- Широко используется в парфюмерной промышленности: входит в состав кремов, помад, зубных паст, предотвращая их от высыхания и способствуя увлажнению и смягчению кожи.
- Несмотря на взрывоопасность этого вещества, в очень малых дозах его применяют в медицине в качестве сосудорасширяющего средства при сердечно-сосудистых заболеваниях.