Муниципальное автономное образовательное учреждение
«Школа №1» Камышловского городского округа
имени Героя Советского Союза Бориса Самуиловича Семёнова
Ферменты и их роль в организме человека
Выполнила: ученица 10 класса,
Мирзоева Мукаддас
Руководитель:
Шувалова Елена Николаевна,
учитель химии и биологии,
I квалификационной категории
Камышлов, 2019
Оглавление
Введение 3
Основная часть 7
РАЗДЕЛ I. Ферменты в живых организмах 7
1.1. История изучения ферментов 7
1.2. Ферменты: понятие, классификация 8
1.3. Значение ферментов для здоровья человека 11
РАЗДЕЛ II. Ферменты пищеварительной системы человека 13
2.1. Пищеварительная система человека 13
2.2. Ферменты и пищеварительная система человека 14
2.3. Растительные (пищевые) ферменты 16
РАЗДЕЛ III. Принципы работы и факторы активности ферментов 19
3.1. Работа ферментов 19
3.2. Факторы, определяющие активность энзимов 20
3.3. Значение ферментов 22
3.4. Энзимопатология 23
РАЗДЕЛ IV. Практическая часть 25
4.1 Определение фермента уреазы в различных растительных объектах 25
4.2. Обнаружение и роль фермента каталазы в живых организмах 26
4.3. Обнаружение и действие фермента слюны амилазы на крахмал 26
Заключение 30
Список используемых источников и литературы 31
Приложения…………………………………………………………………………32
Введение
Все химические процессы, протекающие в живых организмах, контролируются ферментами.
Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ в другие, ими катализируется около 4000 биореакций.
Современная медицина широко использует достижения энзимологии – науки о ферментах. Так, ферменты используются для лечения различных заболеваний, в том числе и наследственных, вызванных нарушением синтеза того или иного фермента или резким перепадом субстрата, на который организм не смог среагировать по причине, например, ослабленного иммунитета. Также ферменты применяют для лучшего вживания и устойчивости в организме искусственных органов, протезов, их применяют в различных перевязочных материалах для ускорения заживления ран и ожогов, для разрушения тромбов.
Пищеварительные ферменты – одна из наиболее часто используемых в гастроэнтерологии групп препаратов, которые безрецептурно широко используются населением. Основным показанием для использования ферментных средств является состояние нарушенного переваривания и всасывания пищевых веществ.
Ни для кого не секрет, что хорошее пищеварение – это неотъемлемое условие полноценной жизни и активного долголетия. Пищеварительные ферменты играют в этом процессе решающую роль. Они отвечают за переваривание, адсорбцию и усвоение пищи, выстраивая наше тело подобно рабочим на стройке. У нас могут быть все строительные материалы – минералы, белки, жиры, вода, витамины, но без ферментов, как без рабочих, строительство не продвинется ни на шаг.
Современный человек потребляет слишком много «мёртвой пищи» пищи, в которой практически нет ферментов.
Если человек съедает свежее яблоко, оно переварится за счет собственных энзимов. Но если человек употребит запеченное яблоко, чтобы его переварить, организму придется задействовать свои собственные ферменты для пищеварения, так как термически обработанная пища лишена естественных энзимов. Кроме того, те ферменты, которые «мертвые» продукты забирают у нашего организма, мы теряем навсегда, так как их запасы в нашем теле не безграничны.
Все это отражается на состоянии здоровья как отдельно взятого человека, так и нации в целом. Пищеварительные заболевания значительно молодеют. По данным Минздрава РФ, заболевания пищеварительного тракта занимают лидирующие позиции в списке. На снижение этих показателей направлены различные меры: научные медицинские исследования, профилактическая информационная работа с населением через СМИ, включение вопросов о ферментах и их роли в жизни человека в программу школьной подготовки по биологии.
Проблема низкого уровня осведомленности населения о функциях и значимости поддержания баланса энзимов в организме подтверждается и результатами нашего исследования, проведенного среди учащихся и родителей МАОУ "Школа №1" КГО (приложение1)
В связи с вышеизложенным можно выделить противоречия:
между значимостью ферментов в жизнедеятельности, обеспечении здоровья человека в целом, пищеварительной системы в частности и высокими статистическими показателями болезней пищеварительного тракта, вызванных дисбалансом энзимов в организме;
между эффективностью существующих методов поддержания баланса энзимов в организме и нерегулярностью их использования людьми в действительности;
между эффективностью профилактической работы с учащимися в области здоровьесбережения и ее недостаточностью в реальности.
Данные противоречия подчеркивают актуальность нашего исследования и указывают на проблему недостаточной разработанности мероприятий, обеспечивающих ценность здорового образа жизни учащихся, в т.ч. посредством поддержания баланса ферментов в организме.
Актуальность: в 10 классе при изучении темы «Ферменты» было выделено достаточно мало времени, а мне захотелось узнать больше о свойствах и значении ферментов в жизни живых организмов, ведь я планирую связать свою жизнь с медициной. Для этого я решила написать исследовательскую работу о ферментах. Актуальность работы заключается в повышении уровня теоретической и практической осведомлённости о роли ферментов в живых организмах, моей готовности, как будущего медицинского работника, к повышению медицинской грамотности населения.
Исходя из актуальности проблемы, мной выбрана тема исследования "Ферменты и их роль в организме человека".
Объект: ферменты живых организмов
Предмет: обнаружение и исследование свойств ферментов.
Гипотеза: если нет ферментов то нет и жизни.
Цель: провести исследование по обнаружению ферментов в живых организмах, рассмотреть их свойства и значение.
Для достижения цели необходимо решить следующие задачи:
изучить историю происхождения ферментов;
изучить понятие, строение, классификацию ферментов и их роль в живых организмах на основе анализа литературных источников;
изучить особенности пищеварительной системы человека и связь ее отделов с ферментами;
определить факторы влияющие на скорость работы ферментов в организме;
обосновать роль ферментов в организме посредством проведения практических опытов;
разработать рекомендации по поддержанию баланса ферментов в организме;
разработать и провести внеклассное мероприятие по теме «Роль ферментов в жизни человека»
В ходе выполнения исследования использовались следующие виды источников:
- теоретические и практико-ориентированные исследования в области энзимологии;
- публикации в периодической печати по вопросам энзимологии;
- словари, справочники, энциклопедии, другие издания справочного характера, содержащие общепринятые определения основных понятий;
- ресурсы сети Интернет, освещающие современные проблемы в области энзимологии.
В ходе работы использовался комплекс методов исследования, позволивший адекватно разрешить поставленные задачи, а именно: изучение и анализ указанных выше литературных источников различных видов; теоретический анализ; эксперимент, метод сравнения, тестирование, метод наблюдения.
Практическая значимость проекта заключается в апробировании опытов по обнаружению ферментов и исследованию среды, в которой они действуют, а также в проведении внеклассного мероприятия с наглядной демонстрацией опытов с целью повышения осведомленности учащихся о значимости ферментов в организме.
Результат: разработать и провести внеклассное мероприятие по теме
«Ферменты и их роль в организме человека».
Основная часть РАЗДЕЛ I. Ферменты в живых организмах 1.1. История изучения ферментов
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения. В конце ХVIII — начале XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен.
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой (ферментом), находящейся в дрожжевых клетках, причём он считал, что эти «силы» неотделимы от структуры живой клетки дрожжей. Эта точка зрения господствовала в науке в течение длительного времени и шла вразрез с господствовавшей тогда теорией брожения Ю. Либиха, согласно которой все процессы брожения представлялись чисто химическими явлениями каталитического характера. Различные точки зрения о природе спиртового брожения в теоретическом споре Л. Пастера с одной стороны, и механицистов М. Бертло и Ю. Либиха — с другой привели к разделению в научной среде двух соответствующих терминов. Собственно, ферментами (от лат.fermentum — закваска) стали называть «организованные ферменты», то есть сами живые микроорганизмы. В противовес этому подходу в 1876 году В. Кюне предложил термин энзим (от греч.ἐν- — в- и ζύμη — дрожжи, закваска, то есть «в дрожжах») для обозначения «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза).
Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено ещё несколько ферментов и белковая природа ферментов была окончательно доказана.
Каталитическая активность РНК впервые была обнаружена в 1980-е годы у пре-рРНК Томасом Чеком, изучавшим сплайсинг РНК у инфузории Tetrahymena thermophila. Рибозимом оказался участок молекулы пре-рРНК Tetrahymena, кодируемый интроном внехромосомного гена рДНК; этот участок осуществлял аутосплайсинг, то есть сам вырезал себя при созревании рРНК.
1.2. Ферменты: понятие, классификация
Ферменты, или как их называют энзимы – это белковые молекулы, ускоряющие химические реакции в живых биологических системах.
Их можно определить как биологические катализаторы, то есть, как вещества, ускоряющие реакции без которых организм не смог бы поддерживать жизнь [6].
Обычно ферменты именуют по типу катализируемой реакции, добавляя суффикс -аза к названию субстрата (например, лактаза — фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название или один и тот же фермент имеет два и более названий. Такие ферменты различают по другим свойствам, например, по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФаза). Многие ферменты имеют исторически сложившиеся тривиальные названия, не связанные с названиями их субстратов, например, пепсин и трипсин. Из-за этих и других затруднений, а также вследствие всевозрастающего числа вновь открываемых ферментов было принято международное соглашение о создании систематической номенклатуры и классификации ферментов. Было решено разработать рациональную международную классификацию которой могли бы пользоваться ученые всех стран. Для этой цели в 1956 г. была создана Международная комиссия по ферментам, включающая крупнейших энзимологов мира. От Советского Союза в нее вошли академики А. Е. Браунштейн и В. А. Энгельгардт. Потребовалось несколько лет упорного труда, чтобы выполнить эту задачу. Первый вариант номенклатуры был опубликован в 1964 г. Он включал список из 874 индивидуальных ферментов. На этом работа не окончилась. После исправлений и дополнений в 1972 г. вышел второй вариант уже с 1770 ферментами, который снова был дополнен. Это объемистая книга – более 300 страниц со списком, в котором перечислено около 2000 ферментов [6].
Классификация ферментов По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие перенос электронов, то есть окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа.
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза.
Гидролазы-класс ферментов, катализирующих реакции расщепления органических соединений при участии воды(реакции гидролиза). Эти реакции протекают по следующей схеме:

Общая схема этих реакций:

КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата с образованием изомерных форм.
КФ 6: Лигазы, катализирующие образование химических связей C—C, C—S, C—O и C—N между субстратами за счёт реакций конденсации, сопряжённых с гидролизом АТФ. Пример: лигаза.
Второе число в наименовании фермента отражает подкласс, третье — подподкласс, а четвёртая — порядковый номер фермента в его подподклассе.
Все ферменты можно разделить на 3 большие группы
Пищеварительные – действуют в желудочно-кишечном тракте, отвечают за переработку питательных веществ и их абсорбцию в системный кровоток. Энзимы, что выделяются стенками тонкой кишки и поджелудочной железой, называются панкреатическими.
Пищевые (растительные) – поступают (должны поступать) с пищей. Продукты, в которых присутствуют пищевые ферменты, иногда называют живой едой.
Метаболические – запускают обменные процессы внутри клеток. Каждая система человеческого организма имеет свою сеть ферментов.
Пищеварительные ферменты, в свою очередь, делятся на 3 категории:
Амилазы – амилаза слюны, лактаза поджелудочного сока, мальтаза слюны. Эти энзимы присутствуют и в слюне, и в кишечнике. Действуют на углеводы: последние распадаются на простые сахара и легко проникают в кровь;
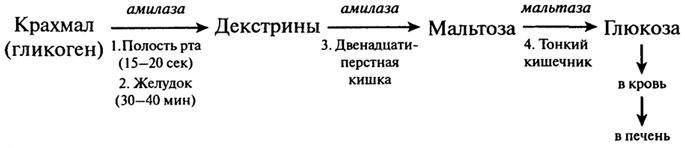
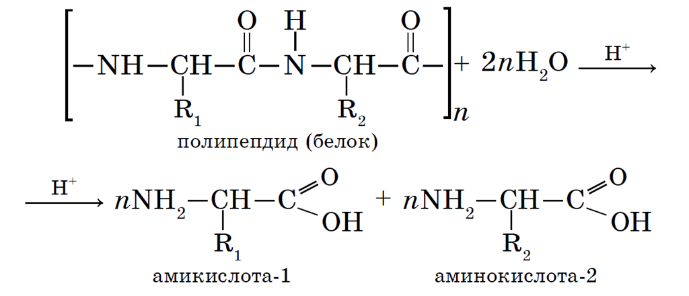
Протеазы – вырабатываются поджелудочной железой и слизистой оболочкой желудка. Помогают переваривать белки, а также нормализуют микрофлору пищеварительного тракта. Присутствуют в кишечнике и желудочном соке. К протеазам относятся пепсин и химозин желудка, эрепсин килечного сока, карбоксипептидаза поджелудочной железы, химотрипсин, трипсин;
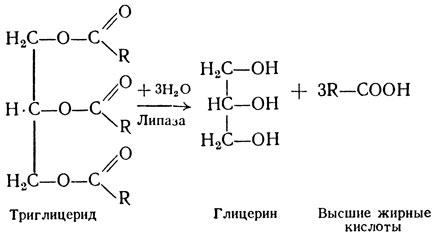
Липаза – вырабатывается поджелудочной железой. Присутствует в желудочном соке. Помогает расщеплять и усваивать жиры.
1.3. Значение ферментов для здоровья человека
К настоящему времени известно уже более 3 тысяч ферментов. Каждая клеточка живого организма содержит сотни разнообразных энзимов. Без них невозможно не только переваривание пищи и ее превращение в те вещества, которые клетки способны усвоить. Ферменты принимают участие в процессах обновления кожи, крови, костей, регуляции обмен веществ, очищении организма, заживлении ран, зрительном и слуховом восприятии, работе центральной нервной системы, реализации генетической информации. Дыхание, мышечное сокращение, работа сердца, рост и деление клеток – все эти процессы поддерживаются бесперебойной работой ферментных систем.
Энзимы играют чрезвычайно важную роль в поддержке нашего иммунитета. Специализированные ферменты участвуют в выработке антител, необходимых для борьбы с вирусами и бактериями, активизируют работу макрофагов – больших хищных клеток, что распознают и обезвреживают любые инородные частицы, попадающие в организм. Удаление продуктов жизнедеятельности клеток, обезвреживание ядов, защита от проникновения инфекции – все это функции ферментов.
Самыми распространенными и изученными на сегодняшний день являются пищеварительные ферменты человека. Рассмотрим их особенности и возможности применения подробнее [6].
РАЗДЕЛ II. Ферменты пищеварительной системы человека 2.1. Пищеварительная система человека
Благодаря наличию пищеварительной системы (см. рисунок 1) происходит сложный физиологический процесс, в ходе которого пища, поступающая в организм, подвергается физическим и химическим изменениям и всасывается в кровь. Данный процесс называется пищеварением. Систему органов пищеварения образуют ротовая полость, пищевод, желудок, кишечник, пищеварительные железы.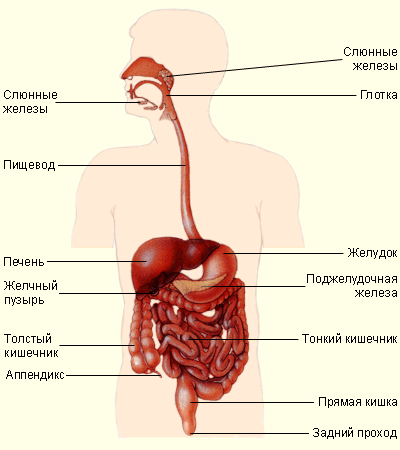
Рис.1. – пищеварительная система человека
В ротовой полости происходит первичная обработка пищи, которая состоит в её механическом измельчении с помощью языка и зубов и превращении в пищевой комок. Слюнные железы выделяют слюну, ферменты которой начинают расщепление содержащихся в пище углеводов. Затем через глотку и пищевод пища попадает в желудок, где под действием желудочного сока переваривается.
Желудок представляет собой толстостенный мышечный мешок, находящийся под диафрагмой в левой половине брюшной полости. Путём сокращения стенок желудка его содержимое смешивается. Множество желёз, сосредоточенных в слизистой стенке желудка, выделяют желудочный сок, содержащий ферменты и соляную кислоту. После этого частично переваренная пища попадает в передний отдел тонкого кишечника – двенадцатиперстную кишку.
Тонкий кишечник состоит из двенадцатиперстной, тощей и подвздошной кишок. В двенадцатиперстной кишке пища подвергается действию поджелудочного сока, желчи, а также соков желез, находящихся в её стенке. В тощей и подвздошной кишках происходит окончательное переваривание пищи и всасывание питательных веществ в кровь.
Непереваренные остатки поступают в толстую кишку. Здесь они накапливаются и подлежат удалению из организма. Начальная часть толстой кишки называется слепой. От неё отходит червеобразный отросток – аппендикс.
К пищеварительным железам относятся слюнные железы, микроскопические железы желудка и кишечника, поджелудочная железа и печень. Печень – самая крупная железа человеческого организма. Она располагается справа под диафрагмой. В печени вырабатывается желчь, которая по протокам поступает в желчный пузырь, где накапливается и по мере надобности поступает в кишечник. Печень задерживает ядовитые вещества и защищает организм от отравления.
К пищеварительным железам, выделяющим соки и превращающим сложные питательные вещества в более простые и растворимые в воде, относится и поджелудочная железа. Она находится между желудком и двенадцатиперстной кишкой. Сок поджелудочной железы содержит ферменты, расщепляющие белки, жиры и углеводы. В сутки выделяется 1–1,5 литра сока поджелудочной железы.
2.2. Ферменты и пищеварительная система человека
Пищеварительные энзимы бывают нескольких типов. В человеческом организме разные виды ферментов содержатся на разных участках пищеварительного тракта.
Ротовая полость.
На этом этапе на пищу воздействует альфа-амилаза. Она расщепляет углеводы, крахмалы, которые содержатся в картофеле, фруктах, овощах и других продуктах питания.
Желудок
Здесь пепсин расщепляет белки до состояния пептидов, а желатиназа – желатин и коллаген, содержащиеся в мясе.
Поджелудочна железа.
На этом этапе «работают»:
трипсин – отвечает за расщепление белков;
альфа-химотрипсин – помогает усвоению протеинов;
эластазы – расщепляют некоторые виды белков;
нуклеазы – помогают расщеплять нуклеиновые кислоты;
стеапсин – способствует усвоению жирной пищи;
амилаза – отвечает за усвоение крахмалов;
липаза – расщепляет жиры (липиды), содержащиеся в молочных продуктах, орехах, маслах и мясе.
Тонкая кишка.
Над пищевыми частицами «работают»:
пептидазы – расщепляют пептидные соединения к уровню аминокислот;
сахараза – помогает усваивать сложные сахара и крахмалы;
мальтаза – расщепляет дисахариды к состоянию моносахаридов (солодовый сахар);
лактаза – расщепляет лактозу (глюкозу, содержащуюся в молочных продуктах);
липаза – способствует усвоению триглицеридов, жирных кислот;
эрепсин – воздействует на протеины;
изомальтаза – «работает» с мальтозой и изомальтозой.
Толстая кишка.
Здесь функции ферментов выполняют:
Кроме названных энзимов, существуют еще:
диастаза – переваривает растительный крахмал;
инвертаза – расщепляет сахарозу (столовый сахар);
глюкоамилаза – превращает крахмал в глюкозу;
альфа-галактозидаза – способствует перевариванию бобов, семян, соевых продуктов, корневых овощей и листовых;
бромелайн – фермент, полученный из ананасов, способствует расщеплению разных видов белков, эффективен при разных уровнях кислотности среды, обладает противовоспалительными свойствами;
папаин – фермент, выделенный из сырой папайи, способствует расщеплению мелких и крупных протеинов, эффективен в широком диапазоне субстратов и кислотности.
целлюлаза – расщепляет целлюлозу, растительные волокна (в человеческом организме не обнаружена);
эндопротеаза – расщепляет пептидные связи;
экстракт бычьей желчи – энзим животного происхождения, стимулирует моторику кишечника;
панкреатин – фермент животного происхождения, ускоряет переваривание жиров и белков;
панкрелипаза – животный фермент, способствует усвоению белков, углеводов и липидов;
пектиназа – расщепляет полисахариды, содержащиеся во фруктах;
фитаза – способствует усвоению фитиновой кислоты, кальция, цинка, меди, марганца и других минералов;
ксиланаза – расщепляет глюкозу из зерновых.
2.3. Растительные (пищевые) ферменты
Употребление продуктов, богатых ферментами, не только облегчает пищеварение, но и высвобождает энергию, которую организм может направить на очистку печени, омоложение клеток, защиту от опухолей и т.д. При этом человек ощущает легкость в животе, чувствует себя бодрым, да и выглядит хорошо. А сырая растительная клетчатка, поступающая в организм с живой пищей, требуется для питания микроорганизмов, что вырабатывают метаболические ферменты.
Растительные энзимы дают нам жизнь и энергию. Если вы посадите в землю два орешка – один жареный, а другой сырой, вымоченный в воде, то жареный просто сгниет в земле, а в сыром зернышке весной проснутся жизненные силы, потому что в нем есть ферменты. И вполне возможно, что из него вырастет большое пышное дерево. Так и человек, потребляя пищу, в которой есть ферменты, вместе с ней получает жизнь. Продукты, лишенные энзимов, заставляют наши клетки работать без отдыха, перегружаться, стареть и умирать. Если ферментов не хватает, в организме начинают накапливаться «отходы»: яды, шлаки, погибшие клетки. Это ведет к увеличению веса, болезням и раннему старению. Любопытный и в то же время печальный факт: в крови пожилых людей содержание ферментов примерно в 100 раз ниже, чем у молодых.
Источниками пищевых энзимов являются растительные продукты из огорода, сада, океана. Это преимущественно овощи, фрукты, ягоды, зелень, зерновые культуры. Собственные ферменты содержат бананы, манго, папайя, ананасы, авокадо, проращенные зерна. Растительные ферменты присутствуют только в сырой, живой пище.
Проростки пшеницы являются источником амилазы (расщепляющей углеводы), в плодах папайи содержатся протеазы, в плодах папайи и ананаса – пептидазы. Источники липазы (расщепляющей жиры) – это плоды, семена, корневища, клубни злаковых культур, горчичное и подсолнечное семя, семена бобовых. Папаином (расщепляющим белки) богаты бананы, ананасы, киви, папайя, манго. Источником лактазы (фермента, расщепляющего молочный сахар) является ячменный солод.
Растительные ферменты начинают обрабатывать пищу уже в желудке, а панкреатические энзимы в кислой желудочной среде работать не могут. Когда пища попадет в тонкую кишку, благодаря растительным ферментам она будет предварительно переварена, это снизит нагрузку на кишечник и позволит питательным веществам лучше усвоиться. К тому же, растительные энзимы продолжают свою работу и в кишечнике.
Как питаться, чтобы организму хватало ферментов?
Все очень просто. Завтрак должен состоять из свежих ягод и фруктов (плюс белковые блюда – творог, орехи, сметана). Каждый прием пищи нужно начинать с овощных салатов с зеленью. Желательно, чтобы ежедневно один прием пищи включал только сырые фрукты, ягоды и овощи. Ужин должен быть легким – состоять из овощей (с кусочком куриной грудки, отварной рыбы или порцией морепродуктов). Несколько раз в месяц полезно устраивать разгрузочные дни на фруктах или свежеотжатых соках.
Для качественного усвоения пищи и полноценного здоровья энзимы просто незаменимы. Лишний вес, аллергии, различные заболевания ЖКТ – все эти и многие другие проблемы можно победить с помощью здорового рациона. А роль ферментов в питании огромна. Наша задача – просто позаботиться о том, чтобы каждый день и в достаточном количестве они присутствовали в наших блюдах [8].
РАЗДЕЛ III. Принципы работы и факторы активности ферментов 3.1. Работа ферментов
Сегодня можно часто услышать о пользе ферментов. Но что такое эти вещества, от которых зависит работоспособность нашего организма?
Энзимы – это биологические молекулы, жизненный цикл которых не определяется рамками от рождения и смерти. Они просто работают в организме до тех пор, пока не растворятся. Как правило, это происходит под воздействием других ферментов.
В процессе биохимической реакции они не становятся частью конечного продукта. Когда реакция завершена, фермент покидает субстрат. После этого вещество готово снова приступить к работе, но уже на другой молекуле. И так продолжается столько, сколько необходимо организму.
Уникальность ферментов в том, что каждый из них выполняет только одну, ему отведенную функцию. Биологическая реакция происходит только тогда, когда фермент находит правильный для него субстрат. Это взаимодействие можно сравнить с принципом работы ключа и замка – только правильно подобранные элементы смогут «сработаться».
Еще одна особенность: они могут работать при низких температурах и умеренном рН, а в роли катализаторов являются более стабильными, чем любые другие химические вещества.
Ферменты в качестве катализаторов ускоряют процессы метаболизма и другие реакции.
Как правило, эти процессы состоят из определенных этапов, каждый из которых требует работы определенного энзима. Без этого цикл преобразования или ускорения не сможет завершиться.
Пожалуй, из всех функций ферментов наиболее известна – роль катализатора. Это значит, что энзимы комбинируют химические реагенты таким образом, чтоб снизить энергетические затраты, необходимые для более быстрого формирования продукта. Без этих веществ химические реакции протекали бы в сотни раз медленнее. Но на этом способности энзимов не исчерпываются. Все живые организмы содержат энергию, необходимую им для продолжения жизни. Аденозинтрифосфат, или АТФ, это своего рода заряженная батарейка, которая снабжает клетки энергией. Но функционирование АТФ невозможно без ферментов. И главный энзим, производящий АТФ, – синтаза. Для каждой молекулы глюкозы, которая трансформируется в энергию, синтаза производит около 32-34 молекул АТФ [3].
3.2. Факторы, определяющие активность энзимов
Поскольку энзим способен ускорять реакции во много раз, его активность определяется так называемым числом оборотов. Этот термин обозначает количество молекул субстрата (реагирующего вещества), которую способна трансформировать 1 молекула фермента за 1 минуту. Однако существует ряд факторов, определяющих скорость реакции:
Концентрация субстрата.
Увеличение концентрации субстрата ведет к ускорению реакции. Чем больше молекул действующего вещества, тем быстрее протекает реакция, поскольку задействовано больше активных центров. Однако ускорения возможно только до тех пор, пока не задействуются все молекулы фермента. После этого, даже повышение концентрации субстрата не приведет к ускорению реакции.
Температура.
Оптимальная температура для жизнедеятельности ферментов – около 37 градусов, то есть температура тела. При температуре свыше 42 градусов энзимы начинают разрушаться. И кулинарная обработка пищи, и глубокая заморозка приводят к гибели ферментов и потери их жизнедеятельной силы. В консервированных, стерилизованных, пастеризованных и даже замороженных продуктах энзимы частично или полностью разрушены. Но не только мертвая пища, но и слишком холодные и горячие блюда убивают ферменты. Когда мы едим слишком горячую пищу, мы убиваем пищеварительные энзимы и обжигаем пищевод. Желудок сильно увеличивается в размерах, а потом из-за спазмов мышцы, что его держит, становится похожим на петушиный гребешок. В результате пища поступает в 12-ти перстную кишку в необработанном состоянии. Если так происходит постоянно, могут появиться такие проблемы, как дисбактериоз, запоры, расстройство кишечника, язва желудка. От холодных блюд (мороженого, например), желудок тоже страдает – сначала скукоживается, а потом увеличивается в размерах, а ферменты замораживаются. Мороженое начинает бродить, выделяются газы и человек получает вздутие живота.
Обычно повышение температуры ведет к ускорению реакций. Это правило работает для большинства ферментативных реакций, но только до тех пор, пока температура не поднимется выше 40 градусов по Цельсию. После этой отметки скорость реакции, наоборот, начинает резко снижаться. Если температура опустится ниже критической отметки, скорость ферментативных реакций повысится снова. Если температура продолжает расти, ковалентные связи рушатся, а каталическая активность фермента теряется навсегда.
Кислотность.
На скорость ферментативных реакций также влияет показатель рН. Для каждого фермента существует свой оптимальный уровень кислотности, при котором реакция проходит наиболее адекватно. Изменение уровня рН сказывается на активности фермента, а значит, и скорости реакции. Если изменения слишком велики, субстрат теряет способность связываться с активным ядром, а энзим больше не может катализировать реакцию. С восстановлением необходимого уровня рН, активность фермента также восстанавливается.
Каждый фермент имеет определенный оптимум pH. Для каждого фермента характерна определенная область оптимальных значений pH (оптимум pH), при которых он проявляет максимальную активность.
Оптимум pH фермента не обязательно совпадает со значением pH, характерным для нормального внутриклеточного окружения этого фермента; последнее может быть, как выше, так и ниже оптимума pH. Таким образом, каталитическую активность фермента в клетках можно в какой-то мере регулировать, изменяя pH окружающей среды [3] (приложение 2)
3.3. Значение ферментов
Мне стало известно, что ферменты применяются практически во всех областях человеческой деятельности, и такое широкое применение, в первую очередь, связано с тем, что они сохраняют свои уникальные свойства вне живых клеток. Ферменты групп амилаз, протеаз и липаз применяются в медицине. Они расщепляют крахмал, белки и жиры. Все эти ферменты, как правило, входят в состав комбинированных препаратов таких, как «Фестал», «Мезим», «Панзинорм», «Панкреатин», применяемых для лечения несварения желудка. Но некоторые энзимы способны также влиять на кровеносную систему (растворяют тромбы), ускорять заживление гнойных ран. И даже в противораковой терапии также прибегают к помощи ферментов и используются, в первую очередь, для лечения заболеваний желудочно-кишечного тракта. Ферменты применяют для растворения тромбов в кровеносных сосудах, при лечении гнойных ран.
Такие ферменты как амилаза расщепляют крахмал и поэтому широко используются в пищевой промышленности. В пищевой и легкой для изготовления сыров, чая, табака, обработка кожи, виноделии, пивоварении, выпечки хлеба.
Ферменты амилазы используются в хлебопечении, виноделии и пивоварении. Протеазы используются для смягчения мяса и при изготовлении готовых каш. Липазы используются в производстве сыра. Они широко используются в бытовой химии. Например, в стиральные порошки добавляют амилазу, которая расщепляет крахмал, протеазы, расщепляющие белки или белковые загрязнения, и липазы, очищающие ткани от жира и масла. Как правило, в состав стирального порошка входит комбинация этих ферментов, то есть ферментные препараты усиливают действие друг друга. Сегодня наиболее изученными ферментами являются протеазы и амилазы. Липазы не всегда стабильны по качеству. Их разработкой занимаются только 10 лет, а амилаза и протеаза существуют на рынке уже более полувека. Сегодня эти две категории ферментов очень хорошо изучены и дают прекрасные результаты, чего пока что нельзя сказать о липазах. Липазы полностью справляются с загрязнениями только после двух-трех стирок, а протеазы и амилазы – за одну. Ученые подсчитали, что добавление ферментов в стиральные порошки на 30-35% увеличивает моющую способность данного порошка [8].
3.4. Энзимопатология
Энзимопатология – область энзимологии, которая изучает связь между болезнью и недостаточным синтезом, или отсутствием синтеза какого-либо фермента.
Например, причиной наследственного заболевания – фенилкетонурии, которое сопровождается расстройством психической деятельности, является потеря клетками печени способности синтезировать фермент, катализирующий превращение фенилаланина в тирозин.
В результате в организме накапливаются токсические вещества. Новорожденный ребенок выглядит здоровым, а первые симптомы фенилкетонурии проявляются в возрасте от двух до шести месяцев. Это выраженная вялость, отсутствие интереса к окружающему миру, повышенная раздражительность, а также беспокойство и рвота.
Во втором полугодии жизни у ребенка выражено отставание в психическом развитии. Менее чем в 10% случаев – это слабая степень олигофрении, а у 60% развивается идиотия. При своевременной диагностике патологических изменений можно избежать, если с момента рождения до наступления полового созревания ограничить поступление фенилаланина с пищей.
Галактоземия –наследственная патология обмена веществ, обусловленная недостаточностью активности ферментов, принимающих участие в метаболизме галактозы. Неспособность организма утилизировать галактозу приводит к тяжёлым поражениям пищеварительной, зрительной и нервной системы детей в самом раннем возрасте.
Признаками галактоземии являются непереносимость грудного молока и молочных смесей, рвота, анорексия, гипотрофия, желтуха, цирроз печени, отёки, катаракта, задержка психомоторного развития.
Основу терапии галактоземии составляют безлактозная диета, назначаемая с первых дней жизни [4].
РАЗДЕЛ IV. Практическая часть 4.1 Определение фермента уреазы в различных растительных объектах
Опыт 1. Определение ферментов в растительных объектах Цель работы: Определить наличие фермента уреазы в растительных объектах.
Оборудование и реактивы: Фарфоровая ступка и пестик, мерный цилиндр, пробирка; вода дистиллированная, мочевина (1%-й раствор), фенолфталеин (0,1%-й спиртовой раствор), бобы.
Ход работы
1) Разотрите в ступке очищенные от кожуры бобы с 5 мл воды до получения однородной суспензии.
2) Перелейте полученную суспензию в пробирку.
3) В пробирку налейте 5 мл раствора мочевины.
4) Добавьте 2–3 капли спиртового раствора фенолфталеина.
5) Содержимое в пробироке перемешайте и оставьте при комнатной температуре на 15–20 мин.
6) Отметьте происходящие изменения.
Результаты. Занесите результаты эксперимента в таблицу.
Выводы. Розовое окрашивание свидетельствует о том, что прошла реакция гидролиза мочевины, следовательно, в бобах содержится фермент уреаза, который осуществляет разложение мочевины до аммиака и углекислого газа (приложение 3)
H2N–CO–NH2 + H2O = 2NH3 + CO2.
Уреаза сохраняет свою активную функцию только при комнатной температуре, при нагревании белок сворачивается – денатурируется – и реакция не идет, при охлаждении его активность замедляется.
Опыт 2. Доказать присутствие ферментов в животных и растительных клетках и их роль в биохимических реакциях Цель: выявить каталитическую активность ферментов в живых тканях; показать высокую специфичность, а также наивысшую активность натуральных и повреждённых кипячением тканей; сформировать знания о роли ферментов в клетках.
4.2. Обнаружение и роль фермента каталазы в живых организмах
Оборудование и материалы: пероксид водорода, кусочки сырого и вареного картофеля, мяса; штатив с пробирками.
Ход работы:
1. В пробирки положите по маленькому (величиной с горошину) кусочку сырого и вареного картофеля, мяса (приложение 5)
2. В каждую пробирку пипеткой добавьте по 8-10 капель раствора пероксида водорода..
3. Наблюдения запишите в таблицу (приложение 4).
Вывод. В этом опыте мы наблюдали действие фермента каталаза. Каталаза катализирует реакцию расщепления перекиси пероксида с образованием молекулярного кислорода и воды.
2H2 O2=2H2O+O2
Соединение пероксида водорода образуется в некоторых растительных и животных клетках в качестве побочного продукта обмена веществ. Соединение — это токсично для клеток, так как обладает высокой окислительной способностью. Каталаза обеспечивает эффективное удаление пероксида, что мы и наблюдали в процессе опыта. Локализуется каталаза в особых органоидах клетки пероксисомах и микротельцах.
4.3. Обнаружение и действие фермента слюны амилазы на крахмал
1.Налейте в посуду стакан холодной воды и разведите в ней пол-ложки крахмала.
2. На небольшом огне доведите жидкость до кипения и варите еще 5-10 мин, постоянно помешивая, до образования однородной клейкой массы.
3. Смочите в крахмальном клейстере бинт и дайте ему просохнуть.
Приготовьте реактив на крахмал — йодную воду (налейте в блюдце немного воды и добавьте несколько капель йода, чтобы получилась жидкость цвета крепко заваренного чая).
4. Исследуйте ферменты своей слюны. Намотайте на спичку вату, смочите ее слюной, а затем на накрахмаленном бинте слюной напишите букву или сделайте рисунок. Расправленный бинт зажмите в руках и подержите его некоторое время (1-2 мин), чтобы он нагрелся.
5. Опустите бинт в йодную воду, тщательно расправив его. Участки, где остался крахмал, окрасятся в синий цвет, а места, обработанные слюной, останутся белыми, так как крахмал в них распался до глюкозы, которая с йодом синего окрашивания не дает. Если все сделано верно, на синем фоне появится белая буква или рисунок. (приложение 5)
Вывод: В этом опыте мы наблюдали действие фермента слюны амилазы на углеводы, содержащиеся в пище. В состав углеводов пищи входит крахмал, который под действием амилазы расщепляется до глюкозы [1] (приложение 6)
Влияние pH среды на активность фермента амилазы.
Цель: выяснить влияние pH среды на каталитическую активность ферментов.
Цель опыта: изучение влияния факторов кислотности и щелочности на активность ферментов слюны – амилаз
Оборудование и реактивы: пипетка; пробирки-3шт., раствор слюны, раствор крахмала, раствор соляной кислоты (1:10), раствор гидроксида натрия , раствор йода, чистая вода, рН-индикаторная бумага.
Методика приготовления разбавленной слюны:
рот ополаскивают 2-3 раза водой для удаления остатков пищи. Отмеряют цилиндром 50 мл дистиллированной воды и ополаскиваю ею рот в течение 3-5 мин. в несколько приёмов. Собранную жидкость фильтрую через вату, и фильтрат использую для работы.
Ход работы:
В пробирку № 1(контрольная) – 1 мл воды.
В пробирку № 2 вносим 1мл раствора кислоты HCl.
В пробирку № 3 - 1мл раствора NaOH.
Далее в пробирки добавляем 5 мл 5% раствора крахмала, 1 мл слюны, 1-2 капли раствора йода. Оставляем пробирки на 20 минут для протекания биохимической реакции гидролиза крахмала. При помощи индикаторной бумаги определяем рН растворов ( приложение 7)
Вывод: в ответ на воздействие повышенной кислотности как химического фактора происходит снижение активности амилаз. pH-оптимум ферментов слюны человека составляет 6,8-7,0.
Влияние курения на работу фермента амилазы.
При курении воздействие на организм человека составляющих компонентов табачного дыма может происходить непосредственно на слизистую оболочку полости рта, носа и бронхов. Итак, слизистая оболочка рта в силу своих анатомо-топографических особенностей первая подвергается воздействию курения. Курение считается вредной привычкой в силу воздействия на организм нескольких факторов. Одним из них является попадание в организм содержащегося в растениях табака (а, следовательно, и в сигаретах) никотина. Для организма человека никотин является вредным воздействующим химическим фактором. Мною было изучено влияние курения на организм через изменения свойств слюны курильщика.
Оборудование и реактивы: пипетки -2 шт., пробирки-2 шт., раствор слюны (собственной и курильщика), раствор крахмала, чистая вода, раствор йода.
Ход работы:
В пробирку № 1 вносим раствор слюны собственной.
В пробирку № 2 вносим раствор слюны курильщика (взятие слюны курильщика для пробы изучается сразу после выкуренной сигареты)
Далее в пробирки добавляем 5 мл 5% раствора крахмала, 1-2 капли раствора йода. Оставляем пробирки на 10 минут в стакане с теплой водой и наблюдаем за изменением интенсивности синего окрашивания растворов (приложение 8)
Вывод: в пробирке со слюной курильщика обесцвечивание раствора происходит медленно, окраска раствора долгое время остается темно – фиолетовой, почти черной. В пробирке с собственной слюной окраска раствора исчезает быстро. Никотин и другие токсичные компоненты табачного дыма вызывают снижение активности содержащихся в слюне ферментов амилаз к гидролитическому расщеплению крахмала. Поскольку процесс пищеварения начинается в ротовой полости с расщеплением сложных углеводов, совершенно очевидно, что он нарушается уже на первоначальном этапе.
Заключение
Без ферментов все реакции в живых организмах протекали бы очень медленно или не протекали бы совсем. Без ферментов невозможно ни пищеварение, ни дыхание. Без них ни единого раза не сократится сердце, не будут работать мыслительные процессы в головном мозге. Ферменты уменьшают воспалительные процессы, улучшают иммунную систему, а также участвуют в синтезе ДНК и внутриклеточном пищеварении. Мы состоим из клеток, в каждой из которых 24 часа в сутки кипит жизнь благодаря ферментам. Поэтому можно уверенно сказать, что управление жизнью — это ферментативная реакция.
Анализируя проделанные опыты было установлено, что ферменты обладают рядом свойств, отличающих их от неорганических катализаторов:
-каждый фермент обладает специфичностью и действует на определенный субстрат;
-каждый фермент действует только при определенных условиях (температура, pH среда)
-при кипячении ферменты, как и другие белки, свертываются и теряют свою активность
Результаты исследования при проведении опытов подтверждают нашу гипотезу о том, что без ферментов нет жизни.
Данная работа имеет большое практическое значение для формирования здорового образа жизни и может быть использована для выступления на классных часах и других внеклассных мероприятиях.
Работая над проектом я узнала, что неправильное питание, вредные привычки, использование лекарств, таких как антибиотики приводят в к серьёзным проблемам в организме, а именно к нарушению работы ферментов.
Составила рекомендации по поддержанию баланса ферментов в организме.
Список используемых источников и литературы
1. Гусева К.Е., Проскурина И.К. Разработка химического эксперимента с экологическим содержанием. Химия в школе, 2002, № 10;
2. Кульберг Л.М. Синтезы органических реактивов для неорганического анализа. М.: ГОНТИ, 1987;
3. Ленинджер А. Основы биохимии: В 3-х томах. Том 1. с. 234--287— Москва: Мир, 1985.
4. Реннеберг Р. Эликсиры жизни (новейшие результаты в области исследования ферментов) М.: «Мир»,1987.
5. Шеховцева Т.Н. Ферменты: их использование в химическом анализе. Соросовский образовательный журнал, 2000, т. 6, № 1, с. 44–48.
6. https://ru.wikipedia.
7. http://www.fptl.ru/biblioteka/biohimija.htmlе.
8. https://www.lifetechnologies.com/ru/ru/home/brands/thermo-scientific.html.
Приложение 1
Анкета « Правильное питание-залог здоровья?»
С целью выяснения содержания в рационе свежих овощей и фруктов богатых ферментами, микроэлементами, витаминами был задан вопрос: «Какие блюда и отдельные продукты вы предпочитаете?»
В анкетировании приняли участие 62 человека: учащиеся и родители.
Результат оказался следующим:
45% готовят и едят традиционные блюда- супы, жареный картофель, пюре, котлеты, колбасы, макароны, пиццы, гамбургеры, каши);
35% - придерживаются здорового образа жизни ( включают в свой рацион овощи, фрукты, зелень, ягоды);
20% - любят экзотические блюда (острые, пряные, копченые).
Интервью, взятое у работника аптечного пункта, показало, что ферментные препараты являются востребованными у населения. Препараты: мезим, панзинорм, энзистал, фестал, пензитал приобретаются часто и в основном без рецепта.
Следовательно, люди применяют заместительную терапию при желудочно-кишечных заболеваниях.
Приложение 2 «Область оптимальных значений pH ферментов»
| Фермент | Оптимум pH |
| Пепсин | 1,5 |
| Трипсин | 7,7 |
| Каталаза | 7,6 |
| Аргиназа | 9,7 |
| Фумараза | 7,8 |
| Рибонуклеаза | 7,8 |
| Амилаза | 6,8-7 |
Приложение 3
«Определение фермента уреазы в растительных объектах»
| Растительные объекты | Бобы |
| Наличие уреазы | Интенсивное розовое окрашивание |
Приложение 4
«Обнаружение и роль фермента каталазы в живых организмах»
| Объект | Наблюдаемое явление |
| Сырой картофель + H2O2 | Выделяются пузырьки |
| Вареный картофель +H2O2 | Пузырьки не выделяются |
| Сырое мясо +H2O2 | Выделяются пузырьки |
| Вареное мясо +H2O2 | Пузырьки не выделяются |
Приложение 5
«Обнаружение и роль фермента каталазы в живых организмах»

Приложение 6
«Обнаружение и действие фермента слюны амилазы на крахмал»
Приложение 7
Влияние кислотности среды на активность ферментов слюны
Во всех 3 пробирках - раствор слюны
| № пробирки | Реактивы
| Значение рН через 20 минут | Реакция раствора после добавления иода | Результаты |
| 1 контрольная | Вода 2мл+крахмал | рН=7 | отсутствует стойкое фиолетовое окрашивание | Амилаза, содержащаяся в слюне ускорила гидролиз крахмала |
| 2 | HCL 2мл+крахмал | рН=2,5 | фиолетовое окрашивание не исчезает | В ответ на повышение кислотности происходит снижение активности амилаз |
| 3 | NaOH 2мл+крахмал
| рН= 9 | фиолетовое окрашивание не исчезает | Сильно щелочная реакция приводит к уменьшению активности амилаз |
Приложение 8
Влияние курения на свойства слюны
| № пробирки | Реактивы | Реакция раствора после добавления иода | Результаты через 10 минут |
| 1. раствор слюны некурящего человека | Крахмал+2-3 капли йода | Сине-фиолетовое окрашивание | Синее окрашивание исчезает, амилаза слюны расщепляет крахмал |
| 2. раствор слюны курильщика | Крахмал+2-3 капли йода | Сине-фиолетовое окрашивание | Синее окрашивание долго не исчезает, гидролиз крахмала затруднен |
Приложение 9
Рекомендации по поддержанию баланса ферментов в организме.
Обязательно употреблять в пищу растительные продукты с огорода, сада, океана: овощи, фрукты, ягоды, зелень, морскую капусту;
Много ферментов содержится в бананах, манго, папайи, ананасах, авокадо;
Желательно, чтобы ежедневно один прием пищи включал только сырые фрукты, ягоды и овощи.
Приём пищи нужно начинать с овощного салата с зеленью (1 раз в день).
Несколько раз в месяц полезно устраивать разгрузочные дни на фруктах или свежеотжатых соках.
Употреблять в пищу ферментированные продукты: квашенная капуста, квашенный редис, солёные огурцы, квашенный сладкий картофель батат и йогурт.
Однако не стоит злоупотреблять сырыми овощами в больших количествах, так как они могут содержать множество растительных токсинов, в том числе ингибиторы ферментов, кроме того некоторые сырые овощи плохо перевариваются (картофель, морковь, капуста, бобовые).
Злоупотребление бобовыми продуктами опасно развитием метеоризма и газообразования, а также образованием камней в почках и желчном пузыре.





















