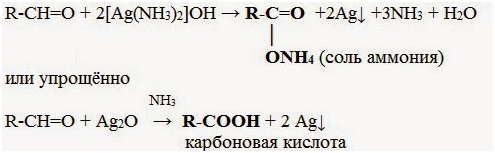Проект
Тема: Комплексные соединения и их применение в медицине
Манина Полина Константиновна
Ученица 11в класса
Кировского областного государственного
общеобразовательного автономного учреждения
«Лицей естественных наук»
Руководитель проекта:
Нурулина Юлия Владимировна,
учитель химии
Кировского областного государственного
общеобразовательного автономного учреждения
«Лицей естественных наук»
Оглавление
Введение 3
Глава 1. Обзор литературы 4
Глава2. Методы и материалы ……………………………………………………………………………...7
2.1 Анализ основных направлений применения комплексных соединений……………………..............................................................................................7
2.2 Анализ применения комплексных соединений в медицине 7
2.3 Редактирование материалов-памятки «Комплексные соединения»………………...7
Глава 3. Результаты подготовки материалов по теме «Комплексные соединения» 8
3.1 Результат анализа основных направлений применения комплексных соединений……………………………………………………………………………………..8
3.2 Результат анализа применения комплексных соединений в медицине 8
3.3 Результат редактирования материалов-памятки «Комплексные соединения» .8
Выводы..........................................................................................................................................9
Библиографический список……………………………………………………………………10
Приложение 1..............................................................................................................................11
Приложение 2…………………………………………………………………………………..16
Приложение 3…………………………………………………………………………………..18
Приложение 4…………………………………………………………………………………..20
Введение
Актуальной проблемой современной химии и медицины является создание лекарственных препаратов, обладающих улучшенными фармакологическими свойствами. Одним из важнейших способов решения этой проблемы является синтез лекарственных препаратов, на основе координационных (комплексных) химических соединений. Изучение процессов взаимодействия «металл–лиганд», являющееся особенностями строения комплексных соединений - вот ключ к поиску новых лекарственных средств. «Металлы жизни» образуют комплексные соединения с протеинами, ферментами и витаминами, что позволяет образовавшимся веществам выполнять важные функции в организме человека и животных [1]. Следует вспомнить о широчайшем распространении комплексных соединений в окружающем нас мире. К примеру, всем известный зеленый пигмент растений – хлорофилл является координационным соединением магния. Комплексные соединения используются повсеместно – от в лаборатории аналитической химии до кабинета врача неотложной помощи [2], [3]. К сожалению, в учебной школьной литературе по общей и неорганической химии разных авторов вопросу «Комплексные соединения» уделено мало внимания, а в учебной программе мало времени на изучение этих жизненно важных и необходимых веществ. Предлагаемый материал проектной работы можно использовать в качестве дополнительного источника информации для расширения кругозора учащихся о мире веществ и химических процессов. Разработанный комплекс материалов – памятки можно использовать для подготовки учащихся к государственной итоговой аттестации по химии. Изучение темы надо осуществлять с помощью учебной литературы, а для быстрого повторения и актуализации знаний по данному вопросу, в период «накануне экзамена», можно воспользоваться разработанным материалами - памятками. Подготовленный комплекс материалов может использовать не только учащийся лицея, но все желающие, испытывающие такую необходимость и планирующие сдавать ЕГЭ по химии.
Цель исследования заключается в выявлении роли комплексных соединений в современной медицинской практике.
Объектом исследования являются координационные соединения.
Предметом исследования являются особенности строения комплексных соединений, позволяющие им проявлять биологическую активность и играть важную роль в медицине.
Задачи исследования:
1. Обзор литературы.
2. Определить основные направления применения комплексных соединений в жизни современного человека.
3. Определить в каких областях медицины используют комплексные соединения.
4. Подготовить материалы по теме «Комплексные соединения».
Новизна проекта: в лицее никто не составлял памятки по этой теме для учащихся, готовящихся к ГИА; научная информация и содержание КИМов по химии постоянно обновляется, наполняется новыми фактами, поэтому обучающиеся при подготовке должны пользоваться современными данными.
Глава 1. Обзор литературы
Одним из основоположников теории строения комплексных соединений является лауреат Нобелевской премии по химии (1913) швейцарский химик Альфред Вернер (1866 – 1919). А. Вернер, являясь профессором Цюрихского университета в 1893 году изложил координационную теорию, объясняющую свойства и строение комплексных соединений, синтезировал большое количество новых комплексных соединений, а также провел работу по систематизации известных и собственноручно синтезированных координационных соединений и предложил экспериментальные методы, позволяющие доказать структуру соединений [2].
Значение комплексных соединений в природе. Ферменты, белки и витаминоподобные вещества координируются как лиганды вокруг биогенных металлов и выполняют свои необычайно важные функции [2]. Природные комплексные соединения с макроциклическими хелатообразующими лигандами играют важную роль в процессах жизнедеятельности. Строение гемоглобина представлено на рисунке 1.
Цитохромы - это крохотные глобулярные белки. В них гем ковалентно связан с ионом металла в кармане, образованном аминокислотными остатками. Цитохромы катализируют протекающие в клетках окислительно-восстановительные процессы. Строение цитохромов представлено на рисунке 2.
Витамин В12 имеет самую сложную по сравнению с другими витаминами структуру, основой которой является корриновое кольцо, а в качестве комплексообразователя выступает катион кобальта. Дефицит витамина B12 является причиной некоторых видов анемий. Животные и растения не способны синтезировать витамин В12. Он синтезируется только микроорганизмами: бактериями, актиномицетами. Структура витамина представлена на рисунке 3.
Хлорофилл представляет собой комплексное соединение магния с порфиринами. Это зелёный пигмент, обусловливающий окраску хлоропластов растений в зелёный цвет. При его участии осуществляется процесс фотосинтеза. Строение хлорофилла можно увидеть на рисунке 4.
Свое важное место в природе занимают макрокомплексы (ионофоры) на основе циклических полипептидов. В их внутренних полостях имеются функциональные группировки, содержащие электронодонорные атомы кислорода и способные связывать катионы металлов в соответствии с размером полости. Связывание происходит за счет донорно-акцепторного взаимодействия (т.е. с образованием комплексных соединений) даже с такими катионами, как Na+ и К+. Ионофоры обеспечивают транспорт ионов через биологические мембраны. Строение представлено на рисунке 5.
Области применения комплексных соединений. Комплексообразование нашло широкое применение в аналитической химии. Для эффективного разделения смеси ионов используют особенности комплексообразования, для количественного определения содержания ионов металлов в водных растворах применяют метод комплексонометрии (или трилонометрии). Трилонометрия широко используется в санитарно-клиническом анализе для количественного определения ионов металлов (содержания кальция, цинка, магния, железа в фармацевтических препаратах). Можно использовать этот метод анализа для определения жесткости воды или содержания ионов металлов в биологических жидкостях (сыворотке крови и моче), костях и хрящах. Этилендиаминтетрауксусная кислота (EDTA) образует устойчивые комплексы практически со всеми катионами металлов, кроме щелочных, используется как детоксикант для выведения из организма радиоактивных и токсичных тяжелых металлов, для консервации крови, а также как антидот при отравлении синильной кислотой, являющейся источником лигандов CN-, которые замещаются полидентатным лигандом с образованием более стабильного комплексного соединения [2]. На рисунке 6 представлена схема образования комплексного соединения тяжелых металлов с Трилоном Б.
Применение комплексных соединений в медицинской практике. В организме постоянно происходит образование и разрушение жизненно важных биокомплексов [4]. Нарушения в метаболизме могут вызываться поступлением катионов металлов-токсикантов или лигандов-токсикантов. Попадание в организм металлов-токсикантов и лигандов-токсикантов приводит к нарушению металло-лигандного гомеостаза, т.к. комплексы данных участников процессов комплексообразования прочнее жизненно-важных комплексов, образованных биометаллами и биолигандами.
Хелатотерапия – это процесс детоксикации организма от металлов – токсикантов при помощи лиганд-препаратов на основе полидентатных лигандов, образующих с маталлами-токсикантами прочные комплексные соединения, хорошо растворимые в воде.
Эффективными препаратами для хелатотерапии являются EDTA, кальцийдинатриевая соль EDTA, унитиол (2,3-димеркаптопропансульфонат натрия), сукцимер (2,3-димеркаптоянтарная кислота), пеннициламин (2-амино-3-меркапто-3-метилмасляная кислота), тиосульфат натрия Na2S2O3. Практическое использование средств для хелатотерапии оказалось особенно результативным при профессиональных хронических интоксикациях соединениями свинца, ртути и радиоактивных элементов [5].
Различные биокатионы, присутствующие в плазме крови в микроколичествах, могут выступать в качестве катализаторов неблагоприятных для здоровья свободнорадикальных процессов с участием активных форм кислорода и тем самым активизировать нежелательные процессы перекисного окисления липидов. Этилендиаминтетрауксусная кислота и ее соли, в частности Na2Caedta, применяются также как антидот при отравлениях свинцом [6]. Этилендиаминтетрауксусная кислота – важнейший биолиганд, обладающий способностью брать на себя функции биокатализатора, подвергаться метаболизму, имитировать функции некоторых ферментов [7].
Известным цитотоксическим препаратом является цисплатин (цис-диамминдихлороплатина(II). Препарат нарушает функции ДНК за счет химических модификаций азотистых оснований путём образования координационных связей между атомом платины и двумя гуаниновыми основаниями ДНК (рисунок 7). В таблице 1 перечислены области применения комплексных соединений металлов в медицине.
Жизненно важное значение в настоящее время приобретает поиск и синтез противоопухолевых лекарственных препаратов. Клинические испытания проходят комплексные соединения редкоземельных элементов: гадолиния, самария, лантана.
Мишенью металлсодержащих противоопухолевых лекарственных препаратов является молекула ДНК. Гибель клеток происходит в результате блокировки ее деления при взаимодействии с молекулой лекарственного средства. Таким образом, поиск потенциальных противоопухолевых средств среди комплексных соединений редкоземельных элементов является перспективным направлением в экспериментальной химиотерапии раковых опухолей [8].
Глава 2. Методы и материалы
2.1 Анализ основных направлений применения комплексных соединений
Был проведен всесторонний разбор и качественное рассмотрение и изучение темы «Комплексные соединения и их роль в жизни современного человека, в частности в медицине», по итогам которого сформировано представление о составе и свойствах комплексных соединений, позволяющих им играть важную роль в повседневной жизни. Изучив печатные учебные источники, можно составить таблицу по общему применению комплексных соединений в жизни современного человека. Она представлена в Приложении 2.
Анализ применения комплексных соединений в медицине
Изучив печатные учебные источники, аннотации к разнообразным медицинским препаратам, можно выявить особенности строения, свойства комплексных соединений, позволяющие играть им важную роль медицинской практике, например, при лечении различных заболеваний. По результатам произведенного анализа планируется составить таблицу по применению комплексных соединений в медицине; а также таблицу лекарственных препаратов, действующие вещества которых – комплексные соединения. Таблицы представлены в Приложении 1 и Приложении 3.
2.3. Редактирование материалов-памятки «Комплексные соединения»
На основе анализа литературы и аннотаций к медицинским лекарственным препаратам составить памятки по строению, свойствам и способам получения комплексных соединений, которые будут полезны для расширения кругозора учащихся, а также для всех желающих, сдающих экзамен по химии. Теоретические вопросы общей и неорганической химии неразрывно связаны в той или иной степени с получением, с применением, строением комплексных соединений. Для качественной подготовки к государственной итоговой аттестации по химии за курс среднего общего образования необходимо уделить внимание теме «Комплексные соединения», особенно при проработке вопросов первой части КИМа: № 4 («Строение веществ. Химическая связь»); № 5 («Классификация веществ»), № 7, 8, 9, 10 («Характерные химические свойства неорганических веществ. Взаимосвязь неорганических соединений»), № 15 («Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот»), № 25 («Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений»), и второй части КИМа по химии: № 32 («Реакции, подтверждающие взаимосвязь различных классов неорганических веществ»), № 34 («Расчёты массовой доли (массы) химического соединения в смеси»)
Таблицы представлены в Приложении 4.Глава 3. Результаты подготовки материалов по теме «Комплексные соединения»
Результат анализа основных направлений применения комплексных
соединений
Были рассмотрены и изучены основные области применения комплексных соединений в жизни современного человека. Была составлена таблица по общему применению комплексов. Она представлена в Приложении 2.
3.2. Результат анализа применения комплексных соединений в медицине
Были рассмотрены и изучены основные области применения комплексных соединений в медицинской практике. Были составлена таблицы по применению координационных соединений в медицине. В таблице 1 в Приложении 1 содержится информация о составе лекарственных препаратов (какие именно комплексные соединения входят) и их назначениях. Также в Приложении 3 вынесена таблица, в которой написаны основные области применения комплексных соединений в медицине и какую роль они играют (детоксиканты, противоопухолевые средства и т.д.)
Результат редактирования материалов-памятки «Комплексные соединения»
Составлены памятки, которые могут быть использованы учащимися для подготовки к ЕГЭ по химии. Она представлена в Приложении 4.
Выводы
В результате анализа литературы по теме проекта было изучено строение комплексных соединений согласно координационной теории А. Вернера, а также их свойства. Выявлена важная роль комплексных соединений в природе и в жизнедеятельности живых организмов. Рассмотрены комплексные соединения, применяемые в качестве лекарственных препаратов для различных медицинских назначений.
В соответствии с целью и задачами исследования были получены следующие основные результаты:
1) Изучена история открытия комплексных соединений.
2) Выявлены особенности строения и следующие из них свойства комплексных соединений, позволяющие им играть важную роль в природе и медицине.
3) Составлена памятка «Комплексные соединения», которая может быть использована для подготовки к экзамену по химии.
Библиографический список
1. Слесарев, В.И. Химия: основы химии живого: учебник для вузов. – 4-е изд., испр. – СПб: Химиздат, 2007. – 784 с.
2. Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. Биографический справочник. — М.: Высшая школа, 1991. — 656 с.
3. Глинка Н.Л. . Общая химия. пособие для вузов/Под ред. А. И. Ермакова, изд. 29-е, испр. - М.: Интеграл-Пресс, 2002. - 728 с.
4. Попков В.А., Пузаков С.А. Общая химия: учебник. – М.: ГЭОТАР-Медиа, 2010. – 976 с.
5. Архипова, О.Г. Комплексоны в клинике профессиональных болезней / О.Г. Архипова, Л.А. Зорина, Н.С. Сорокина. – М.: Медицина, 1975. – 62 с.
6. Advan, J. A Textbook on EDTA Chelation Therapy / J. Advan // Med. - 1989. - Vol. 2, № 1. - P. 17 – 54.
7. Дятлова, Н.М. Комплексоны и комплексонаты металлов / Н.М. Дятлова, В.Я. Темкина, К.И. Попов. – М.: Химия, 1988. – 544 с.
8. Рукк, Н.С. Перспективность создания противоопухолевых лекарств на основе координационных соединений элементов IIIB группы / Н.С. Рукк, Г.Н. Апрышко, А.Ю. Скрябина // Российский биотерапевтический журнал. - №2. – 2014. – С. 47-50.
Приложение 1
Рисунок 1. Строение гемоглобина
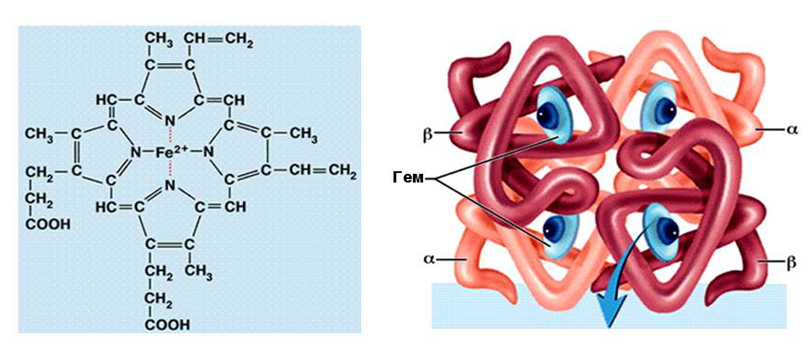
Рисунок 2. Строение цитохромов
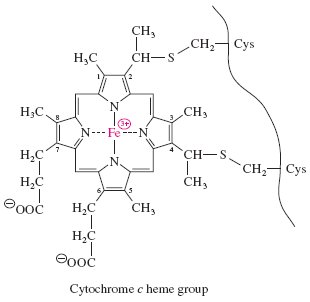
Рисунок 3. Строение витамина В12
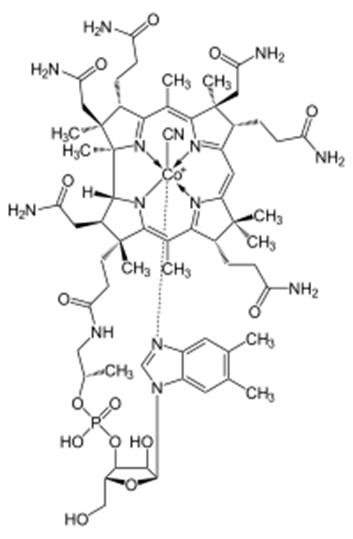
Рисунок 4. Строение хлорофилла
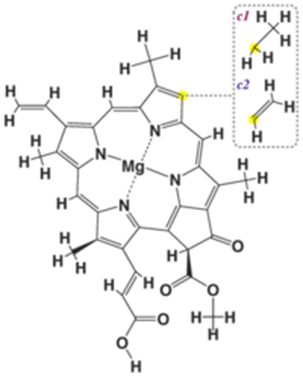
Рисунок 5. Строение ионофора
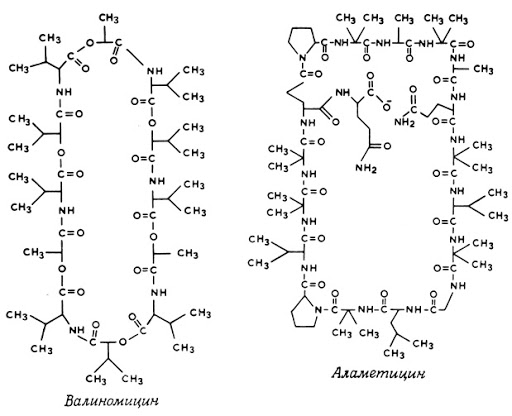
Рисунок 6. Схема образования комплексного соединения тяжелого металла с Трилоном Б
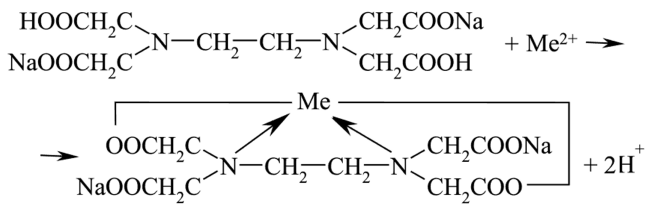
Рисунок 7. Образование координационных связей между атомом платины и двумя гуаниновыми основаниями ДНК
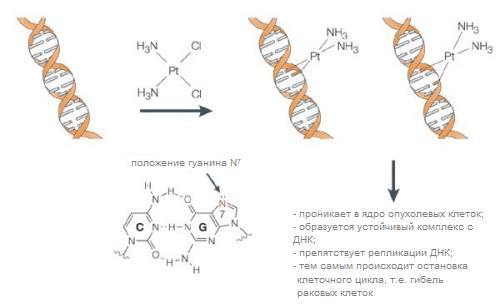
Таблица 1. Применение комплексных соединений металлов в медицине [3].
| Металл-комплексообразователь | Лекарственное средство | Применение |
| Висмут | Висмута субгаллат (входит в состав препаратов, как Анестезол, Проктозан и т.д.) 
Висмута субсалицилат (входит в состав препаратов, как Де-Нол) 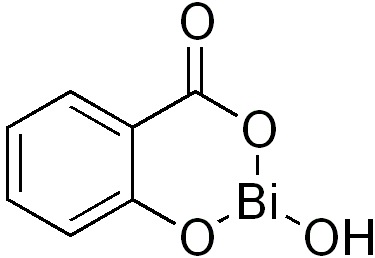
| Гастропротективное средство |
| Гадолиний | Магневист | Рентгеноконтрастное вещество |
| Железо | Ферроцерон | Средство для лечения анемии |
| Золото | Ауранофин | При ревматоидном артрите |
| Кобальт | Витамин В12
| При анемиях и других заболеваниях |
| Платина | Цисплатин Карбоплатин | Противоопухолевые препараты |
| Серебро | Сульфатиазол серебра | Противомикробное средство |
| Цинк | Аспартат цинка 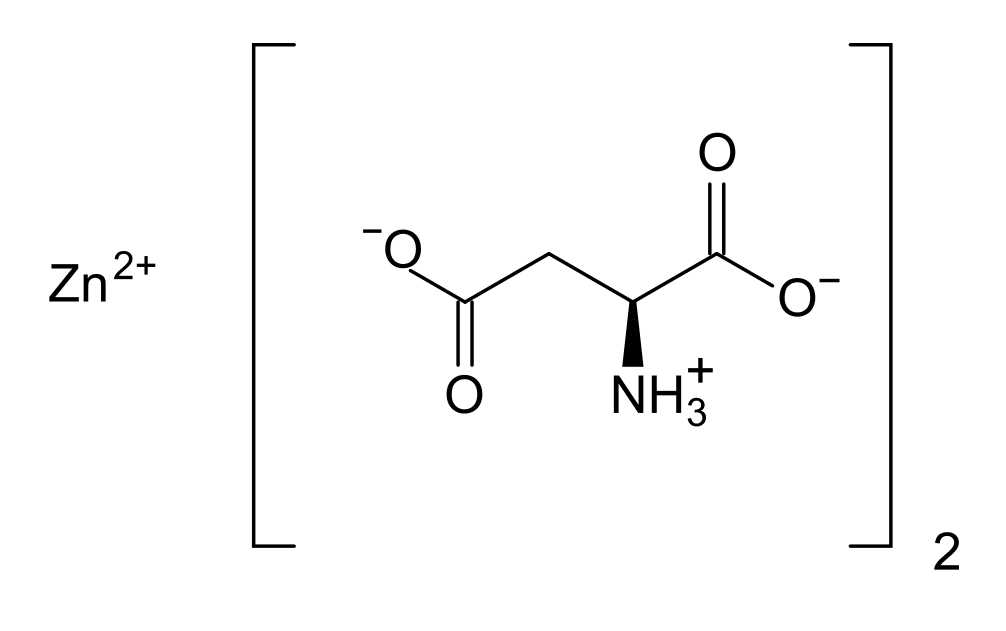
| При лечении дефицита цинка |
Приложение 2 Применение комплексных соединений
| Название | Применение |
| Оксигемоглобин, хлорофилл витамин В12, цитохромы | Вещества, обеспечивающие жизнедеятельность живых организмов |
| Аналитическая химия |
| Трилон Б (динатриевая соль EDTA) | Комплексонометрический метод (трилонометрия), широко используется в санитарно-клиническом анализе для количественного определения ионов металлов |
| Гексацианоферрат(III) калия K3[Fe(CN)6] | Реагент для обнаружения Fe2+, Sn2+ в почвоведении |
| Бис(диметилглиоксимат) никеля(II) | Пигмент; продукт реакции реактива Чугаева (диметилглиоксима) на ионы никеля 2+ с среде аммиака |
| Дигидрат тетраиодомеркурата (II) калия K2[HgI4]•2H2O | Реактива Несслера, качественное обнаружение аммиака |
| Металлургия |
| Криолит Na3[AlF6] | Электролитическое получение алюминия |
| Железо-салицилатный комплекс | При получении салицилатных электролитов, в химии и технологии присадок |
| Тетракарбонилникель [Ni(CO)4] | Никелевые покрытия неметаллических поверхностей, для получения никеля высокой чистоты, в качестве катализатора |
| Дицианоаурат (I) натрия Na[Au(CN)2]
| Цианидное выщелачивание золота, с его растворением в слабых цианистых растворах |
| Гидроксид гексабензоатожелеза (III) [Fe(C6H5COOH)6] (OH)3 | Комплексные соединения применяют при борьбе с коррозией (для получения на поверхности железа защитной плёнки) |
| Сельское хозяйство |
| «Секвестрен» Турбо | Азотное железосодержащее минеральное удобрение для коррекции и эффективного устранения признаков дефицита железа у растений |
| Моногидрат cульфата пентааквамеди (II) [Cu(H2O)4]SO4∙H2O | Микроудобрения, медные |
| Химическая технология |
| | Катализаторы виниловой полимеризации процессов гидрирования |
Приложение 3 Применение комплексных соединений в медицине.
| Название | Применение |
| Детоксиканты |
|
Этилендиаминтетрауксусная кислота (EDTA) | Хелатотерапия, биокатализатор. Используется как детоксикант для выведения из организма радиоактивных и токсичных тяжелых металлов, для консервации крови, а также как антидот при отравлении синильной кислотой |
| Димеркаптоянтарная кислота (сукцимер) | Хелатотерапия, пероральное средство для лечения тяжелых отравлений свинцом у детей, антидот |
| Гидроксокобаламин, B12а | Лечение отравления цианидом калия, ацетонитрилом, припионитрилом |
| Дитиолпропансульфонат натрия | Дезинтоксикационное лекарственное средство, при отравлениях соединениями мышьяка и солями тяжелых металлов |
| Лечение дефицита химических элементов |
| Глицин-цинк хелат гидрат (Е6), краткое: глицинат цинка | Лечение дефицита цинка |
| Глюконат железа | Лечение дефицита железа |
| Аналитические препараты |
|
Трилон Б (динатриевая соль EDTA) | Трилонометрия, которая широко используется в санитарно-клиническом анализе для количественного определения ионов металлов |
| Противоопухолевые лекарственные средства |
| Цисплатин (цис-диамминдихлороплатина (II) | Цитотоксический препарат. Препарат нарушает функции ДНК за счет химических модификаций азотистых оснований |
| Комплекс тиоцианата трис (1,10-фенантролин) лантана (III) | Показывает выраженный цитотоксический и антипролиферативный эффект на клетках различных видов опухолей |
Приложение 4 Памятка по теме «Комплексные соединения»
Таблица 1. Основные понятия
| Понятие | Определение |
| Комплексные соединения (КС) | Соединения, в состав которых входят сложные ионы, состоящие из центральных атомов и лигандов, которые способны самостоятельно существовать как в кристаллах, так и в растворе |
| Комплексообразователь (центральный атом) | атом или ион, являющийся принимающий пары электронов, давая пустые атомные орбитали и занимающий центральное положение в комплексном соединении. |
| Лиганды | молекулы или ионы (анионы), предоставляющие комплексообразователю на его вакантные орбитали свои электронные пары |
| Внутренняя сфера | Ковалентно связанные комплексообразователь и лиганды. |
| Внешняя сфера | Ионы (+ или -), которые нейтрализуют заряд комплексного иона и образующие с ним связь ионного типа. |
| Координационное число (к.ч.)
| число свободных атомных орбиталей, предоставляемых комплексообразователем. |
| Дентантность | количество образуемых донорно-акцепторных связей |
| Хелаты | устойчивые комплексы металлов с полидентатными лигандами, в которых центральный атом является компонентом циклической структуры. |
| Комплексонометрия | метод количественного анализа, основанный на реакции комплексообразования с получением прочных хелатных соединений металлов с комплексонами. |
| Хелатотерапия | Удаление ионов-токсикантов из организма под действием хелатирующих реагентов. |
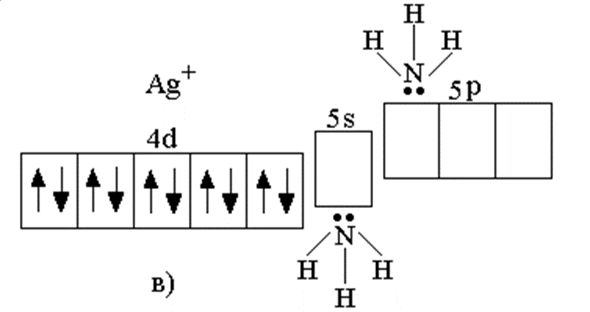
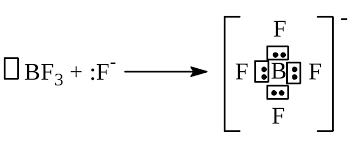
Таблица 2. Схемы образования донорно-акцепторной связи в комплексном соединении
Таблица 3. Расчет заряда внутренней сферы комплексного соединения
| Внутренняя сфера | Пример | Расчет заряда
|
| Катион (заряжена «+») | [Cu2+(NH3)4]z | z = +2 + 4·0 = 2+ [Cu(NH3)4]2+ |
| Анион (заряжена «-») | [Fe3+(CN)6]z | z = +3 + 6·(-1) = 3- [Fe(CN)6]3- |
| Электронейтральна (заряд «0») | [Fe0(CО)50]z | z = 0 + 5·(0) = 0 [Fe(CО)5]0 |
Таблица 4. Классификация комплексных соединений
| Катионный комплекс | Анионный комплекс | Нейтральный комплекс
|
| [Cu(NH3)4]SO4 | Са2[Fe(CN)6] | [Pt(NH3)2Cl2]
|
Таблица 5. Номенклатура комплексных соединений
При составлении названий комплексных соединений указывается сначала название аниона, а затем — название катиона в родительном падеже.
| Формула катионного комплекса | Название |
| [Ag(NН3)2]Br | Бромид диамминсеребра (I) |
| [Zn(H2O)4](NO3)2 | нитрат тетрааквацинка |
| Формула анионного комплекса | Название |
| Na3[Fe(CN)6] | Гексацианоферрат(III) натрия |
| Na2[ZnCl4] | Тетрахлороцинкат натрия |
| Формула нейтрального комплекса | Название |
| [Fe(H2O)3Сl3] | Трихлоротриакважелезо |
| [Pt(NH3)2Br2] | Дибромодиамминплатина |
Таблица 6. Химические свойства комплексных соединений
| Химическое свойство | Уравнение реакции |
| Диссоциация | а) первичная [Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl- б) вторичная [Ag(NH3)2]+ ⇆ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ ⇆ Ag+ + NH3 |
| Образование менее лабильного комплексного соединения | K4[Co(CNS)6]+FeCl3 = K3[Fe(CNS)6] + KCl + CoCl2 Pt[(NH3)4Cl2] + 4KCN = K2[Pt(CN)4]+ 4NH3 + 2KCl |
| Разрушение гидроксокомплексов в кислой среде | Na2[Zn(OH)4] + 4HCl = 2NaCl + ZnCl2 + 4H2O Na2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2NaHCO3 K[Al(OH)4] + H2S = Al(OH)3 + KHS + H2O |
| Реакции обмена | [Cu(NH3)4]SO4+BaCl2 = BaSO4 + [Cu(NH3)4]Cl2 3Na[Al(OH)4] +AlCl3 = 4Al(OH)3 + 3NaCl |
| Разрушение координационного соединения с образованием осадка | [Ag(NH3)2]Cl + KI = AgI + KCl + 2NH3 [Ni(NH3)2]SO4 + (NH4)2S = NiS + 4NH3+ (NH4)2SO4 |
| Разрушение комплексного соединения в результате протекания окислительно-восстановительных превращений | 2K[Au(CN)2] + Zn = 2Au + K2[Zn(CN)4] |
| Качественные реакции органических веществ с участием аммиакатов | HC ≡ CH + 2Ag(NH3)2OH → AgC≡Cag + 2H2O + 4NH3
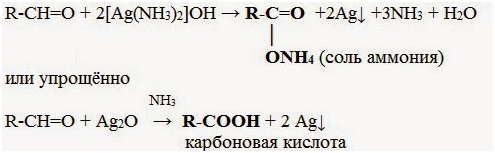 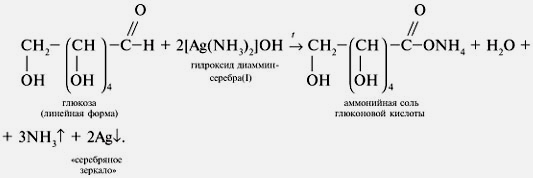
|
Таблица 7. Получение комплексных соединений
| Способ получения | Уравнение реакции |
|
Взаимодействие амфотерных оксидов и гидроксидов с растворами щелочей
|
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] Al(OH)3 + NaOH = Na[Al(OH)4] |
|
Взаимодействие металлов с растворами щелочей (Zn, Al, Be, Sn, Pb)
|
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2 |
|
Восстановление нитратов
|
8Al + 5KOH + 3KNO3 + 18H2O = 3NH3 + 8K[Al(OH)4]
|
|
Взаимодействие гидроксида аммония с водорастворимыми солями, оксидами, содержащими комплексообразователь
|
Cu2O + 4NH3 + H2O = 2[Cu(NH3)4]OH AgCl + 2NH3 + H2O = [Ag(NH3)2]Cl Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 |
|
Взаимодействие солей переходных металлов с избытком раствора щелочи |
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl |
18